中国人群中RHAG 变异对mRNA 剪接影响的体外研究*
2023-11-30贾双双孙明明温机智魏玲罗广平姬艳丽
贾双双 孙明明 温机智 魏玲 罗广平 姬艳丽△
(1.广州血液中心 广州市血液安全重点实验室,广东 广州 510095;2.广州金域医学检验中心有限公司)
Rh 血型系统是最复杂的血型系统之一,迄今为止共发现了54 种抗原,包括一系列具有多态性的常见抗原以及高频和低频抗原。 以往研究发现Rh 系统存在诸多变异型血型,包括RhD 变异型血型、RhCE 变异型血型、D-、Rhmod(Rh血型系统抗原显著减少)及Rhnull(Rh 血型系统抗原完全缺乏)等血型,这些变异型血型个体可存在天然抗体或产生同种抗体,导致严重输血反应及母婴血型不合致死性胎儿新生儿溶血病[1]。 Rh 变异型表型大多数由Rh 血型系统编码基因RHD及RHCE突变所致。 除此之外,因为红细胞膜上Rh相关糖蛋白(RhAG)的存在是RhD 和RhCE 抗原表达的必需条件,其编码基因RHAG的突变,是Rhmod 及Rhnull 稀有表型最常见的分子基础[2-7]。 我们此前在RhD 变异型(弱D 表型)标本中,发现了RHAG突变,表明RHAG突变也可以导致单独RhD 抗原异常表达[8]。
迄今为止,由国际输血协会(ISBT)命名的与Rhmod 表型相关的RHAG突变共有15 种,其中13 种为错义突变,1 种为缺失突变,1 种为影响起始密码子的突变;与Rhnull 表型相关RHAG突变共有27 种,其中12 种错义突变,6 种缺失突变,1 种无义突变,7 种剪接位点突变,1 种剪接位点附近突变[9]。 在我国人群中,却仅有个例Rhmod 表型[10-11](分子基础分别为RHAG*572A 和RHAG*236A 突变型等位基因)和Rhnull 表型相关的报道[12-13](分子基础分别为RHAG*672A和RHAG*534G 缺失突变型等位基因)。 对于可能是通过影响mRNA 剪接的突变,如内含子区域的剪接位点突变或剪接位点附近突变、以及编码区域的同义突变等,可以采用一种剪接异常体外验证实验,即体外微基因剪接系统(minigene splicing assay,MSA)来加以验证。 本研究拟利用现有中国人群全外显子组测序数据库,进行RHAG基因突变分析,以获得我国人群新发现的和已经发现但功能尚不清楚的诸多RHAG基因突变及其分布数据。 并通过体外微基因剪接系统研究剪接位点突变、剪接位点附近突变及位于编码区的同义突变对RHAG基因mRNA 剪接的影响,从而探讨其对Rh 变异型血型的影响。
1 材料与方法
1.1RHAG基因突变数据来源 我国人群中RHAG基因变异数据来源于金域KMxD 数据库,由广州金域医学检验中心有限公司通过对KMxD 数据库中16 049 名中国人群全外显子组测序结果中的RHAG基因进行生物信息学分析和总结后提供。
1.2 试剂与仪器 HEK-293T 细胞(本实验室保存),DMEM培养基(Gibco 公司,批号:8121524),6 孔板(Corning 公司,批号:06622601),定点突变试剂盒(Agilent Technologies 公司,批号:210519),Fugene 转染试剂(Promega 公司,批号:0000469194),RNA 提取试剂盒(Macherey-Nagel 公司,批号:2012/001),RT-PCR 试剂盒(Qiagen 公司,批号:175020740),7500 型PCR 仪、3130 xl 型基因测序仪(ABI 公司)。
1.3 方法
1.3.1 纳入MSA 分析的RHAG基因突变 通过对KMxD 数据库中的RHAG基因数据的初步分析,共发现剪切位点附近突变和同义突变共计35 种,我们从中选择了4 种剪接位点附近突变(c.158-5delT,c.341+3G>A,c.807+3A>C,c.1139-7G>A)及6 种频率相对较高的同义突变(c.312G>A,c.609C>T,c.681G>A,c.861G>A,c.957T>A 和c.984T>C)进行体外微基因剪接系统分析,见表1。
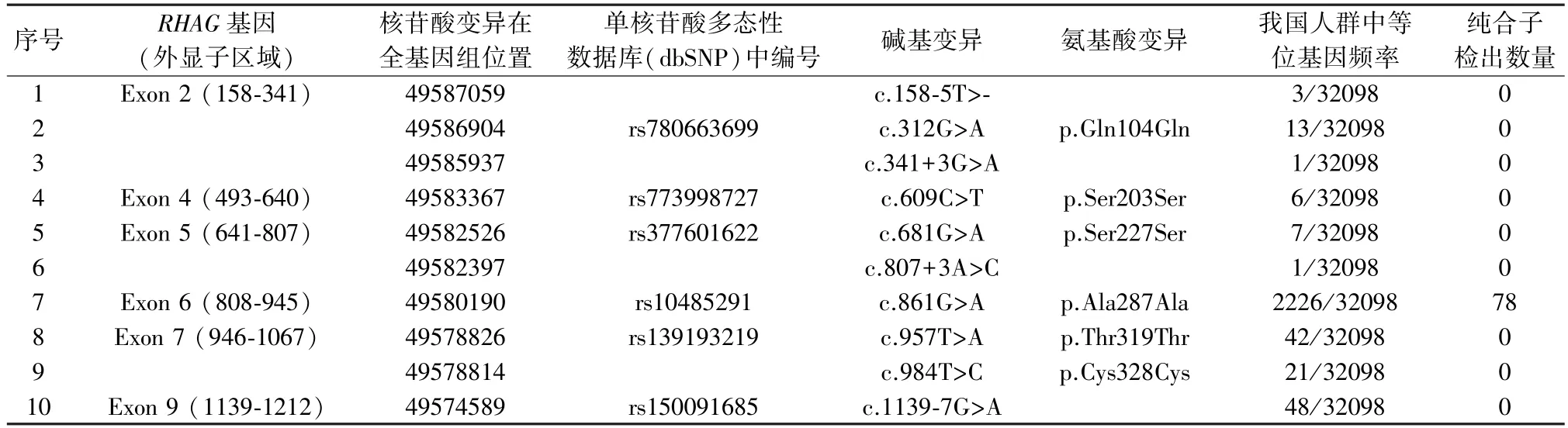
表1 KMxD 数据库中国人群频率相对较高的RHAG 基因剪切位点附近突变和同义突变及其分布频率
1.3.2 构建RHAG微基因表达质粒 委托华大基因公司进行质粒构建,其构建示意图见图1。POLR2G基因全长1 598 bp,共包含3 个外显子。 将POLR2G基因插入到pcDNA3.1质粒的多克隆位点,构建微基因剪接分析系统的质粒载体(pSplicePOLR2G)。 随后将需要分析的RHAG基因的相应外显子及侧翼内含子序列两侧各100~200 bp 插入到上述载体的EcoRI 酶切位点,获得RHAG基因各外显子野生型表达质粒[15]。 在RHAG野生型质粒基础上使用定点突变试剂盒引入碱基突变构建RHAG突变型质粒。
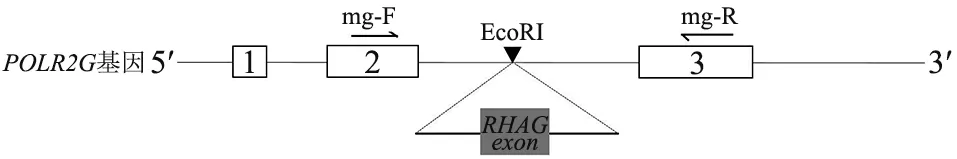
图1 pSplicePOLR2G 载体及微基因剪接系统构建示意图
1.3.3 体外微基因剪接系统分析 参照文献[14]方法,将HEK-293T 细胞以1.75×105/mL 的浓度和2 mL/孔的量铺至6 孔培养板中,置细胞培养箱中培养。 次日按照转染试剂盒说明书,将RHAG基因相应外显子的野生型及突变型质粒分别转染HEK-293T 细胞,并以pSplicePOLR2G空载体质粒转染HEK-293T 细胞作为对照。 转染48 h 后,收集细胞提取总RNA。 随后使用POLR2G基因的特异性引物进行一步法RTPCR,其正向引物mg-F 位于POLR2G基因exon 2 上,反向引物mg-R 位于POLR2G基因exon 3 上,引物位置示意图见图1。 对PCR 产物进行2%琼脂糖凝胶电泳检测,120 V 电泳30 min,同时用测序仪对PCR 产物进行毛细管电泳检测。 所有实验均独立进行2 次。 通过比较野生型质粒和突变型质粒的正常转录本百分比来分析基因突变对于剪接的影响。 若突变不影响剪接,那么该重组基因经过剪接后内含子会被切除,形成包含POLR2G_exon 2(部分) +插入的RHAG外显子(全部) +POLR2G_exon 3(部分)的扩增产物;若突变影响剪接,那么插入的RHAG基因片段中原有的剪接位点的剪接效率会部分降低或完全失效,在数量或质量上形成与野生型质粒不同的剪接产物。
2 结果
2.1 琼脂糖凝胶电泳检测结果 对10 种RHAG突变型质粒与相应野生型质粒的RT-PCR 的扩增产物进行琼脂糖凝胶电泳检测,结果见图2。 对于RHAG外显子野生型质粒,扩增片段长度为POLR2G基因部分exon 2 和部分exon 3 的序列(共254 bp),再加上插入的RHAG基因相应外显子的序列。其中RHAG_exon 2 野生型质粒比较特殊,插入的RHAG_exon 2 野生型质粒序列中存在1 个与RHAG_exon 2 剪接位点的剪接效率相当的隐匿剪接位点,导致形成2 种剪接产物,其中较长的剪接产物长度为438 bp(包括pSplicePOLR2G空载体序列254 bp 和RHAG_exon 2 的完整序列184 bp),较短的剪接产物长度为334 bp(包括pSplicePOLR2G空载体序列254 bp 和RHAG_exon 2 的部分序列150 bp)。 其余exon 4、exon 5、exon 6、exon 7、exon 9 野生型质粒的扩增产物长度分别为402、421、392、376、328 bp,均是在pSplicePOLR2G空载体基础上增加了各相应外显子的序列长度。 通过比较野生型质粒与突变型质粒的条带大小及亮度,可以初步判断这10 种突变对剪接的影响并不大。

图2 RHAG 基因突变微基因剪接分析试验的琼脂糖凝胶电泳检测结果
2.2 毛细管电泳检测结果 为了对结果进行定量分析,我们同时也对各突变型及野生型质粒表达的RT-PCR 产物进行了毛细管电泳(图3),并对各标本的正常转录本剪接产物峰图下面积在总峰图下面积的占比进行了计算,结果详见表2。 Exclusion 表示异常转录本峰图下面积;Inclusion 表示正常转录本峰图下面积;SUM 表示异常转录本和正常转录本的总面积;%inclusion 表示正常转录本占总转录本面积的百分比;Ratio =%inclusion (πSNV)/ %inclusion (πwt),表示突变型与野生型质粒表达的正常转录本百分比的比值。 其结果>1,表明该突变增强了原剪接位点的剪接效率,增强了该基因正常转录本的表达;结果<1,表明该突变减弱了原剪接位点的剪接效率,减弱了该基因正常转录本的表达;结果≈1,表明该突变对剪接无影响;结果越接近1 表明对剪接的影响越小。 从表2 中可见c.312A 和c.341+3A 这2 种点突变所致的Ratio 值大于1.4,增强了正常转录本的表达。 而c.609T、c.681A、c.861A、c.957A、c.984C 和c.1139-7A 这6 种突变所致的Ratio 值约等于1,介于0.972~1.097,几乎不影响正常剪接。 剩下的c.158-5delT 和c.807+3C 两种突变轻微减弱了原剪接位点的剪接效率,其Ratio 值分别为0.884 和0.735,但还是以正常转录本为主,因此推测该两种突变对表型并不会产生影响。
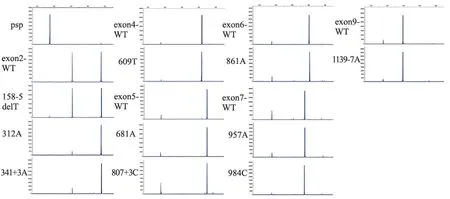
图3 RHAG 基因相应外显子体外微基因剪接分析试验的毛细管电泳结果
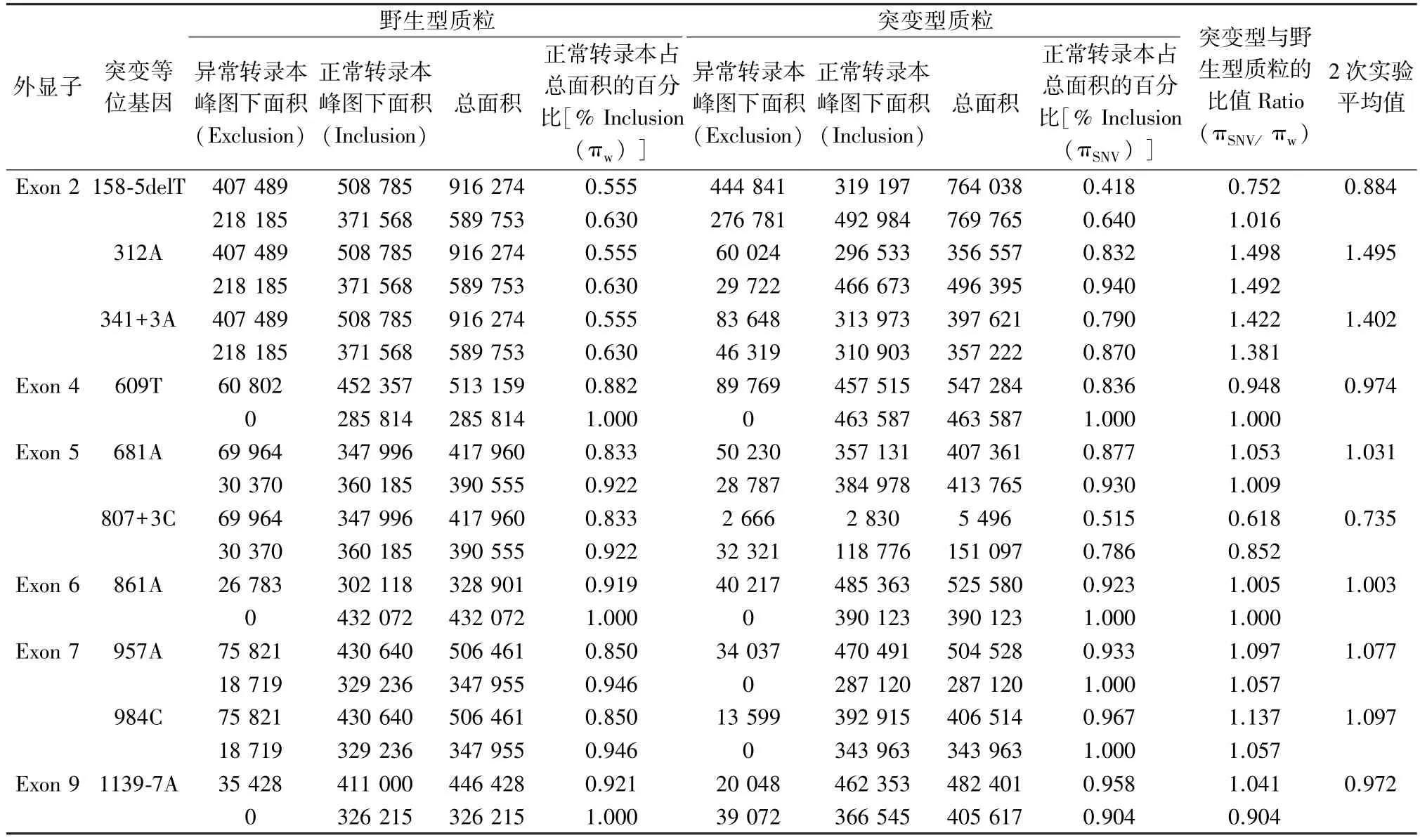
表2 突变型与野生型质粒正常转录本百分比的比较
3 讨论
筛查RHAG基因变异,以往主要是通过收集Rhnull 和Rhmod 个体标本进行RHAG基因分析来获得,但是由RHAG基因变异所致的Rhnull 和Rhmod 表型属于较为罕见的稀有血型,在人群中的分布频率极低,采用筛查方式获得较为困难。 因此本研究利用现有的基于中国人群 的16 000 余份大样本的全外显子组测序数据库,进行RHAG基因变异分析,以获得我国人群新发现和已经发现但功能尚不清楚的诸多RHAG变异及其分布数据。 对于其中可能影响RHAG基因mRNA 剪接的剪切位点和剪接位点附近突变或外显子同义突变,体外最准确的验证方法是通过分离网织红细胞或体外培养先证者有核红细胞,检测红细胞中RHAG基因mRNA 剪接体的表达情况,以证实这些突变对于RHAGmRNA 剪接的影响。 但很多时候难以获得先证者足够的新鲜血液标本进行网织红细胞分离或有核红细胞培养,所以本研究通过体外微基因剪接系统等较为成熟的体外实验方法[15],对可能引起剪接异常的突变进行了体外验证。
一般认为剪接位点[5’-splicing site(SS),及3’-SS,序列分别为CAG/GUAAGU 和NYAG/G]和剪接位点附近突变以及一些发生在外显子编码区的同义突变是导致mRNA 剪接异常较常见的原因[16-17],因此本研究选择了10 种中国人群中频率相对较高的位于RHAG基因剪接位点附近的突变或同义突变,进行了体外微基因剪接系统分析,结果发现只有2种剪接位点附近突变(c.158-5delT,c.807+3A>C)轻微减弱了原剪接位点的剪接效率。 结合ISBT 命名的与Rhmod 或Rhnull 表型相关的RHAG突变中,仅包括1 种剪接位点附近突变(c.640+3del14),未发现同义突变,但剪接位点突变却高达7 种(c.157+1G>A, c.945+1G>A, c.946-1G>A, c.946-1G>T,c.1067+1G>A, c.946-2A>G, c.1139G>T),表明RHAG基因在剪接方面比较保守,除了剪接位点突变会影响RHAG基因mRNA 剪接外,剪接位点附近突变及编码区同义突变较少引起RHAG基因异常剪接。 这可能与RhAG 蛋白在RhD 和RhCE 抗原表达中起重要作用有关。 剪接位点附近突变和同义突变本身并不改变氨基酸及蛋白结构,本研究通过体外微基因剪接系统证明该10 种突变对RHAG基因mRNA 的剪接的影响不大,推测其为正常Rh 表型。 在中国人群KMxD 数据库中,RHAG基因突变虽有一定频率分布,却很少发现有纯合突变,即使有频率较高的纯合突变(c.861G>A),本实验也证明其大概率为正常Rh 表型。 这也许可以解释为何迄今为止中国人群中只发现极少RHAG突变引起Rhmod 表型或Rhnull 表型。
利益冲突:所有作者均声明不存在利益冲突。
