博落回提取物和抗生素联合用药对蛋种鸡自然感染滑液囊支原体的治疗效果分析
2023-11-30王晨燕邵国青
王晨燕,周 峰,邵国青,3,侯 博*
(1.福建省农业科学院畜牧兽医研究所/福建省畜禽疫病疾病防治工程技术研究中心,福州 350013; 2.佛山科学技术学院生命科学与工程学院,佛山 528231;3.江苏省农业科学院兽医研究所,南京 210014)
滑液囊支原体(Mycoplasmasynoviae,MS)是一种禽主要呼吸道病的病原,鸡群感染可引起气囊炎和滑液囊炎。MS可在输卵管中定植[1],产蛋鸡感染MS还可引起产蛋率和蛋孵化率下降,给养禽业带来了很大的困难。MS水平传播的潜伏期为11~21 d[2],垂直传播的潜伏期为6 d[3],鸡群感染MS后可终身带菌。自2010年开始,我国16个省份9 774个多日龄混养肉鸡群中检测出MS感染,MS在种鸡胚胎中的阳性率高达16.29%[4]。Xue等[5]发现,463个未免疫商品鸡群的MS抗体阳性率为80.99%,Gole等[6]发现蛋鸡鸡胚中卵黄抗体的MS阳性率为69%。2009年有报道证实,蛋壳顶端异常(eggshell abonormalities,EAA)与MS感染有关[7],鸡感染从输卵管中分离的MS后更易出现EAA现象[1]。
目前,临床可使用MS活疫苗MS-H株或MS灭活疫苗用于预防感染。活疫苗的使用不仅可以显著降低MS的水平传播速率[8],还可减少气囊损伤和降低EAA蛋的数量[9],然而MS活疫苗的使用要求为必须免疫阴性鸡群,且不论是活疫苗还是灭活疫苗都不能完全阻止MS野毒菌株在气管中的定植[8,10-11]。此外,鸡群感染MS后至少需要3周才能从血清中检测到MS抗体[12],抗体产生时鸡群可能已经大范围感染MS,临床检测已发现肉鸡5周内和蛋鸡4周内存在MS早期感染[4,13-14],这些都给疫苗使用造成严重的困扰。
对于已经感染MS的鸡群临床主要采用药物来控制感染。体外研究表明,MS对部分抗生素敏感[15],其中包括泰万菌素、泰乐菌素、泰妙菌素、替米考星、林可/大观霉素等,抗生素治疗虽很难彻底根除MS感染[16],却可以有效减少气囊炎的发病率。有报道通过多轮交替抗生素治疗可彻底根除MS感染,但花费巨大[17],因而如何正确合理使用抗生素成为MS感染治疗的一大难题。考虑到食品安全问题和按国家法律法规规定,蛋鸡在产蛋期禁止使用抗生素,临床中迫切需要一种可以长期添加且能够预防和治疗MS的药物。血根碱、白屈菜红碱、原阿片碱和别隐品碱作为博落回的主要活性成分,已开发注册为二类新中兽药((2011)新兽药证字34号和(2019)新兽药证字62号),并被国家农业农村部批准可长期在饲料中添加使用,成为饲料添加剂抗生素替代产品之一[18]。有研究报道在雪峰乌骨鸡饲料中添加博落回可显著增加蛋壳的强度和厚度,极显著增加血清中谷胱甘肽浓度,并显著提高黄体酮、促卵泡激素、雌二醇等激素水平[19]。博落回中有效成分血根碱具有抗炎作用[20],可抑制炎症反应的关键调节因子NF-κB的激活[21],同时还显示出对白色念珠菌较强的抗菌作用[22]。此外,血根碱与氨基糖苷类抗生素共同使用具有协同效应,可显著提高细胞内活性氧(reactive oxygen species,ROS)和DNA氧化水平,消除细菌的生物被膜[23]。
本试验通过临床症状观察,上颚裂拭子、输卵管膨大部和子宫部拭子的MS病原检测,血清的MS抗体检测,蛋鸡产蛋数量和蛋品质以及病理切片等研究分析博落回提取物和抗生素联合用药对蛋种鸡滑液囊支原体自然感染病例的治疗效果,为临床MS自然感染提供新的治疗思路和效果评估参考。
1 材料与方法
1.1 蛋种鸡及药物来源
80只117日龄、体重相近的海兰褐父母代蛋种鸡和全价日粮购自国内某种鸡公司,其鸡群在65日龄通过上颚裂拭子采样检测发现MS病原阳性率为52%。
盐酸多西环素、林可-大观霉素、酒石酸泰乐菌素、酒石酸泰万菌素、磷酸替米考星和延胡索酸泰妙菌素均购自国内或进口品牌,博落回散(规格:100 g:3.75 g)和博普总碱散(规格:含原阿片碱和别隐品碱的总量不得少于1.5%,其中原阿片碱不得少于1.0%)均由湖南农业大学曾建国教授馈赠。
1.2 试验试剂
MS抗体检测试剂盒购自BioChek公司;细菌DNA提取试剂盒购自天根生化科技(北京)有限公司;pClone007质粒、TreliefTM5α感受态细胞、2×T5 Fast qPCR Mix(Probe)均购自北京擎科生物科技有限公司;质粒提取试剂盒购自QIAGEN公司;引物和探针由北京擎科生物科技有限公司合成。
1.3 试验设计及采样
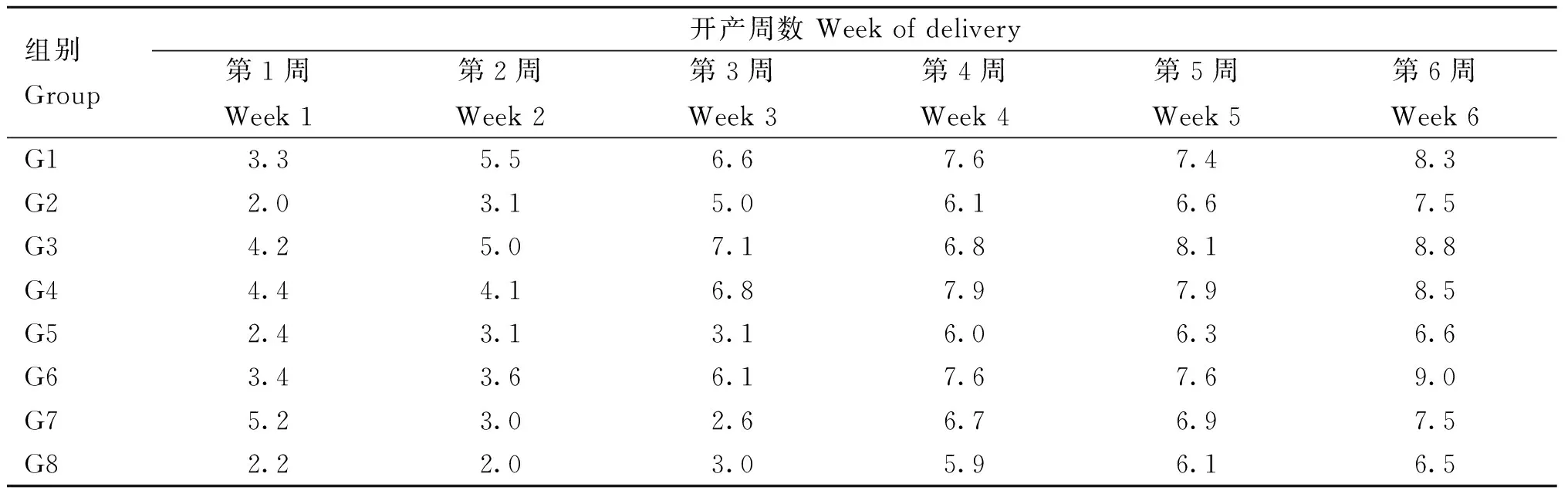
蛋种鸡预饲养7 d后,采用两次随机数法将80只鸡随机分为8个组,每组10只,其中G2组为未处理的对照组,继续正常饲喂,其余各组为用药组,具体用药情况见表1。各组鸡只开产后每天记录产蛋数,并且对开产后第4、5和6周的鸡蛋进行蛋品质测定。
各组分别在用药前(124日龄)以及用药后第17天(140日龄)、第24天(147日龄)、第38天(161日龄)和第59天(182日龄)采集所有鸡的上颚裂拭子;在用药前和用药后第17天(140日龄)、第31天(154日龄)和第59天(182日龄)对所有鸡只翅下静脉采血;用药后第59天(182日龄)处死所有鸡后,剖检观察并记录气囊炎、输卵管炎以及脚垫肿胀的发病情况,并用植绒拭子在输卵管的膨大部和子宫部反复擦拭3次采集拭子样本,同时采集气管、输卵管膨大部和子宫部于10%中性福尔马林中固定。

表1 MS感染用药方法Table 1 The treatment therapies of MS infection
1.4 上颚裂、输卵管膨大部和子宫部拭子MS病原检测
将采集的上颚裂、输卵管膨大部和子宫部的拭子置于含有1 mL PBS的离心管中,混匀成悬液,参照中华人民共和国行业标准《禽支原体PCR检测技术》[24](NY/T 553—2015)的样品处理方式,将悬液2 000 r·min-1,离心5 min;取上清液1 mL置于1.5 mL离心管中,12 000 r·min-1,4 ℃离心30 min,仔细吸取所有上清液弃去,将沉淀采用细菌DNA提取试剂盒提取基因组DNA,-20 ℃保存备用。
MS荧光检测方法参照已发表的文献[13]进行检测,并利用上述引物,以MS FZ株的基因组DNA为模板,将PCR扩增物克隆至pClone007质粒中,并转化至感受态细胞。根据PCR方法扩增选择阳性克隆子,并进行扩大培养,使用QIAGEN质粒提取试剂盒从50 mL菌液中提取质粒,使用NanoDrop 2000分光光度计对获得DNA质粒进行浓度测定和分析。将上述测定浓度的质粒溶液用无核酸酶的水稀释至108拷贝数每4 μL,分装为50 μL·管-1,并对质粒DNA进行10倍连续稀释(107~102),通过Cq值与以10为底取对数(lg)的比值生成标准曲线测定待测样品的载量。同时设置阴性和阳性提取对照品同时提取核酸进行检测,该检测方法的最低检测限为100拷贝数·反应-1。
1.5 MS血清抗体检测
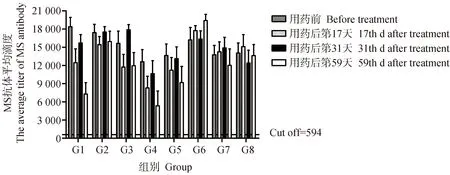
将采集的血液按常规方法分离血清后,采用Biochek MS抗体检测试剂盒,按照说明书对血清样品进行检测,当S/P值≥0.500(抗体滴度≥594),判为MS抗体阳性,否则判为MS抗体阴性。
1.6 产蛋数量与蛋品质测定
开产后直至试验结束,记录开产后第1周至第6周每天的产蛋数,计算各组周日均产蛋数。
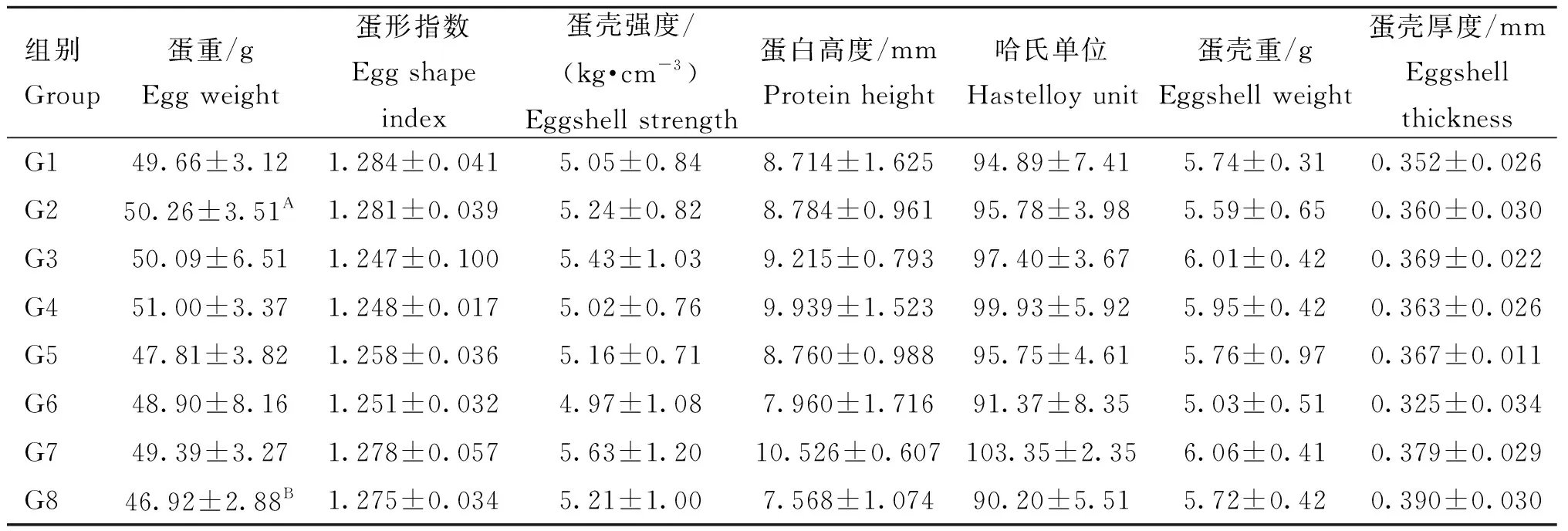
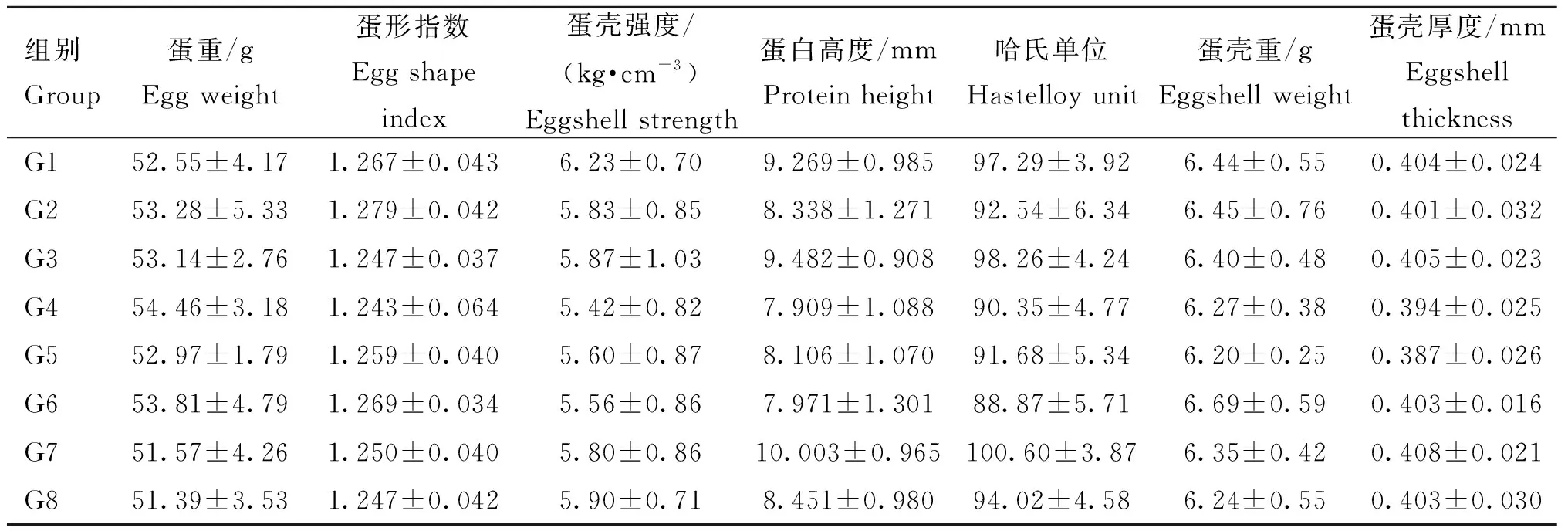
取开产后第4周(162~168日龄)、第5周(169~175日龄)和第6周(176~182日龄)各组所产鸡蛋全部用于检测蛋品质,包括蛋重、蛋白高度、哈氏单位、蛋形指数、蛋壳强度和蛋壳厚度,当天检测完毕。采用美国ORKA蛋品质分析仪(EA-01)测定蛋白高度,重复测定2次,并计算哈氏单位;利用游标卡尺测定鸡蛋纵径和横径,计算蛋形指数;采用北京天翔科技有限公司TENOVO蛋壳强度测定仪(KQ-1A)测定蛋壳强度;使用千分尺测定蛋壳厚度(钝端、中端和尖端);利用电子天平称量蛋重和蛋壳重,其中根据海兰褐2021年新版饲养管理手册中欧洲标准按蛋重(n)范围分别计算小蛋占比率(43 g 将固定的气管、输卵管膨大部和子宫部经酒精脱水、透明、浸蜡、包埋、切片、常规苏木精-伊红染色法(Hematoxylin-Eosin staining,HE)染色,脱水、透明和封固后,在光镜下观察病理损伤情况。 使用GraphPad Prism 5软件对上颚裂拭子载量、血清抗体滴度和蛋品质数据进行单因素方差分析,当P<0.001时,表示差异极显著;当P<0.01时,表示差异显著。 与用药前相比,用药后第17天G4、G6、G7和G8的上颚裂拭子MS病原阳性率下降,最低为G4组(20%),其中G4组相较于G2组上颚裂拭子MS载量极显著下降(P<0.001),G6和G7组相较于G2组上颚裂拭子MS载量显著下降(P<0.01);用药后第24天,G4、G6和G7上颚裂拭子MS病原阳性率开始上升,G1和G8组阳性率分别下降为90%和70%,其中G4组相较于G2组上颚裂拭子MS载量显著下降(P<0.01);用药后第38天,G1、G5和G8组的上颚裂拭子MS病原阳性率开始上升。G3组上颚裂拭子MS病原阳性率用药后无变化。结果表明:单独使用博落回提取物或博落回提取物联合抗生素可在一段时间内降低自然感染MS的鸡群上颚裂拭子载量和病原阳性率,具体结果见表2。 表2 上颚裂拭子MS阳性率及载量Table 2 MS positive rates and loads of cleft palate swabs 各组血清在用药前的MS抗体平均滴度均高于12 000,各组间无显著差异(P>0.05),且各组在用药前以及用药后第17天、第31天和第59天的MS抗体平均滴度均不存在显著差异(P>0.05)。用药后第59天,G1和G4组的MS抗体平均滴度相较于用药前下降约60%,其中G4组有1只鸡的血清抗体检测为阴性。结果表明:鸡群自然感染MS采用博落回提取物或博落回提取物联合抗生素治疗可在一段时间内降低MS抗体滴度(图1)。 图1 用药前、后血清MS抗体平均滴度结果Fig.1 The result of average titer of MS antibody from serum before and after treatment 用药后第59天,剖检观察发现G1、G3、G4、G6和G7组没有肉眼可见的输卵管病变(图2C),G2组观察到1只鸡右侧输卵管囊肿(图2A);G5和G8组各有1只鸡右侧卵泡发育不全,输卵管长度变短(图2B)。G2和G6组分别观察到1只鸡有气囊炎,其中G2组腹气囊增厚,G6组除腹气囊增厚外,胸骨还出现明显囊肿,其余各组鸡只均未观察到有气囊炎。此外,各组均未观察到脚垫肿胀(表3)。 表3 输卵管炎、气囊炎和脚垫肿胀发病率Table 3 The morbidities of salpingitis, air sacculitis and swelling of foot pad 用药后第59天,各组的输卵管子宫部拭子均未检测到MS病原,G2、G4、G5、G7和G8组的输卵管膨大部拭子检测到MS病原,阳性率最高为G2组和G8组(20%),G4、G5和G7组均为10%,其他组均未检测到。结果表明可从输卵管膨大部中检测到MS病原(表4),这或许是造成MS垂直传播的原因。 各组气管黏膜固有层均可见不同程度的炎性细胞浸润(图3A),输卵管的膨大部和子宫部的组织结构正常(图3B、3C),未见变性、坏死等病理变化,结果表明MS感染没有对输卵管造成明显病理损伤,各组气管表现明显病理损伤。 表4 输卵管膨大部和子宫部拭子MS病原阳性率Table 4 The positive rates of MS antigens in the swabs of magnum and uterus of oviduct A. 气管,箭头指示有炎细胞浸润;B.输卵管膨大部;C. 输卵管子宫部A. Trachea, arrow indicated inflammatory cellular infiltration; B. Magnum of oviduct; C. Uterus of oviduct图3 气管、输卵管膨大部和子宫部的组织病理学损伤Fig.3 Histopathologic lesions in trachea and the magnum and uterus of oviduct 各组周日均产蛋数均随开产周龄增加而增加,增加幅度有所差异。开产后第1周,G2组每周日均产蛋数相较于其他处理组最少,仅为2枚。开产后第4周,各组周日均产蛋率均超过50%。开产后第6周,G1、G3、G4和G6组的周日均产蛋数已增至8枚以上,最高为G6组9枚;G2和G7组均为7.5枚;G5和G8组最少,分别为6.6和6.5枚。结果表明G1、G3、G4和G6组用药后相较于G2组周日均产蛋数随开产周龄增加而明显增加,开产后具体产蛋数量见表5。 表5 开产后各组周日均产蛋数Table 5 Average daily egg production per week for each group after delivery 枚 产蛋后第4 周,G8组的平均蛋重显著低于G2组(P<0.01),其余各组产蛋后第4、5和6周蛋品质均无明显差异,具体结果见表6、7和8。 各组的中蛋相对丰度占比随产蛋周龄增加而增加,产蛋后6周内没有任何一组出现大蛋。产蛋后第4周,G4和G6组的中蛋占比最高,但不超过30%;产蛋后第5周,G2、G4、G5和G6组的中蛋占比最高,约50%;产蛋后第6周,G4组的中蛋占比最高为60%。G1、G7和G8组在产蛋后第4、5和6周,中蛋占比均没有超过50%(图4)。 表6 产蛋后第4周的蛋品质测定Table 6 The egg quality at 4th week after laying 表7 产蛋后第5周的蛋品质测定Table 7 The egg quality at 5th week after laying 表8 产蛋后第6周的蛋品质测定Table 8 The egg quality at 6th week after laying 图4 产蛋后第4(A)、5(B)和6周(C)的不同蛋重相对丰度占比Fig.4 The proportion of relative abundance of different egg weights at 4th (A), 5th (B) and 6th (C) week after laying 自2010年开始,国内鸡群陆续开始出现MS感染情况,临床主要表现为呼吸道症状和关节炎[25]。前期通过对2018~2020年福建省内未免疫鸡群感染调查发现,MS病原和抗体阳性率随日龄增加而增加[13]。有研究表明,多日龄混养较全进全出鸡群饲养更易出现MS感染[26]。本试验动物为商品化的蛋种鸡群,来源于多日龄混养的鸡场,鸡群65日龄通过上颚裂拭子检测发现MS病原阳性率为52%,用药前MS感染率至少80%,并且具有较高水平的MS载量,MS抗体阳性率全群为100%,抗体滴度均超过12 000,属于MS自然感染较长时间且较为严重的蛋种鸡群。用药后第59天,G2组即无处理组通过剖检观察存在10%输卵管炎和10%气囊炎,但未发现有脚垫肿胀,表明上颚裂拭子检测出阳性并未100%表现出明显的临床症状,提示临床未表现出气囊炎或输卵管炎的鸡也可能存在MS感染。用药后第59天输卵管子宫部拭子均未检测出MS,G2组在输卵管膨大部拭子中检测出20%阳性率,提示临床可以在输卵管膨大部采集拭子进行MS病原检测,病理结果表明MS感染未造成对输卵管膨大部和子宫部的病理损伤,结果与其他报道一致[1],提示输卵管膨大部的MS病原存在可能是造成MS垂直传播的原因。部分鸡虽未表现出临床症状,但MS感染可造成气管出现明显病理损伤,增加了其他病原的易感性,临床应重视MS感染对鸡群的危害。此外,MS具有较强的水平传播能力,有研究报道MS菌株可在气管中检测到,但不是所有MS菌株都能在输卵管中定植[1],不同MS菌株具有不同组织嗜性,本研究根据拭子病原检测结果发现,G2组出现输卵管炎、气囊炎及膨大部检测为阳性的鸡并不是来源于同一只鸡,然而上颚裂拭子检测均为阳性,推测该试验鸡群有可能感染了具有呼吸道或生殖道不同组织嗜性的MS菌株。 采用最低抑制浓度(minimum inhibitory concentration,MIC)分析发现,MS国内分离株对大环内酯类抗生素和林可/大观霉素较为敏感[27],Morrow等[15]同样发现,MS亚洲分离株对泰乐菌素、泰妙菌素和四环素类抗生素较为敏感,对替米考星的耐药性增加,MS体外连续传代10代可获得对红霉素和泰乐菌素的高水平耐药性[28]。中兽药博落回含有血根碱和白屈菜红碱等有效生物碱成分,体外试验表明这两种生物碱可对耐甲氧西林和多重耐药的金黄色葡萄球菌具有一定的生长抑制作用[29],博落回可长期在饲料中添加且没有休药期,更适合产蛋鸡使用。本试验选取临床常用以及对MS较为敏感的抗生素,并首次将博落回提取物和抗生素联合使用,开展动物体内试验分析药物对蛋鸡群MS自然感染的治疗效果。通过对上颚裂拭子的病原检测发现,抗生素联合博落回提取物可显著降低MS载量,该结果同单独使用抗生素效果一致[30],然而用药后第38和59天上颚裂拭子的MS载量开始恢复用药前的感染水平。有研究表明MS可黏附并侵入宿主细胞,这可能是抗生素治疗很难根除MS感染的原因[16]。Stanley 等[31]通过血凝抑制(hemagglutination inhibition,HI)试验检测发现,MG的HI抗体降低约40%左右,表明采用恩诺沙星治疗鸡毒支原体(Mycoplasmagalliscepticum,MG)感染有效。本研究通过血清抗体检测发现,G1组和G4组用药后第59天的抗体滴度较用药前下降60%左右,令人意外的是,G4组有1只鸡抗体转为阴性,同时,G4和G6组有1或2只鸡用药前上颚裂拭子检测MS为阳性鸡转为阴性,表明联合使用博落回提取物和抗生素对治疗MS感染有效,因此在临床生产实践中用药后应定期监测至少6周的血清MS抗体水平和至少4周的上颚裂拭子MS病原阳性率,考虑以抗体滴度和病原阳性率下降对用药效果进行分析。 有证据表明蛋鸡感染MS可引起产蛋量下降[1,32],短时间抗生素使用如泰乐菌素可暂时提高产蛋量[33],本研究蛋鸡群在药物使用后第17天开产,各组鸡只的产蛋量都随着产蛋周龄增加而增加,其中G1、G3、G4和G6组通过药物治疗在开产后的周日均产蛋量都较G2组高,用药组与无处理组的周日均产蛋量不存在显著差异,药物治疗对于产蛋量的影响仍然需要大规模的饲养试验进行验证。MS感染还可出现EAA蛋[33],用扫描电子显微镜检查可见蛋壳钙化区的乳头层缺失以及内蛋壳膜增厚,对蛋品质有影响,特别表现在蛋壳强度和蛋壳厚度[7],有报道产蛋后第55周开始在鸡蛋中观察EAA现象,蛋破损率增加[34],此外,鸡群感染MS不一定能出现EAA现象,但是从输卵管中分离得到的MS重新感染鸡后更易出现EAA现象,一旦有传染性支气管炎病毒(infectious bronchitis virus,IBV)感染,EAA现象加重[7]。本研究中试验鸡未达到产蛋高峰,尚未观察到EAA蛋现象,这可能与饲养周期较短或感染的菌株不同而有关,或许也与未有其他致病因素协同相关。尽管各组蛋重差异不显著(除第4 周的G2和G8组),但通过对不同蛋重相对丰度占比进行统计发现各组存在差异,G4组的中蛋比率相较于其他组更高(60%),推测MS感染可能出现蛋重或蛋大小参差不齐,但不排除是否有其他病原影响,需要在生产实践中引起重视。 综上所述,MS感染可在输卵管膨大部中定植,但并未造成病理损伤,单独使用博落回提取物或者抗生素和博落回提取物联合使用可降低上颚裂拭子MS病原载量和阳性率,以及血清中MS抗体滴度,同时产蛋前期周日均产蛋数明显增加,抗生素和博落回提取物联合使用还可提高中蛋的相对丰度。因此,生产实践中在产蛋前合理单独使用博落回提取物或者博落回提取物和抗生素联合使用,产蛋期持续使用博落回提取物可改善MS感染对蛋种鸡产蛋前期生产性能的影响。1.7 病理切片
1.8 统计分析
2 结 果
2.1 上颚裂拭子MS载量

2.2 血清MS抗体检测
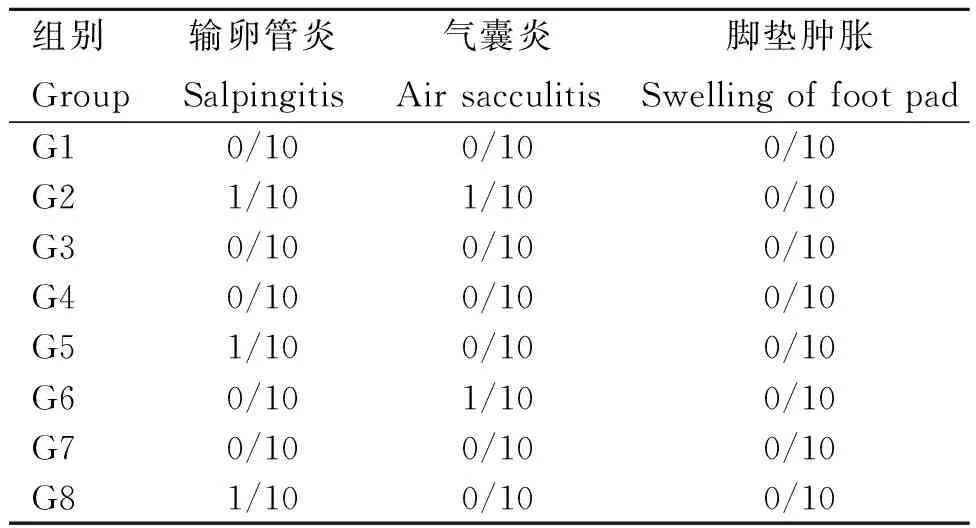
2.3 剖检症状
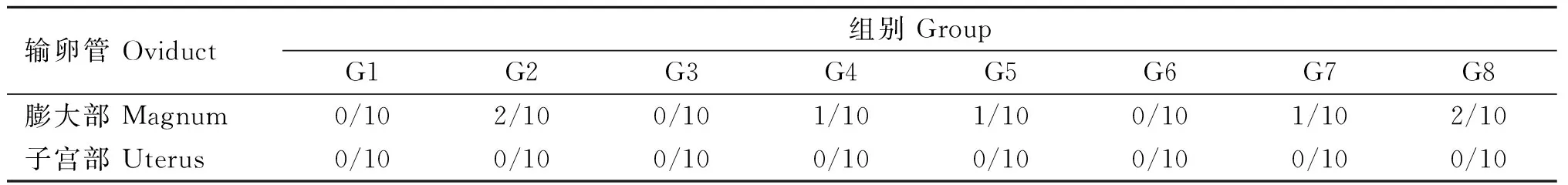
2.4 输卵管膨大部和子宫部拭子MS病原检测
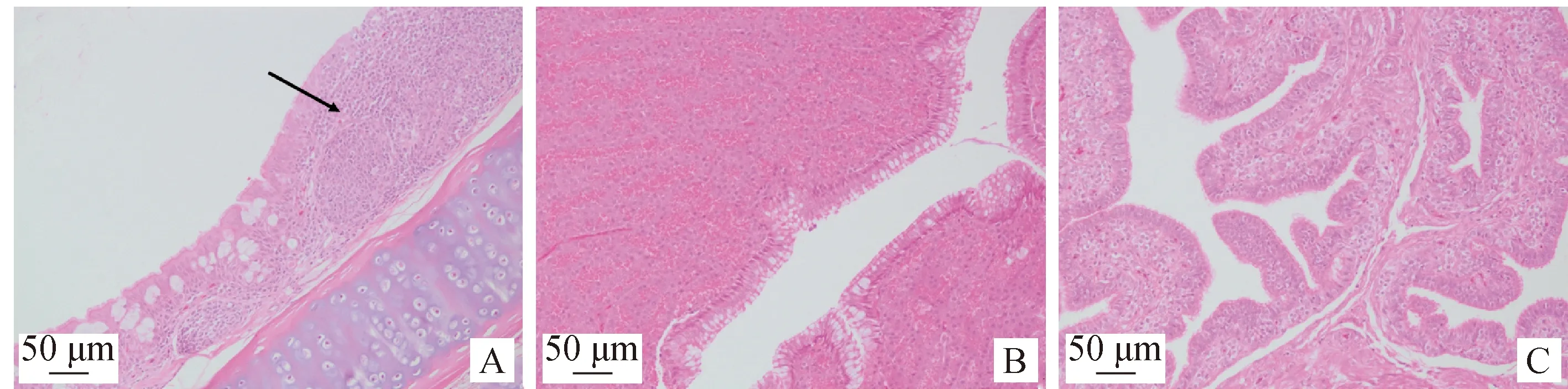
2.5 病理变化
2.6 周日均产蛋数
2.7 蛋品质测定


3 讨 论
4 结 论
