复合改良剂强化博落回修复锰矿渣的机理
2022-04-29何浪君陈永华苏荣葵王佳昕张奥姗朱虹红
何浪君,陈永华,苏荣葵,蔡 斌,王佳昕,张奥姗,朱虹红
(中南林业科技大学 环境科学与工程学院,湖南 长沙 410004)
中国锰矿资源丰富,分布广泛,其中以湖南、广西最为丰富,占全国总储量55%[1]。锰是植物必需的生长元素,适量的锰能促进植物生长,但过量的锰将对植物产生毒害[2]。锰矿的大量开采,使得锰污染问题日益严重[3]。因此,如何降低锰矿区污染成为亟须解决的问题[4]。重金属污染土壤修复是指使用物理、化学和生物方法从土壤中去除或固定重金属,以此降低其迁移性和生物有效性,稳定重金属污染物[5]。生物修复技术中的植物修复是指利用植物来降解、提取或固定重金属污染物,因其具有低成本、高效益的优点,成为主要修复手段[6]。目前,已知大部分锰超累积植物不但生物量低,修复效率不高,且几乎没有经济价值,不宜推广[7]。因此,筛选耐锰性强、生物量大和经济价值高的植物,已成为锰矿区植物修复的关键。
博落回Macleaya cordata属多年生草本植物,其生态适应性强,抗旱、耐瘠,并且含有多种可以药用的博落回提取物生物碱,有较高的经济价值[8]。有研究表明博落回对Mn 有一定的富集能力[9]。然而,在矿渣上种植的植物通常受到矿渣理化性质差的限制,使植物成活率低,生物量小[6]。近年来,有研究发现加入改良剂能有效改善矿渣的理化性质,降低重金属的危害[10]。在锰矿渣改良剂筛选与应用研究中主要是无机物与有机物两大类,无机改良剂可以固定矿渣中的锰,其施加过多则存在降低矿渣肥力的可能性,而有机改良剂可以改善矿渣中的肥力,持续强化矿渣修复[11]。有研究表明有机改良剂蘑菇渣与无机改良剂凹凸棒进行复合配比,能充分发挥复合改良剂中有机与无机改良剂各自的优势,锰矿的植物修复效果将得到显著提高[11-12]。因此采用有机改良剂蘑菇渣与无机改良剂凹凸棒进行复合配比联合多年生草本植物博落回修复锰矿渣具有十分广阔的应用前景。但是,该复合改良剂与博落回对锰矿渣的联合修复机制尚不清楚,需要进一步研究。
因此,本研究以博落回为供试植物、锰矿渣为基质、蘑菇渣和凹凸棒为复合改良剂进行盆栽试验,研究了改良条件下博落回对锰的耐性、转运与富集效应,锰在博落回体内细胞的分布情况和化学形态,博落回的生理生化、微观结构与官能团,旨在为将博落回应用于修复锰矿污染土壤提供理论依据。
1 材料与方法
1.1 材 料
博落回采自邵阳隆回县博落回种植基地,锰矿渣来源于湘潭某锰矿,有机改良剂蘑菇渣、无机改良剂凹凸棒、基肥钙镁磷肥均购置某肥料生产厂家。
1.2 方 法
1.2.1 试验设计
基质设为红壤+10%(蘑菇渣∶凹凸棒=3∶1)为R、锰矿渣为M、锰矿渣+10%(蘑菇渣∶凹凸棒=3∶1)为M+,3 种基质加入3%的基肥钙镁磷肥当作肥料,3 种基质设置12 个重复。选取植株大小、长势一致的博落回幼苗进行盆栽试验,种植在装有3 种基质的花盆里。2020年5月种植,11月取样待测。不同基质的基本理化性质如表1所示。

表1 3 种基质基本理化性质†Table 1 Physicochemical characterization of three substrates
1.2.2 样品的采集与分析
1)博落回预处理
采集培养6 个月后的博落回,用超纯水清洗,分别剪取博落回的根、茎、叶并称其鲜质量,备用[13]。
2)Mn 含量测定
将博落回样品70℃烘干48 h。在微波消解装置中,用HNO3-HClO4的混合酸(4∶1)消解所有样品,并使用火焰原子吸收分光光度计(FAAS,AA-7002,Thermo Fisher Scientific,USA)测量Mn 浓度。
3)化学形态分析
博落回中锰的化学形态[14]:一是用80%乙醇(FE)提取无机形态;二是H2O(FW)提取有机形态;三是用1 mol NaCl(FNaCl)提取的果胶和蛋白质形态;四是用2%HAc(FHAc)提取的未溶解的磷酸盐形态;五是用0.6 mol HCl(FHCl)萃取草酸盐形态。六是Mn 残留态。
4)亚细胞组分重金属含量测定
采用差速离心法分离出博落回细胞各组分,采用“硝酸-高氯酸”电热板消解法消解,火焰原子吸收分光光度计测定博落回各组分浓度[15]。
5)生理生化指标测定
用分光光度计法(UV-5100 紫外可见分光光度计)测定叶绿素的含量[16]。下列指标测定时间分为前中后3 期,前期测定于7月份进行,中期测定于9月份进行,后期测定于11月份进行,每次测量间隔2 个月。用硫代巴比妥酸法测定丙二醛(MDA)含量[17];用考马斯亮蓝法测定可溶性蛋白的含量[17];用氮蓝四唑超氧化物歧化酶(SOD)[17];用愈创木酚氧化法测过氧化物酶 (POD)[17];用紫外吸收法测过氧化氢酶 (CAT)活性[17]。
6)微观结构分析
沿叶片主脉两侧切成长2~3 mm,宽1 mm的条形小块,放入2.5%的戊二醛溶液固定。通过扫描透射电子显微镜观察植物根,茎和叶的微观结构[18]。该检测由科学指南针公司完成。
7)官能团分析
用傅里叶变换红外光谱仪(FTIR)测量官能团组成。干燥后的样品经过200 mm 网筛后送科学指南针公司检测。
1.3 数据分析
数据均为平均值±标准差,用Excel 2010 处理基本数据,用SPSS19.0 进行数据统计分析,用Origin 8.5 制作图表。耐性指数(TI)为M 和M+处理下博落回株高、根长、生物量与R 处理下相应数值的比值。
2 结果与分析
2.1 改良锰矿渣对博落回生长的影响
不同基质处理组的博落回生长情况如表2所示,与R 处理组相比,M 处理下的博落回生物量、株高、总根长的数值均明显减少,说明Mn 胁迫严重抑制了博落回的生长。而M+处理下,博落回的生物量为5.96 g,株高为94.10 cm,根长为518.84 cm,生长量比起M 处理组明显提高,甚至略微高于R 处理组,博落回的生长得到改善。从其耐性指数可以看出,M+处理组的博落回对锰矿的耐受性是M 处理的1.77 倍,说明加入复合改良剂使博落回对锰矿的耐受性提高。

表2 3 种基质处理下博落回的生长情况Table 2 The growth of Macleaya cordata under the three treatments
2.2 改良锰矿渣对博落回叶片叶绿素的影响
表3为3 种基质处理下的博落回叶片的叶绿素含量。在M+处理下博落回的叶绿素a、叶绿素b 和叶绿素总量浓度的数值与M 处理组相比有明显增加。同时,叶绿素a、叶绿素b、叶绿素总量、叶绿素a/b 值均呈现R>M+>M 的趋势,说明Mn 胁迫下博落回叶片中的叶绿体受到损伤,使叶绿素a/b 降低,光合效率降低,从而加速了博落回叶片的黄化。而添加复合改良剂后博落回叶片的叶绿素总量、叶绿素a/b 值的增加表明改良后能有效缓解Mn 胁迫对博落回叶片的损害,减缓了叶片的黄化。

表3 3 种基质处理下博落回叶片的叶绿素含量Table 3 Chlorophyll contents of Macleaya cordata leaves under three substrate treatments
2.3 改良锰矿渣对博落回叶片的生理生化响应
观察图1可见不同基质处理下博落回叶片的可溶性蛋白、MDA、CAT、SOD 和POD 的变化趋势。从图中可以看到,M 处理组中的博落回叶片可溶性蛋白的含量在前、中、后期呈现逐渐增加的趋势,而在M+处理组的可溶性蛋白含量在中后期则呈现为先升高后下降的变化趋势。在前、中、后期,R 处理组与M+处理组中博落回叶片的MDA 均无明显差异,而随着时间的推移,M 处理组的MDA 呈现逐渐上升的趋势。在前、中、后期,R 处理组与M+处理组中博落回叶片的CAT 活性无明显变化,而M 处理组随着时间的推移CAT 活性呈现逐渐降低的趋势,在后期比前期降低了33%;3 种基质处理组的POD 活性表现出明显的差异,且随着时间的推移,M 与M+处理组的POD 活性均呈现先升后降的趋势。与POD 的变化类似,3 种基质处理组的SOD 活性随着时间的推移,M 与M+处理组均呈现先升高后下降的趋势。在前、中、后期,R 处理组与M+处理组中博落回叶片的MDA 均无显著性差异,而随着时间的推移,M 处理组的MDA 呈现逐渐上升的趋势。
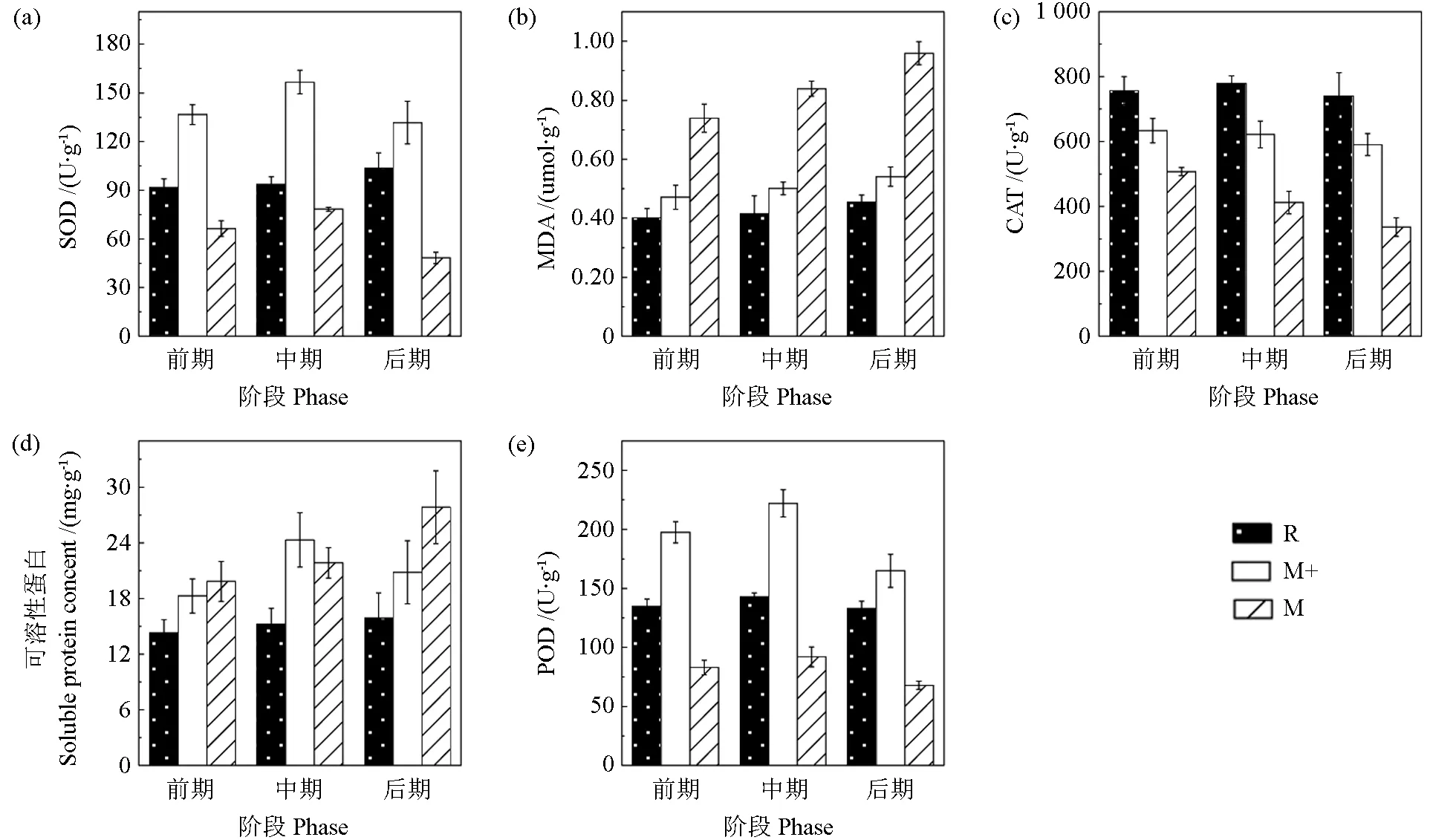
图1 3 种基质处理下博落回叶片内SOD(a)、MDA(b)、CAT(c)、可溶性蛋白(d)和POD(e)的变化Fig.1 The SOD (a),MDA (b),CAT (c),soluble protein contents (d) and POD(e) activities of Macleaya cordata leaves in the three treatments
2.4 锰在博落回根、茎、叶中的亚细胞分布和化学形态分析
2.4.1 锰在博落回根、茎、叶中的亚细胞分布
从不同基质处理下Mn 在博落回根、茎、叶内亚细胞组分分布情况(图2)中可以看出,博落回根、茎、叶中Mn 主要集中分布在细胞壁中,其次是可溶性部分,然后是细胞器组分,表明细胞壁在博落回耐锰性上起主要作用。与M+处理相比下,在M 处理中,博落回根、茎、叶中细胞壁组分F1 所占比例明显降低,由65%、55%、61%分别降至42%、25%、28%。而可溶性组分F3 所占比例则显著增加,由27%、35%、29%分别增加至38%、55%和54%。细胞器组分F2 所占比例依次增加10%、9%和8%。

图2 3 种基质处理下博落回根茎叶内亚细胞分布情况Fig.2 Distribution of subcellular components of Mn in roots,stems and leaves of Macleaya cordata seedlings in the three treatments
2.4.2 锰在博落回根、茎、叶中的化学形态
从3 种基质处理下Mn 在博落回根、茎、叶内化学形态(图3)中可以看出,博落回根中的Mn以氯化钠提取态为主,与M+处理组相比,M 处理组的氯化钠提取态占比增加了14%,而醋酸提取态占比减少7%。博落回茎中的Mn2+主要呈氯化钠提取态和醋酸提取态,在M+处理组中,其占比为51%和18%;而在M 处理组中,氯化钠提取态降低至34%,醋酸提取态增加至32%。在博落回叶中,Mn2+主要为水提取态和氯化钠提取态,与M+处理组相比,M 处理组的水提取态占比减少了11%。

图3 3 种基质处理下博落回根茎叶内化学形态分布情况Fig.3 Distribution of chemical forms of Mn in roots,stems and leaves of Macleaya cordata seedlings in the three treatments
2.5 锰胁迫下根、茎、叶微观结构的变化
观察3 种基质处理下博落回根、茎、叶的透射电镜(TEM)结果(图4)可以看出:在R 处理下,博落回中根、茎、叶内的细胞结构完整;博落回叶片中的叶绿体排列整齐,形状呈现梭形,叶绿体内的片层结构排列有序。在M 处理下,博落回的根、茎、叶细胞受损严重,大部分细胞器呈解体状态流出在细胞间隙;叶片中的叶绿体形状膨胀成球形,其中片层排列紊乱;淀粉粒颗粒和线粒体数量与对照相比明显减少,嗜饿颗粒却变大增多;细胞壁周围及细胞间隙出现大量黑色物质,有可能是重金属沉淀[12]。在M+处理下,博落回根、茎、叶的细胞结构相对完整,细胞器与对照比相对减少,叶片中的叶绿体结构未发生明显变化,淀粉粒却增多,细胞间隙有少量黑色物质出现。

图4 3 种基质处理下博落回根茎叶的微观结构Fig.4 Pictures of root,stem,and leaf cells of Macleaya cordata seedlings in the three treatments via TEM
2.6 改良锰矿渣对博落回组织官能团的影响
从不同基质处理下Mn 胁迫对博落回根、茎、叶的傅里叶红外光谱图谱变化(图5)可以看出,图中的特征峰包括3 422、2 920、1 640、1 035 cm-1这4 处特征峰,其中3 422 cm-1处的吸收峰表示的自由羟基的伸缩振动峰主要来自博落回中纤维素、多糖等碳水化合物;2 920 cm-1处的吸收峰表示的是羧基与甲基伸缩振动重叠峰,主要来自于博落回中维生素和各种膜与细胞壁的组织等成分;1 640 cm-1处的吸收峰表示的N-H 酰胺弯曲振动峰是博落回中蛋白质的特征红外光谱;1 035 cm-1处的吸收峰表示的是醇、酯基和酚类的C-O 基团的伸缩振动峰[19]。博落回根部发现,3 422、2 920、1 640、1 035 cm-1这4 处峰值在博落回根中在不同基质的峰形无明显变化。而博落回茎和叶部的官能团在3 422、2 920、1 640、1 035 cm-1这4 处的吸收峰发生明显偏移。在M 处理下,博落回茎部和叶部3 422 cm-1、2 920 cm-1、1 640 cm-1、1 035 cm-1处的吸收峰与R处理组相比,发生了明显偏移,同时此处吸收峰的峰形变窄,透过率变高;而M+处理组中博落回茎和叶部的这四处吸收峰与M 处理相比峰形均变宽,透过率下降。

图5 3 种基质处理下博落回根、茎、叶官能团的影响Fig.5 FTIR analysis of Macleaya cordata roots,stems and leaves in the three treatments
3 结论与讨论
前期课题组筛选出了复合改良剂(有机改良剂蘑菇渣和无机改良剂凹凸棒),可通过无机改良剂凹凸棒吸附锰矿渣中的重金属,并结合有机改良剂蘑菇渣改善锰矿渣中的肥力,提高植物修复效果[11]。试验结果表明,添加复合改良剂后的锰矿渣,其孔隙度和有机质浓度数值相比起锰矿渣明显增加,这表明复合改良剂的加入可以使锰矿渣变疏松,提高锰矿渣的渗透性和肥力,为博落回提供更好的生长条件。M+处理组中的锰的有效态含量显著降低,表明改良剂的加入对矿渣里的锰产生钝化效果。同时,M+处理组的博落回的株高、生物量、根长的数值与M 处理组相比明显升高,这表明添加复合改良剂可以促进博落回在锰矿渣中的生长,减缓锰对博落回的毒性,提高博落回对锰的耐受性。
叶绿体中叶绿素含量会影响博落回的生长和发育[20]。在本试验中,M处理下,博落回中叶绿素a,b 的浓度与R 相比明显降低,这可能是由于Mn 胁迫下博落回叶片中叶绿体或叶绿素酶的活性受到了抑制[21]。同时,博落回叶片叶绿素a 与叶绿素b 的比值明显降低,说明博落回叶片叶绿体结构受到严重破坏。叶绿素含量下降可能是博落回受到Mn 胁迫后,Mn 结合叶绿体中蛋白质的巯基,抑制了其叶绿素的合成[22],也可能是Mn 胁迫下活性氧的增加,使博落回中叶绿体的结构与功能遭到损伤[23]。然而,M+处理组博落回叶中的叶绿素a、b 的浓度明显高于M 处理组,表明改良剂的加入降低了重金属胁迫下叶绿素的损伤。
MDA 通常用来反映细胞膜的损伤程度。与M+处理组相比,M 处理组博落回中MDA 含量明显增加,表明博落回细胞受到Mn 胁迫出现明显的膜脂过氧化反应,导致其细胞膜受损,细胞内渗透压失去平衡[21]。而改良剂的加入,可以减少细胞膜的损伤,缓解细胞内的渗透压失衡,降低了对博落回的伤害程度。M+处理组可溶性蛋白的浓度在前、中、后期呈现先升后降的趋势,这可能是中期锰胁迫促进博落回体内糖和蛋白的合成代谢,以满足生长所需的营养物质,这也可能是博落回抵抗锰毒害的一种自我保护机制[4]。而后期可能由于改良剂加入改善土壤环境使博落回适应了环境的改变,因此总蛋白下降。在本研究中,矿渣中过量的锰抑制了博落回叶片的生长,这可能与反应氧的种类有关[24]。Mn 诱导氧化应力并增加ROS 量,ROS 主要产生在叶绿体、线粒体;细胞中过量的ROS 会引起脂质过氧化、膜损伤,影响细胞代谢和植物的生长[25]。植物可以通过提高SOD 酶活性激活抗氧化防御系统以应对Mn 胁迫引起的ROS 含量增加。与M 处理组相比,M+处理组的SOD 的活性明显增加,表明改良剂的加入提高了SOD 的活性,降低了ROS 的含量,进而降低了锰对植物的毒性。POD 和CAT 可以催化H2O2生成H2O,从而缓解H2O2的增加。在前中后期,在M+和M 处理中CAT 的含量逐渐降低,而在M+和M 处理中,POD 活性高于CAT 活性,表明POD在去除H2O2中起作用。与M处理组相比,M+处理组的POD 的活性明显增加,表明改良剂的加入提高了POD 的活性,降低了H2O2的含量,减少了锰对植物的毒性。一般来说,添加改良剂可以调节渗透压平衡和抗氧化酶的活性,以去除由Mn毒性产生的ROS,然后降低脂质过氧化作用。这种解毒措施可以保护原叶细胞免受毒性,并维持植物生长的正常生理代谢活动。
图2中发现,在M+和M 处理组中,博落回根茎叶中的锰主要分布在细胞壁,这表明博落回通过其细胞壁的固持作用固定Mn,从而可避免过多的Mn 进入细胞体内,减轻Mn 对博落回的毒害作用[26-27]。在M 处理中,在博落回茎、叶的可溶性组分占比分别增加了35%和29%,这表明茎、叶中液泡的区隔作用明显增强,这有利于Mn 向叶片转运,降低重金属的毒性。添加复合改良剂的M+处理组中,Mn 在博落回根、茎、叶细胞器组分的占比分别下降10%、9%和8%,这表明添加复合改良剂减轻Mn 胁迫对博落回细胞器的损伤,这有利于细胞进行代谢等活动,使博落回可以正常生长。
重金属在植物体中的形态是其累积解毒的重要机制之一[28]。从图3中看出,Mn 在博落回根茎叶中的形态主要为氯化钠提取态和水提取态,这表明博落回体内的Mn 主要与蛋白质螯合、有机盐和磷酸盐沉淀形式存在。在博落回根中,与M 处理组相比,M+处理组的氯化钠提取态占比减少了14%,而醋酸提取态占比增加了7%,说明Mn 向迁移活性弱的提取态转化,部分限制了Mn 向地上部的迁移,进而减轻了Mn 毒害。在博落回叶中,Mn 主要为水提取态和氯化钠提取态,水提取态Mn 占总锰的34%~39%,去离子水主要提取与水溶性物质结合的部分如水溶性有机酸盐,因此博落回叶片中大部分Mn 可能与有机酸结合[28]。此前有研究表明有机酸和重金属络合累积在液泡中,降低重金属对植物的毒性[28]。与M 处理组相比,M+处理组的水提取态占比增加9%,表明改良剂的加入使博落回体中大部分Mn 与有机酸结合解毒,毒害减少。
由TEM 观察到的博落回微观结构可知:观察博落回叶片发现M 处理下博落回细胞间隙有流出的细胞器,同时存在黑色物质,推测该黑色物质为重金属沉淀[13]。在M 处理下,博落回细胞中液泡可能沉积大量锰金属沉淀,最终排出细胞间隙,以防止锰对博落回细胞的伤害[13]。M+处理下,博落回的细胞结构完整,叶绿体结构未发生明显变化,而M 处理的博落回,叶绿体双层膜破裂或结构消失,表明Mn 胁迫对博落回叶绿体结构产生损害,而改良剂的加入缓解了此损害[30-31]。植物的叶绿体内会含有大量淀粉粒,淀粉粒的降解会促进叶绿体合成有机溶质提供碳骨架去参与渗透调节[13]。M+处理下,博落回中叶绿体的淀粉粒的数量与M 处理相比相对减少,说明改良剂的加入使博落回对Mn 胁迫采取了积极的防御措施,促进叶绿体中淀粉粒的降解,从而促进合成有机溶质以调节渗透压[32-33]。
在本试验中,博落回细胞壁的固定和液泡的分离可能与2 920 cm-1处的-COOH、-CH3这些功能团相关,这些功能团可以结合博落回中细胞壁和液泡中的Mn,从而减少Mn 对博落回细胞的毒性[34]。在M+处理后,博落回细胞细胞壁和液泡中的氨基酸和羧酸含量增加,从而增强了氨基酸与重金属的结合。M 处理后3 422 cm-1处的吸收峰透过率变高,说明此时锰胁迫破坏了博落回细胞壁的羟基吸附结合Mn 的机制,导致其细胞壁的羟基无法吸附结合Mn,引起峰值升高[35]。而加入改良剂后此机制未被破坏,反而促进博落回的碳水化合物的分泌,从而减少Mn 对植物细胞的损害。研究发现,1 060 cm-1处吸收峰可能与植物细胞膜的膜脂过氧化程度相关,Mn 浓度越高,膜过氧化程度越深,引起峰值升高[35]。从图5中可以看出M处理下博落回体内由于Mn 浓度过高破坏此机制,使吸光度下降;而M+处理下增加了1 040 cm-1处的硫代基团数量,从而降低膜的过氧化程度。
本研究在细胞层面对博落回耐锰的生理生化性质及机理进行了讨论,下一步可以进行组学分析和耐锰基因检测,进一步明确博落回的耐锰机制,为博落回修复锰矿提供理论依据。此外,博落回作为经济作物,在修复锰矿渣的同时如何安全高效利用博落回提取物也是今后一个重要的研究方向。
复合改良剂(蘑菇渣和凹凸棒)联合博落回植物修复锰矿渣具有很好的效果。博落回是一种能有效稳定锰矿渣重金属元素的草本植物,复合改良剂的加入提高了锰矿渣的渗透性和肥力,降低锰的毒性,从而促进了博落回的生长。改良条件下,博落回叶片中Mn 对叶绿体结构的损害明显降低,提高了植物的光合效率;且通过调节抗氧化酶的活性去除了过量的ROS,调节了渗透压,降低了脂质过氧化,从而保护原蛋白免受Mn 的毒性。与此同时,改良条件下博落回增加了大量的甲基、羧基基团,结合细胞壁和液泡的Mn 形成稳定化合物,使Mn 在细胞器的积累减少,降低了Mn 对博落回的毒性。本研究为复合改良剂联合博落回在锰矿区生态修复中的潜在应用提供了理论依据和技术支撑,为植物修复重金属污染场地提供了新的视角。
