紫锥菊提取物联合柳氮磺吡啶对湿热泄泻大鼠Th17/Treg免疫失衡的影响
2023-11-30池幸子李耀星王慧婷严铭恩杨诗靖杨泊文郭世宁石达友
池幸子,李耀星,王慧婷,严铭恩,杨诗靖,杨泊文,孙 晗,郭世宁,2, 石达友,2,武 力,2,刘 翠,2*
(1.华南农业大学兽医学院,广州 510642;2.广东省兽用中药与天然药物工程技术研究中心,广州 510642)
湿热泄泻证在中兽医临床中较为常见,其证型主要为湿热侵犯肠道,临床表现为腹痛、腹泻、肛门焦灼、黏液脓性血便或暴发性腹泻及黄糜烂臭散便,舌苔黄腻等[1-2]。在畜牧业中,夏秋季动物的过度使役,畜禽流动性增加,常使其应激导致湿热泄泻,带来巨大的经济损失[3]。根据中医理论,紫锥菊味辛、苦,性凉,具有疏散风热,清热解毒的功效,在治疗湿热泄泻方面具有副作用小、疗效高、成本低及综合效应好等优势[4-5]。
Th17细胞是一种存在于肠黏膜中的CD4+细胞亚群,以产生IL-6、IL-17、IL-23等细胞因子为主要特征,与诱导机体炎症,激活B细胞产生自身抗体等密切相关[6]。Treg细胞亚群是免疫反应和炎症疾病的重要调节因子,通过TGF-β、IL-10、IL-15等细胞因子调节机体的免疫系统,促进肠道T细胞的活化。机体正常情况下,Th17/Treg水平保持相对平衡,而病理状态下相关细胞因子发生变化会使得两者平衡被打破从而引发疾病的产生[7]。Treg细胞和Th17细胞的发现,改变了人们对免疫调节、免疫病理及宿主防御的认识,加深了人们对炎症性肠病发病机制的认识[8-10]。研究表明,机体免疫反应的失衡,尤其是Th17细胞与Treg细胞的分化异常,在湿热泄泻的发病机制中起到关键作用[11-13]。Th17细胞与Treg细胞是肠道免疫稳态的关键因素,有多种细胞因子与转录因子参与调控,因而Th17/Treg平衡对肠道健康而言尤为重要[14-15]。
前期研究表明,每日使用3 g·kg-1紫锥菊提取物能调节机体免疫,有效改善大鼠湿热泄泻症状[16]。柳氮磺吡啶为一种磺胺类抗菌药,主要成分是5-氨基水杨酸,是临床上治疗溃疡性结肠炎的常用药,其在湿热型肠炎中也有较好的疗效[17]。本研究采用紫锥菊提取物联合柳氮磺吡啶治疗大鼠湿热泄泻,探讨中西药物联合对湿热泄泻大鼠Th17/Treg平衡的影响与疗效,为紫锥菊提取物防治湿热泄泻疾病提供科学依据。
1 材料与方法
1.1 试剂和仪器
葡萄糖,购自天津市大茂化学试剂厂;猪油,购自顿蒿特食品有限公司;营养琼脂,购自青岛高科园海博生物技术有限公司;各种动物外周血淋巴细胞分离液试剂盒,购自北京索莱宝科技有限公司;CD4 Monoclonal Antibody (OX35) FITC、IL-17A Monoclonal Antibody (eBio17B7) PE、FOXP3 Monoclonal Antibody (FJK-16s) PE、CD25 Monoclonal Antibody (OX39) APC、eBioscienceTM细胞刺激混合物(加蛋白转运抑制剂)(500×)、eBioscienceTM细胞内固定与透化缓冲液、eBioscienceTMFoxp3/Transcription Factor Fixation/Permeabilization Concentrate and Diluent,购自英潍捷基上海贸易有限公司;红细胞裂解液,购自上海仁捷生物科技有限公司;TGF-β、IL-10、IL-17、IL-23 ELISA 试剂盒,购自上海酶联生物科技有限公司。
离心机(湖南湘仪,L420)、酶标仪(Thermo,357-701660)、流式细胞仪(贝克曼库尔特,CYTOFLEX)。
1.2 药物与菌种
紫锥菊提取物,由华南农业大学兽医学院中兽医实验室与广州华农高科生物科技有限公司研制,广州华农高科生物科技有限公司中试生产,批号:20191201,含单咖啡酰酒石酸和菊苣酸的总量不少于2.0%,100 g·袋-1。产肠毒素性大肠杆菌(O78)购自中国兽医药品监察所。
1.3 实验动物与分组
SPF级Wistar大鼠40只购自广州南方医科大学实验动物管理中心,体重180~220 g,雌雄各半,动物生产许可证号:SYXK(粤)2019-0136。40只Wistar大鼠随机均分为5组:空白组、模型组、紫锥菊提取物组、柳氮磺吡啶组及中西结合组,雌雄各半。空白组大鼠给予正常饮水,单日灌胃同剂量生理盐水,处于温度(22±2)℃,湿度 50%±5%环境中;其余各组大鼠于单日灌胃20 mL·kg-1猪油并给予充足饲料,于双日禁食,且自由饮用30%葡萄糖水,所有大鼠置于高温高湿环境中,维持室内温度33 ℃±2 ℃,湿度90%±5%,每日持续8 h,共10 d。10 d后,除空白组外,其余各组大鼠均腹腔注射剂量为2 mL·kg-1产毒性大肠杆菌菌液(1.8×109CFU·mL-1),间隔24 h后再次注射1 mL·kg-1剂量大肠杆菌菌液,自然适应1 d,空白组大鼠腹腔注射等量生理盐水[16]。造模后,紫锥菊提取物组每日分别灌胃紫锥菊提取物1 g·kg-1,柳氮磺吡啶组每日灌胃柳氮磺吡啶0.1 g·kg-1,中西结合组每日灌胃1 g·kg-1紫锥菊提取物+0.1 g·kg-1柳氮磺吡啶,空白组与模型组大鼠给予等量生理盐水,持续6 d。
1.4 临床体征观察
观察大鼠临床体征,记录体重、饮水量与采食量。根据临床症状评分表量化各组大鼠的湿热泄泻临床症状变化程度。评分参考王涛[18]的标准并加以优化,见表1。
1.5 组织病理学检查
取各组大鼠结肠用10%中性甲醛溶液固定,冲洗样本中的甲醛后使用乙醇脱水,二甲苯透明,石蜡包埋并切片(4 μm),进行HE染色,封片,光学显微镜观察各组大鼠结肠组织学差异。
1.6 各组大鼠主要血清因子含量检测
各组大鼠进行腹主动脉采血,采全血4 mL静置2~3 h,室温下3 500 r·min-1离心10 min,取上清备用。运用ELISA法检测各组大鼠血清中TGF-β、IL-10、IL-17、IL-23的含量。
1.7 各组大鼠PBMCs中Th17/Treg细胞比例测定
1.7.1 制备PBMCs悬液 大鼠腹主动脉采血5 mL,使用PBS将血液按1∶1比例稀释于15 mL离心管中。另取两个15 mL离心管,分别加入5 mL淋巴细胞分离液,将稀释好的血液样本用1 mL移液枪贴壁缓慢加入淋巴细胞分离液管中,尽量保持液面分层。1 000×g离心20 min后,吸取白膜层细胞到15 mL洁净的离心管中,10 mL PBS或细胞洗涤液洗涤白膜层细胞。500×g离心5 min,弃上清。向管中加入1 mL红细胞裂解液,轻轻吹打混匀,静置1~2 min。500×g离心5 min,弃上清。向管中加入5 mL PBS,轻柔混匀重悬沉淀,离心2~3 min,弃上清,加入500 μL PBS重悬。取5个5 mL棕色管,每管50 μL细胞悬液,分别为Treg 组中CD4单染管、CD25单染管、Foxp3单染管、阴性对照管,复染管准备染色。余250 μL 装入3 mL培养皿中,添加2 mL细胞培养液并添加4 μL细胞刺激剂置于37℃、5%CO2培养箱中孵育4 h。
1.7.2 PBMCs计数 细胞密度计算公式为:原细胞悬液的细胞数/4 mL =细胞平均数×105,调整细胞密度为1×106。
1.7.3 PBMCs中Th17细胞和Treg细胞比例测定 1.5 mL的EP管中加入50 μL细胞悬液。先加入50 μL的PBSA调整体积至100 μL。然后复合管加入CD4抗体0.5 μL、CD25 抗体0.625 μL,CD4管加入CD4抗体0.5 μL,CD25管加入CD25 抗体0.625 μL,轻轻地脉冲涡旋混匀,4 ℃避光孵育30 min。加入1 ml的PBS洗涤细胞,4 ℃下400~600×g离心5 min,弃上清,加PBS 100 μL重悬。Foxp3管与复合管加入1 mL Foxp3 固定/破膜工作溶液并脉冲涡旋。4 ℃避光孵育30 min。每管加入2 mL破膜液,在室温下400~600×g离心样品5 min弃上清。用破膜液重悬沉淀至100 μL。不洗涤,加入Foxp3抗体5 μL,轻轻地脉冲涡旋混匀,室温孵育30 min以上,避光。在EP管加入2 mL的破膜液,在室温下400~600×g离心样品5 min,弃上清。用PBS重悬后,流式细胞仪检测Treg细胞数量测定。
孵育结束后,收集培养液,600×g离心5 min弃上清。加入PBS 1 mL重悬,600×g离心5 min,弃上清,加入200 μL PBS重悬。分装成4个5 mL的棕色管,为CD4单染管、IL-17单染管、阴性对照管、复合管。各管分别加入50 μL PBS调整体积至100 μL。向复合管加入CD4抗体0.5 μL,CD4管中加入CD4抗体0.5 μL,脉冲涡旋混匀,4 ℃ 避光孵育30 min。加入PBS 1 mL洗涤细胞,400~600×g离心5 min,弃上清。重复洗涤。加入100 μL PBS重悬。IL-17管与复合管加入添加100 μL IC固定液来固定细胞,之后脉冲涡旋混合。室温避光孵育30 min。加入2 mL破膜液,在室温下600×g离心5 min。弃上清。用破膜液重悬沉淀至100 μL破膜液中,加入IL-17抗体0.625 μL,脉冲涡旋混匀,室温避光孵育30 min。加入2 mL的破膜液,400~600×g离心5 min,弃上清用PBS重悬后,流式细胞仪检测Th17细胞数量测定。
1.8 数据分析

2 结 果
2.1 各组大鼠的临床体征
第12天造模结束时,与空白组相比,模型组大鼠临床症状评分显著升高(P<0.05),第13~18天时评分逐渐降低但始终显著高于空白组(P<0.05)。各治疗组在第13~18天治疗过程中评分逐渐降低,但与模型组无显著差异(P>0.05),第18天时中西结合组与柳氮磺吡啶组差异不显著(P>0.05,图1A)。
第12天造模结束时,与空白组相比,模型组大鼠体重显著降低(P<0.05)。第13~18天各治疗组体重缓慢增长且低于空白组。与模型组相比,第18天时紫锥菊提取物组与柳氮磺吡啶组大鼠体重与模型组无显著差异(P>0.05,图1B)。
第12天造模结束时,模型组大鼠饮水量与空白组无显著差异(P>0.05),第13~18天各组饮水量逐步恢复至正常水平(图1C)。
第12天造模结束时,模型组大鼠采食量显著低于空白组(P<0.05)。第15天各治疗组采食量上升,在第18天时逐步恢复至正常水平(图1D)。
2.2 各组大鼠结肠病理学变化
如图2所示,与空白组相比,模型组大鼠结肠发现有大量的炎性细胞浸润(图2,如箭头所示),在各治疗组中,柳氮磺吡啶组大鼠结肠见炎性细胞浸润、出血及脱落的肠绒毛(图2,如箭头所示),而紫锥菊提取物组和中西结合组大鼠结肠均未见明显异常。
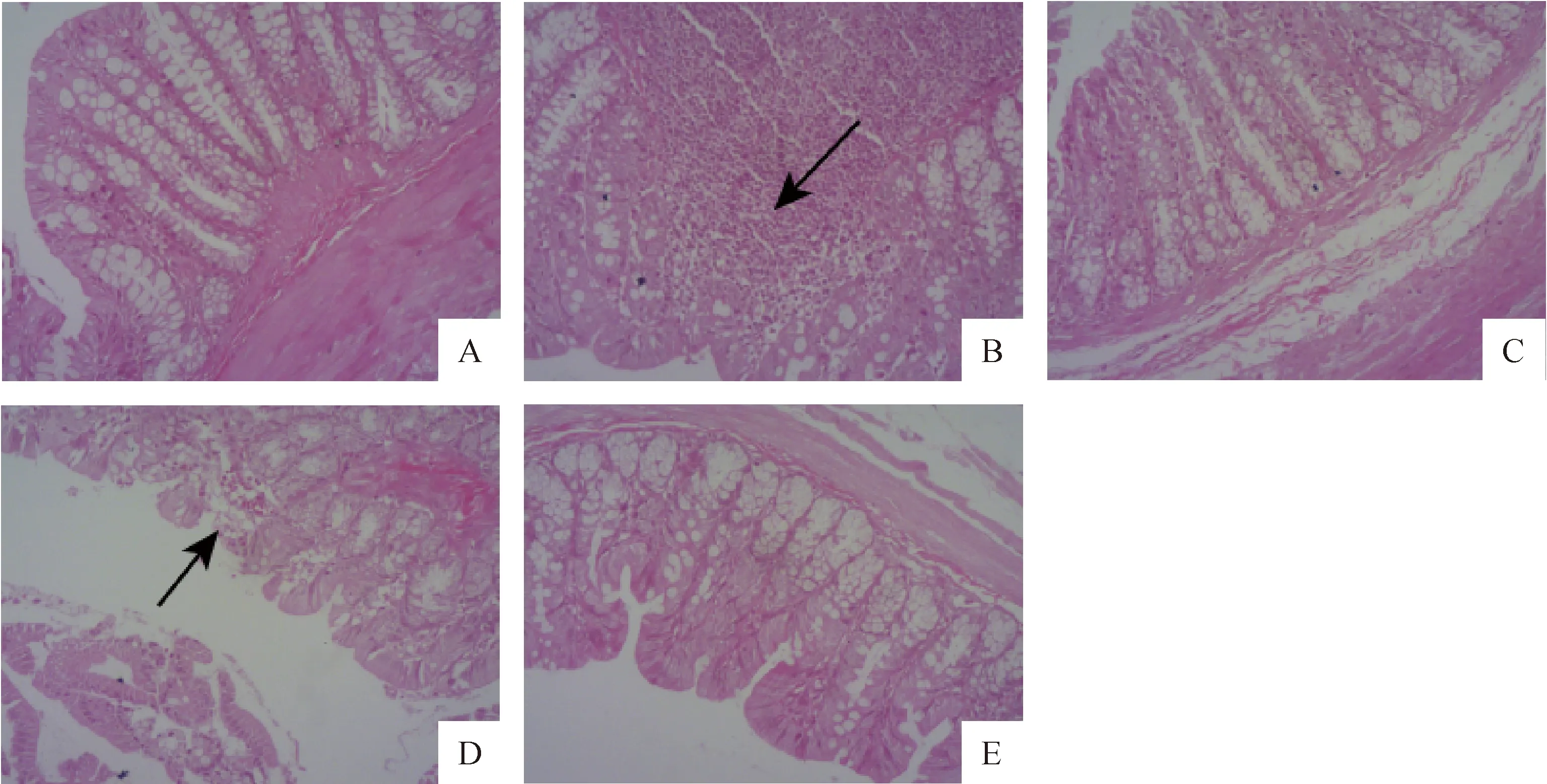
A.空白组;B.模型组;C.紫锥菊提取物组;D.柳氮磺吡啶组;E.中西结合组A. Control group; B. Model group; C. Echinacea purpurea extract group; D. Sulfasalazine group; E. Integrated traditional Chinese and Western medicine group图2 各组大鼠结肠病理学变化结肠病理学变化(HE染色,100×)Fig.2 Pathological changes of colon in rats of each group (HE staining, 100×)
2.3 各组大鼠血清炎性因子水平变化
各组大鼠血清炎性细胞因子水平变化如图3,与空白组相比,模型组大鼠血清中IL-17、IL-23水平显著升高(P<0.05),血清中TGF-β、IL-10水平显著降低(P<0.05)。与模型组相比,紫锥菊提取物组与中西结合组大鼠血清中IL-17、IL-23水平显著降低(P<0.05),血清中TGF-β水平显著升高(P<0.05),血清IL-10水平无显著差异(P>0.05)。
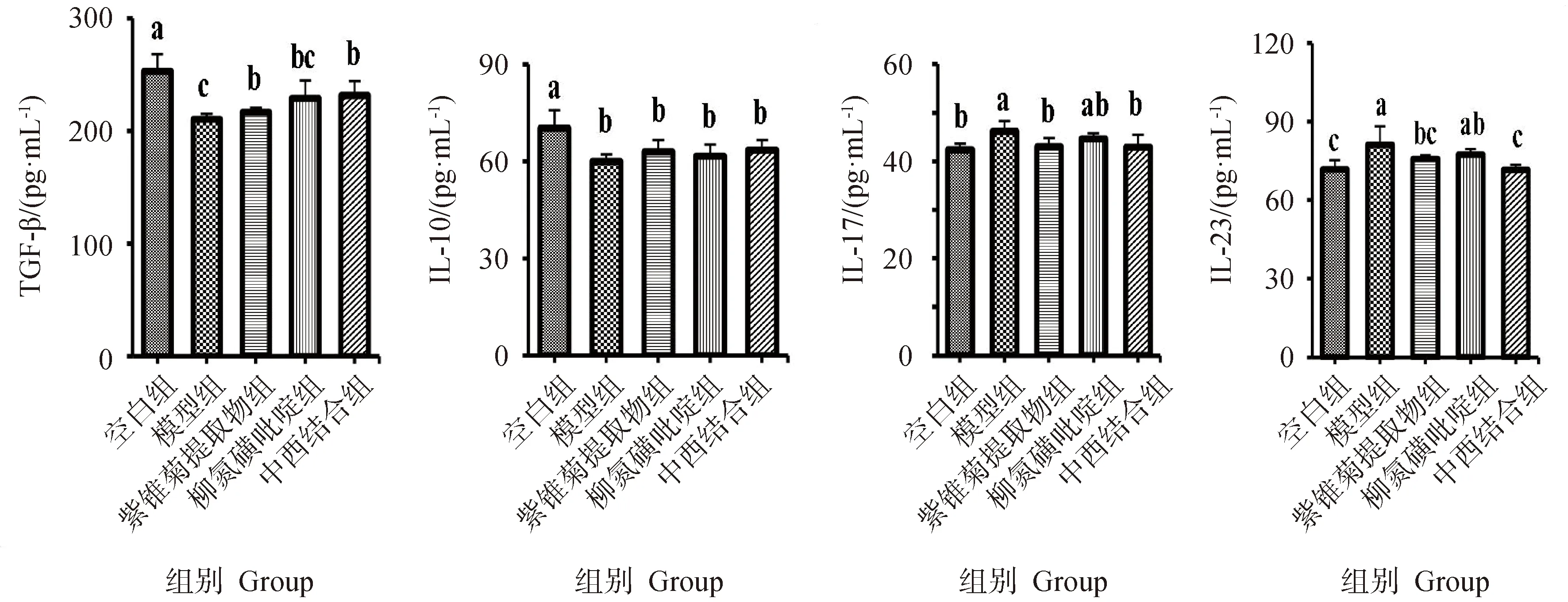
柱上字母不同表明各组间差异显著(P<0.05)。“a”表示最大值,“b”、“c”、“d”依次递减 Different letters on the bar indicate significant differences among groups (P<0.05).“a” indicates the maximum value, and “b”, “c” and “d” decrease gradually图3 各组大鼠血清炎性细胞因子水平的变化Fig.3 Changes of serum inflammatory cytokines of rats in each group
2.4 各组大鼠PBMCs中Th17/Treg细胞比例变化
如表2所示,与空白组相比,模型组大鼠PBMCs中Th17细胞比例显著升高(P<0.05),PBMCs中Treg细胞比例显著降低(P<0.05),Th17/Treg比例显著升高(P<0.05)。与模型组相比,紫锥菊提取物组与中西结合组大鼠PBMCs中Th17细胞比例显著降低(P<0.05),PBMCs中Treg细胞比例显著升高(P<0.05),Th17/Treg比例显著降低(P<0.05)。
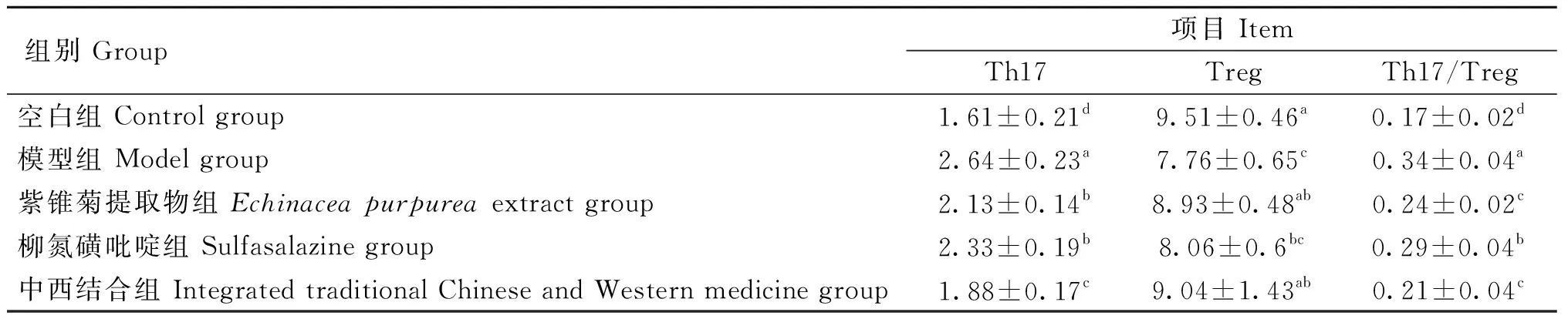
表2 大鼠PBMCs中Th17/Treg细胞比例(n=6)Table 2 Th17/Treg cell ratio in rat PBMCs (n=6)
3 讨 论
湿热泄泻证由湿热壅滞,损伤脾胃,运化失常所致,目前该模型的建立多采用模拟高温高湿环境制造“外湿”,同时饮食肥甘之物损伤脾胃制造“内湿”。但也有研究表明仅高温高湿环境不足以建立动物大肠湿热证,腹腔注射大肠杆菌,配合饮食及环境复合法更能成功建立符合中兽医学临床特点的湿热泄泻模型[19]。本试验总结前人经验,采用“内外湿热+大肠杆菌”方法,通过提高外界温湿度营造易感疾病环境,同时内服葡萄糖水与猪油导致机体热蕴湿阻,以此建立了稳定的湿热泄泻大鼠模型。
紫锥菊为菊科多年生草本植物,其活性成分有多糖、烷烃及咖啡酸衍生物等[20]。现代研究主要集中于紫锥菊对免疫系统的影响,如免疫刺激或免疫调节作用[21-23]。基于网络药理学探究紫锥菊增强免疫功能的作用机制预测紫锥菊活性成分可通过调节转录因子、免疫细胞、炎症因子等增强机体免疫功能[24]。前期研究也证实了紫锥菊提取物能提高机体免疫从而有效改善大鼠湿热泄泻症状[16]。本试验成功建立湿热泄泻大鼠模型后,采用紫锥菊提取物联合柳氮磺吡啶治疗湿热泄泻模型大鼠,通过观察治疗过程中大鼠的临床体征,发现中西结合组大鼠的临床症状评分要低于紫锥菊提取物组与柳氮磺吡啶组,说明中西结合组在缓解湿热泄泻大鼠的萎靡不振、腹泻不止方面优于单独给予紫锥菊提取物或柳氮磺吡啶。本试验结果显示,紫锥菊提取物组、柳氮磺吡啶组及中西结合组的饮水量与采食量均低于模型组,提示由于药物的灌胃影响了大鼠的饮食欲,从而进一步导致各治疗组大鼠的体重要低于模型组。结肠病理切片的结果显示,治疗后柳氮磺吡啶组大鼠结肠仍有炎性细胞浸润、出血及脱落的肠绒毛等损伤,而紫锥菊提取物组与中西结合组的大鼠结肠未见明显异常。
一般认为应激导致腹泻是多方面作用的结果,现在越来越多的研究表明,湿热泄泻中内外湿邪导致机体联合应激与病原微生物感染,使得病患体内免疫细胞发生变化,表明一系列病程与免疫功能紊乱密切相关[25-26]。机体感受湿热外邪,或因饮食酿湿生热,升降失常,下注大肠,将导致机体PBMCs中Th17/Treg比例下调,加剧炎症反应,抑制机体免疫功能,因此,Th17/Treg 免疫失衡可作为湿热泄泻的潜在标志物。本试验检测了大鼠PBMCs的Th17/Treg比例及相关血清炎性因子水平,从而探究中西药物结合的疗效及对Th17/Treg轴的影响。结果显示,采用“内外湿热+大肠杆菌”对大鼠造模后,模型组大鼠PBMCs中Th17细胞比例显著升高,PBMCs中Treg细胞比例显著降低,Th17/Treg比例显著升高。采用紫锥菊提取物或其与柳氮磺吡啶联合治疗后,均可显著降低大鼠PBMCs中Th17细胞比例,从而使紊乱的Th17/Treg比例恢复平衡,且中西结合组的效果优于紫锥菊提取物组与柳氮磺吡啶组。CD4+细胞亚群中的Th17细胞主要存在于肠黏膜中,可分泌IL-6、IL-17、IL-22、IL-23等细胞因子,IL-6上调会影响IL-23R的含量变化,从而诱导机体炎症[27-28]。TGF-β诱导幼稚T细胞转化为Treg细胞抑制自身免疫,但在IL-6作用下,TGF-β可促进幼稚T细胞分化为Th17细胞,分泌炎症因子IL-17以促进自身免疫和炎症的发生[29-30]。本试验结果显示中西结合组降低炎性因子IL-17、IL-23与升高血清TGF-β的作用优于紫锥菊提取物组与柳氮磺吡啶组,具有良好的抗炎效果。另外,Treg细胞可分泌 IL-10、TGF-β以抑制其他辅助型T细胞的功能,主要通过Foxp3发挥其免疫调节作用[31]。Treg细胞还可通过其他机制发挥抑制自身免疫性疾病的功能,Treg细胞通过控制肠道T细胞的活化,调节小鼠的肠道免疫反应[32]。有研究表明,IL-6依赖STAT3信号通路途径,对Th17细胞的增殖分化有促进作用;另外,STAT3也可通过关键基因维甲酸相关孤儿受体γt(retinoid acid-related orphan receptor gammat,RORγt)的表达增加调控Th17细胞的增殖分化[33]。当IL-6缺乏时,通过TGF-β与IL-21的协同,也能诱导Th17细胞增殖[34]。大鼠湿热泄泻如何导致机体炎症反应的发生以及Th17/Treg失衡的机制机理尚需进一步深入研究。
4 结 论
紫锥菊提取物联合柳氮磺吡啶给药可明显改善湿热泄泻大鼠的结肠损伤、减少炎性细胞浸润,显著降低湿热泄泻大鼠血清中IL-17、IL-23水平,升高血清中TGF-β水平,且效果优于紫锥菊提取物组、柳氮磺吡啶组,并且在改善血清炎性因子水平的同时调节了Th17/Treg比例,从而对湿热泄泻大鼠起到治疗效果。
