鸽源鼠伤寒沙门菌的分离鉴定及致病性分析
2023-11-30杨梦林郑世奇黄燕华
杨梦林,郑世奇,彭 凯,王 玮,黄燕华,3*,彭 杰*
(1.仲恺农业工程学院健康养殖创新研究院,广州 510225;2.广东省农业科学院动物科学研究所,广东省畜禽 育种与营养研究重点实验室,农业农村部华南动物营养与饲料重点实验室,广州 510640; 3.岭南现代农业科学与技术广东省实验室,广州 510642)
沙门菌在全世界广泛分布,自1885年沙门菌首次被分离后,截至目前为止,已发现的血清型已经超过2 600种[1]。鸽沙门菌病是肉鸽养殖业中常见的细菌病之一,主要病原菌为鼠伤寒沙门菌,通过消化道、呼吸道等途径传播,症状表现为精神状态萎靡、羽毛凌乱、下痢、行为失常等。被感染的种鸽能够通过垂直传播将细菌传递给种蛋,引起种蛋坏死,降低孵化率,还能通过哺乳等方式感染乳鸽,引起乳鸽生长速度减慢甚至死亡[2]。此外,沙门菌作为人畜共患病原菌,能够通过污染鸽的加工产品传播给人类和动物,对公共卫生安全造成威胁。目前抗生素滥用情况较为严重,造成了细菌的耐药性形成速度加快[3],因此了解沙门菌的耐药性对于科学用药有重要意义。
广东某地区规模化肉鸽养殖场出现肉鸽下痢、消瘦、精神异常、关节肿大等症状,临床观察发现疑似感染鸽沙门菌。试验采集病死鸽病变组织,进行细菌分离、纯化、鉴定、耐药性分析、耐药基因和毒力基因检测并建立感染啮齿动物模型,分析沙门菌的毒力和致病性,以期为沙门菌病防治提供一定的科学依据。
1 材料与方法
1.1 病料收集
从广东某地区三个大规模肉鸽养殖场收集72只病死鸽,根据病鸽临床症状在无菌条件下分别采集36份肝、23份脾、13份膝关节样品,共计72份待检测样本。
1.2 试剂和培养基
麦康凯培养基、XLD琼脂、SS琼脂、LB培养基、生化鉴定管购自广州环凯微生物科技有限公司产品;药敏纸片购自杭州微生物试剂有限公司;2×F8 Master Mix购自艾德莱有限公司;DNA标准 DL2000,核酸染料E×Red(10 000×)购自北京庄盟国际生物基因科技有限公司产品;沙门菌属诊断血清试剂盒购自宁波天润生物药业有限公司。
1.3 病原菌分离与鉴定
在无菌条件下将72份病变组织进行研磨,先后接种于XLD琼脂、麦康凯琼脂和SS琼脂培养基分离纯化,记录菌落形态和颜色并进行革兰染色和镜检。对分离菌进行生化鉴定以及生长曲线观察;采用沙门菌属诊断血清,观察分离菌与O价血清凝集情况;鼠伤寒沙门菌特异性STM4497基因PCR鉴定[4]及16S rRNA鉴定[5],扩增片段送往生工生物工程(上海)股份有限公司测序,测序结果在NCBI数据库中进行Blast序列相似性对比分析,并构建系统进化树。
1.4 药敏试验
参照美国临床实验室标准委员会(NCCLS-2018) 描述的K-B法的标准,根据抑菌圈直径进行判定分离菌株的耐药情况。药敏试验用药包括氨苄西林、阿莫西林等20种药物。
1.5 耐药基因和毒力基因检测
试验挑取单菌落溶解于装有50 μL无菌水的EP管中,振荡混匀后作DNA模板,检测耐药基因(tetA、tetB、sul-11、aphA3、aacC4、aadAF、aacC2、qnrA、qnrB、Aac(6′)-Ib、catI、floR、cmlA、blaTEM、blaSHV)[6-14]和毒力基因(mogA、sseL、mgtC、bcfA、araB、spvA、spvB、spvC、spvD、spvR、stn、fliC、fimA、avrA、invH、sopA、virK)[15-18]。
1.6 动物致病性试验
将6周龄C57BL/6小鼠随机分为5组,每组6只,选取携带毒力基因数量最多的致病菌分别以103、105、107、109CFU·mL-1浓度的攻毒剂量处理试验组,每只灌服0.2 mL,设置阴性对照组,以PBS代替菌液,每只0.2 mL,仅第1日灌服,饲养期为6 d,试验期结束后观察小鼠器官病变。
2 结 果
2.1 分离菌分离鉴定
本研究在72份样本共分离鉴定出12株病原菌,在XLD培养基均长出边缘整齐、圆形粉红色菌落,中心呈黑色(图1A);在麦康凯培养基均长出表面光滑、圆形半透明灰白色菌落(图1B);在SS琼脂均长出无色半透明状菌落,中心呈黑色(图1C)。镜检观察到两端钝圆、没有芽胞和荚膜的革兰阴性杆状菌(图1D)。生化鉴定结果均符合沙门菌特性,血清型鉴定结果显示沙门菌A~F多价O血清和沙门菌O4单价血清因子与12株分离菌发生凝集反应,鼠伤寒沙门菌特异性序列STM4497经PCR扩增得到一条接近523 bp DNA目的条带,并将16S rRNA测序结果在NCBI数据库中进行Blast分析对比并建立系统进化树(图1E),综上,说明12株分离菌均属于鼠伤寒沙门菌。
2.2 分离菌耐药性检测
药敏结果显示,12株菌分离菌对恩诺沙星、甲氧苄啶、复方新诺明、氟苯尼考、氯霉素、氨苄西林、阿莫西林、头孢噻吩、美罗培南、头孢曲松耐药率为0.0%,对卡那霉素、呋喃妥因、头孢噻肟、丁胺卡那、环丙沙星、庆大霉素的耐药率为8.3%~33.3%,对多西环素、米诺环素的耐药率为58.3%~83.3%,对萘啶酸和利福平耐药率为100.0%。
2.3 分离菌耐药基因和毒力基因检测
12株分离菌耐药基因检测结果显示,tetA携带率为58.3%,sul-11携带率为41.7%,其他耐药基因未检出,结合“2.2”药敏试验结果发现,四环素类耐药基因与其耐药表型符合率100%,但磺胺类耐药基因与耐药表型符合率为0%。毒力基因检测结果显示,mgtC、bcfA、spvA、spvD、spvR、stn、avrA、invH、sopA携带率为100%,sseL、spvC、fliC携带率为91.7%,mogA、virK基因携带率为83.3%,araB为75.0%,spvB为66.7%,fimA为58.3%,说明该地区流行沙门菌毒力基因携带较多,详见表1。
2.4 分离菌致病性研究
试验随机选取携带检测毒力基因最多的1株分离菌进行攻毒小鼠试验,结果显示,随着灌菌浓度增大,小鼠体重和采食量显著下降(图2A、B),脾、肝肿大,结肠长度缩减(图2C、D、E)。观察空肠HE切片发现鼠伤寒沙门菌引起绒毛长度与隐窝深度比值下降(图2F),杯状细胞逐渐减少(图2G、I);观察肝HE切片发现大量免疫细胞汇集肝,并且肝枯否细胞(Kupffer cell)数目逐渐增加(图2H、图3)。
3 讨 论
本研究发现从样本中分离出的12株致病菌均为鼠伤寒沙门菌,除本研究外,在多地报告中也指出鸽沙门菌病是由鼠伤寒沙门菌感染引起,这提示了鸽子对鼠伤寒沙门菌易感。细菌耐药性形成与抗生素产生的环境压力有着紧密联系,细菌能够通过整合子、质粒等从外界获取抗性基因,同时还能够通过质粒、转座子等多种可移动原件发生水平传播[3,19-20]。试验检测出5株菌具有磺胺类耐药基因sul-11,但对磺胺类药物却保持高度敏感,与相关报道中磺胺类耐药基因sul-11与磺胺异噁唑耐药表型符合程度较高[21]具有差异性,这可能与本研究使用的药物为甲氧苄啶和复方新诺明有关,不同的药物作用机制存在差异,此外,sul-11基因能够表达出具有磺胺类药物抗性的二氢蝶酸合成酶,使细菌的生长不受磺胺类药物影响。但在细菌内部由于sul-11基因存在多种类型的质粒中[22-24],其表达水平以及作用机制并不清晰,需要进一步探究。除此之外,部分菌种对氨基糖苷类和喹诺酮类具有耐药性,但并未检出氨基糖苷类和喹诺酮类耐药基因,可能与本研究检测耐药基因种类不全有关,亦或者产生了新的耐药基因。
细菌是通过多个毒力因子之间的协同作用对机体器官造成炎性损伤的,因此检测毒力基因携带量有利于评估沙门菌致病能力。本研究发现,毒力岛基因ssel、mogA、mgtC、bcfA、araB检出率高于75.0%,毒力质粒基因、肠毒素毒力基因、鞭毛基因以及其他毒力基因检出率均高于66.0%,其中11株菌含有sseL毒力基因,在诸多研究中发现,携带毒力岛基因sseL的沙门菌毒性更强,沙门菌分泌的sseL蛋白能够抑制机体炎症反应,并且还能损伤吞噬细胞,有利于沙门菌逃逸[25-26]。除此之外,还有magtC、avrA、spvB、spvC、sopA等主要毒力因子[27],在本试验分离菌中携带率也较高,说明该地区沙门菌的致病性较强。
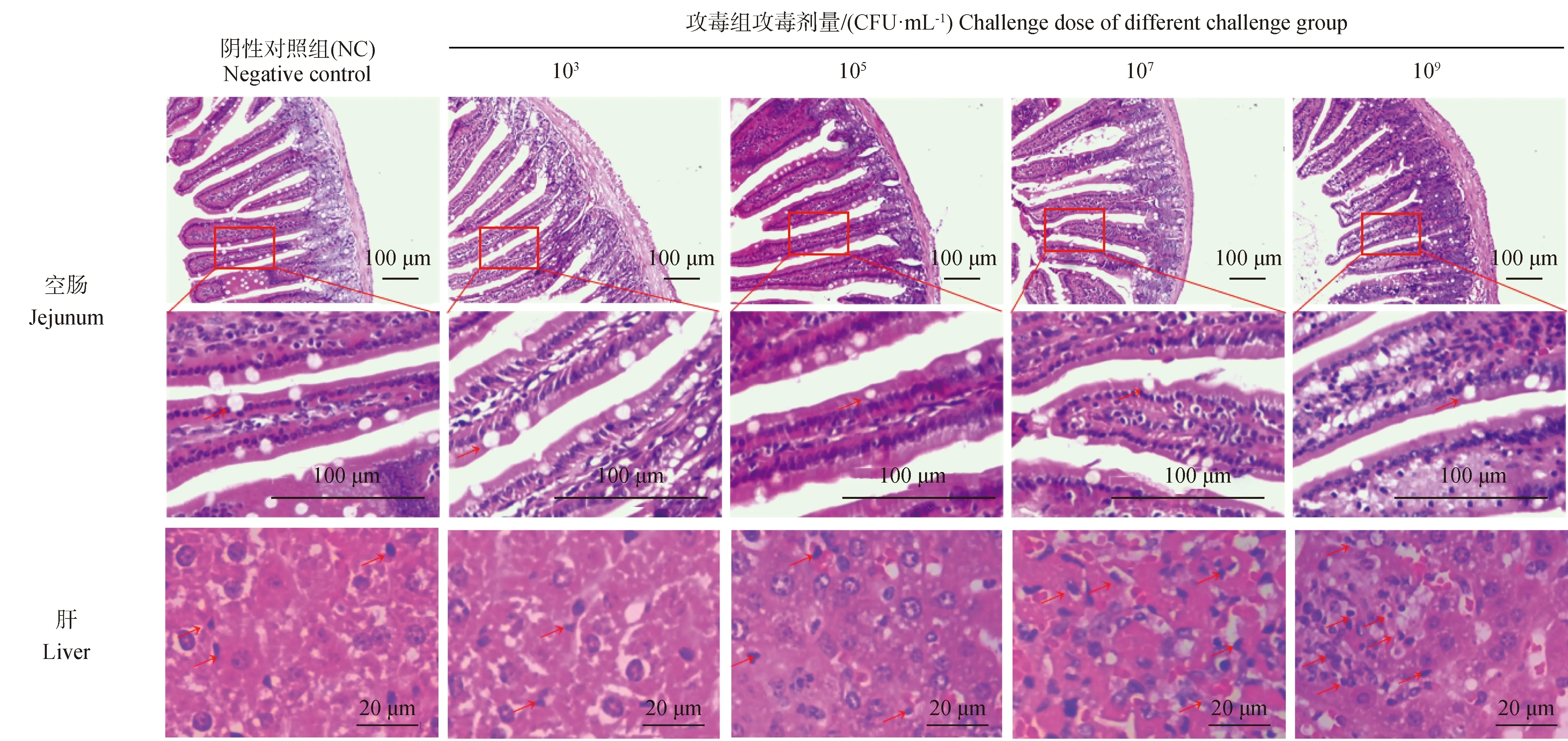
在动物致病性试验结果中发现灌服致病菌浓度高于105CFU·mL-1时,小鼠空肠绒隐比及杯状细胞数目随着灌菌浓度升高逐渐下降。杯状细胞分泌的黏蛋白是肠道机械屏障的重要组成部分,当沙门菌定植于肠道后,毒力岛SPI-1和SPI-2向肠上皮细胞输送效应蛋白,引起肠上皮细胞损伤,破坏肠道屏障的完整性[28-31],研究结果说明沙门菌对肠道吸收功能和屏障功能具有负面影响。除此之外,研究发现随着灌服致病菌浓度升高,肝脏中枯否细胞数量逐渐增多,有研究指出革兰阴性菌细胞壁组分脂多糖能够活化枯否细胞,使其炎症因子分泌增加,引起其他免疫细胞向肝脏聚集,共同清除血液中的细菌[32],然而这个过程是否有枯否细胞前体细胞募集进入肝脏发生分化增殖这一机制并不清晰,本研究枯否细胞数量增加可能与上述过程有关,此机制还有待进一步探究。
4 结 论
成功分离出12株鼠伤寒沙门菌,通过药敏测试、耐药和毒力基因检测以及6周龄小鼠致病性研究发现分离菌均出现多重耐药,并且毒力基因携带量较高,致病性强,建议在该地区治疗鸽沙门菌病中使用甲氧苄啶、复方新诺明等高敏感药物,同时要提高公共卫生安全意识,注重食品安全,避免向人群传播。
