希瓦氏菌分泌黄素对间硝基苯磺酸钠厌氧生物还原影响
2023-11-30洪忠强,吕红,王晓磊,周集体
洪 忠 强, 吕 红, 王 晓 磊, 周 集 体
( 大连理工大学 环境学院 工业生态与环境工程教育部重点实验室, 辽宁 大连 116024 )
0 引 言
电化学活性菌(electrochemically active bacteria,EAB)是将电子从细胞内传输到胞外电子受体如金属离子、矿物质、有机污染物或电极的一类微生物,其电子转移过程称为胞外电子传递[1-2].目前国内外学者普遍认为EAB具有两种胞外电子传递机制[3]:一种是通过外膜表面c型细胞色素蛋白[4-5]或延伸的导电菌毛/纳米线[6-7]进行的直接电子传递机制;另一种是通过电子穿梭体[8-9]进行的间接电子传递机制,主要以细胞自身分泌的各种电子穿梭体[10-11],如黄素类物质完成细胞和不溶性底物之间的电子交换[12-13].
希瓦氏菌是能够利用含有Fe(Ⅲ)、Mn(Ⅲ)或Mn(Ⅳ)的矿物质作为末端电子受体的EAB之一.有学者发现希瓦氏菌株S.oneidensisMR-1中的bfe是一个可以控制细胞分泌黄素的黄素腺嘌呤二核苷酸(FAD)转运蛋白基因,缺失bfe基因会显著降低细胞对Fe(Ⅲ)氧化物等矿物质及石墨电极的还原速率[14].可见,细胞分泌的黄素类物质在介导还原胞外固态电子受体过程中起到主要作用[8,14].研究表明,位于细胞表面的外膜蛋白MtrC和OmcA可通过还原黄素单核苷酸(FMN)将电子转移到固体Fe(Ⅲ)上[15-16].这两个外膜蛋白也能够还原氧化石墨烯(GO)[17],从而促进胞外电子传递.据报道,菌株MR-1通过还原GO,提高了对硝基苯的厌氧生物还原速率[18].海藻希瓦氏菌还原GO制备的还原氧化石墨烯(rGO)也能够加速偶氮染料的厌氧生物脱色[19].然而,在上述反应过程中,细胞分泌的黄素在胞外污染物去除以及固态电子传递体GO存在下的角色还未阐明.
为此,本研究选择广泛应用的高极性硝基芳香化合物间硝基苯磺酸钠(3-NBS)作为模式污染物,以Shewanellasp. RQs-106为模式菌株,通过敲除bfe,研究黄素在3-NBS厌氧生物还原过程中的贡献以及在GO介导的3-NBS还原过程中的作用,从而阐明黄素在高极性硝基芳香化合物胞外还原过程中的作用,为黄素类物质在实际环境污染物处理中的应用提供理论基础.
1 实验材料与方法
1.1 菌株来源
希瓦氏菌株Shewanellasp. RQs-106(简称菌株RQs-106)经实验室筛选并鉴定[20],在GenBank中的登录号为MF168410;FAD转运蛋白基因缺失菌株Δbfe经实验室制备并鉴定[20].
1.2 试 剂
3-NBS、间氨基苯磺酸钠(3-ABS)、四乙基溴化铵购自上海麦克林生化科技有限公司,分析纯;乙腈为色谱纯.
磷酸盐缓冲液:6.7 g/L K2HPO4·3H2O,2.8 g/L KH2PO4,pH=7.2.
萃取缓冲液(EB):100 mmol/L甲酸铵,100 mmol/L甲酸,25%甲醇.
1.3 培养基
(1)LB培养基
5.0 g/L酵母浸粉,10.0 g/L NaCl,10.0 g/L蛋白胨,pH=7.2.
(2)基础培养基
6.70 g/L K2HPO4·3H2O,2.80 g/L KH2PO4,0.20 g/L MgCl2·6H2O,1.00 g/L NH4Cl,0.02 g/L CaCl2,pH=7.2.
1.4 实验方法
(1)3-NBS厌氧生物还原实验
在65 mL棕色血清瓶中加入50 mL基础培养基,丁基胶塞封口后曝N220 min,钳口铝盖密封并于121 ℃下灭菌20 min,待冷却后移入厌氧箱,向体系中分别加入一定浓度乳酸钠和3-NBS,混匀后加入菌悬液至所需浓度,于30 ℃摇床150 r/min培养,定时取样,并测定体系内3-NBS、3-ABS和黄素浓度.
研究不同细胞浓度(0~0.2 g/L)对3-NBS的生物还原特性,反应条件为乳酸钠浓度40 mmol/L,30 ℃,pH 7.2.
(2)黄素对3-NBS厌氧生物还原的影响
研究不同浓度3-NBS(0.01~2.0 mmol/L)的生物还原特性及其反应过程中黄素浓度变化,反应条件为细胞浓度0.15 g/L,乳酸钠浓度40 mmol/L,30 ℃,pH 7.2.
研究了菌株RQs-106和菌株Δbfe对3-NBS的生物还原特性,以及20 mg/L GO对菌株RQs-106和菌株Δbfe还原3-NBS的影响,反应条件为细胞浓度0.15 g/L,3-NBS浓度0.2 mmol/L,乳酸钠浓度40 mmol/L,30 ℃,pH 7.2.
1.5 测定方法
菌体浓度测定:在600 nm处测定光密度(OD)(METASH,UV-5500紫外可见分光光度计).
3-NBS和3-ABS浓度测定:使用高效液相色谱仪(HPLC,LC-20AT,Shimadzu)测定,色谱柱型号为Sapphire-C18(5 μm,4.6 mm×250 mm),柱温箱温度为40 ℃;紫外检测波长为260和293 nm;流动相为80%超纯水(含1 g/L四乙基溴化铵),20%乙腈(色谱纯);流动相条件为流速1 mL/min,进样量10 μL.
使用假一级动力学模型来描述3-NBS的厌氧生物还原过程,假一级动力学常数k由下式计算得出:
ct=c0e-kt
(1)
式中:c0表示初始时刻3-NBS浓度,mmol/L;ct表示t时刻3-NBS浓度,mmol/L;t表示反应时间,h;k表示假一级动力学常数,h-1.
胞内外黄素样品制备与测定[21]:收集各个反应体系中的样品1 mL并离心(10 000g, 20 min,4 ℃),上清液过0.22 μm滤膜后用于测定胞外黄素浓度;菌饼使用磷酸盐缓冲液清洗并离心(10 000g,20 min,4 ℃),然后加入1 mL EB溶液振荡均匀,置于80 ℃水浴10 min后,离心(20 000g,20 min,4 ℃)并收集上清液,过0.22 μm滤膜后用于测定胞内黄素浓度.样品制备完毕后采用高效液相色谱-荧光检测器进行黄素类物质检测[21].
胞内蛋白物质测定:Bradford[22]法检测细胞蛋白含量.
GO反应前后的表征:使用X射线光电子能谱仪(XPS,ESCALAB 250Xi,Thermo Fisher)分析GO表面的化学组成成分.将反应后的菌液离心(10 000g,20 min,4 ℃),去掉上清液,将沉淀依次经2 mol/L氢氧化钠溶液、1 mol/L盐酸溶液、乙醇溶液和超纯水清洗后,最后将获得的材料进行冷冻干燥处理,研磨后进行光电子能谱表征,并与初始GO进行比较.
2 结果与讨论
2.1 细胞浓度对3-NBS生物还原的影响
如图1所示,随着细胞浓度的增高,3-NBS的厌氧生物还原速率明显增大;当细胞浓度为0.15和0.20 g/L时,菌株RQs-106在48 h内对3-NBS的去除率均在90%以上,去除速率分别为0.025 0和0.019 5 mmol/(h·g),因此后续实验采用细胞浓度为0.15 g/L.在反应过程中,还检测到还原产物3-ABS的生成.这表明,菌株RQs-106能够通过还原3-NBS将其去除.
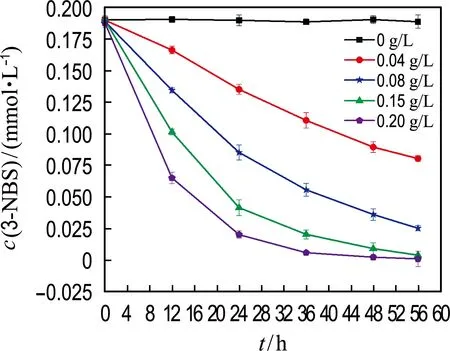
(a) 3-NBS还原
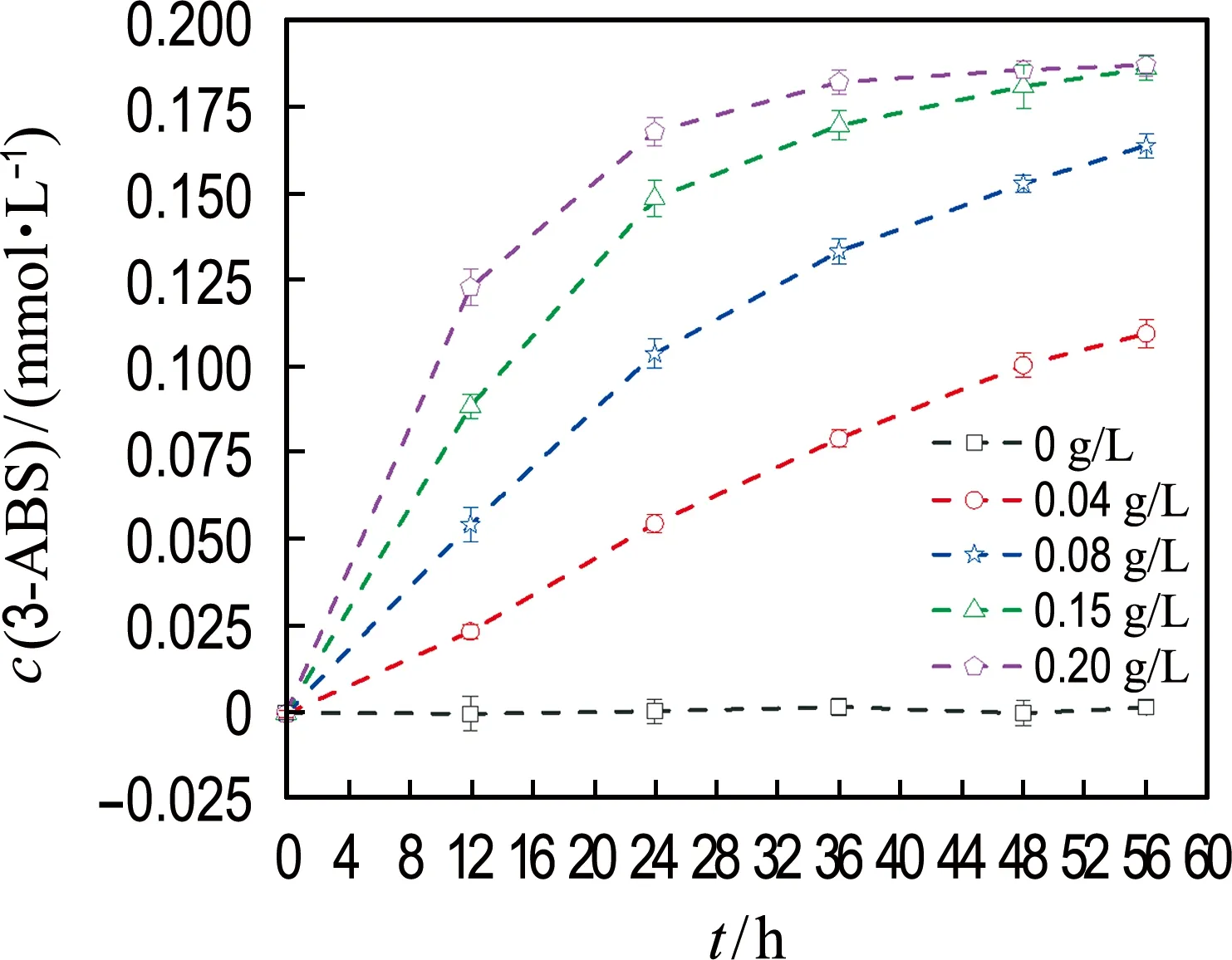
(b) 3-ABS生成
2.2 3-NBS浓度对生物还原及分泌胞外黄素的影响
本实验中3-NBS的厌氧生物还原过程遵循假一级动力学模型.如图2所示,随着3-NBS浓度的增高,假一级动力学常数k逐渐增大.当3-NBS浓度为1.00 mmol/L,k达到最大.在反应体系的上清液中检测到胞外黄素单核苷酸(FMN)和核黄素(RF).当3-NBS浓度为0 mmol/L,细胞分泌1.45 μmol/g黄素至胞外.随着3-NBS浓度的升高,胞外黄素浓度也呈现上升趋势,并呈正相关(R2=0.89).上述结果表明,3-NBS浓度的增高会刺激菌株RQs-106分泌更多黄素.研究表明,希瓦氏菌分泌的黄素在生物电解池系统中能够显著增强电流的产生,加速胞外电子传递速率[8].其加速机制包括黄素单核苷酸和核黄素通过与外膜细胞色素C(c-Cyts)特异性结合[23]传递电子和以游离型黄素作为氧化还原穿梭体的间接电子传递过程[12-13].因此,本实验检测到的这些黄素作为氧化还原介体加强了细胞与3-NBS之间的胞外电子传递过程,从而促进了3-NBS还原速率的增大.
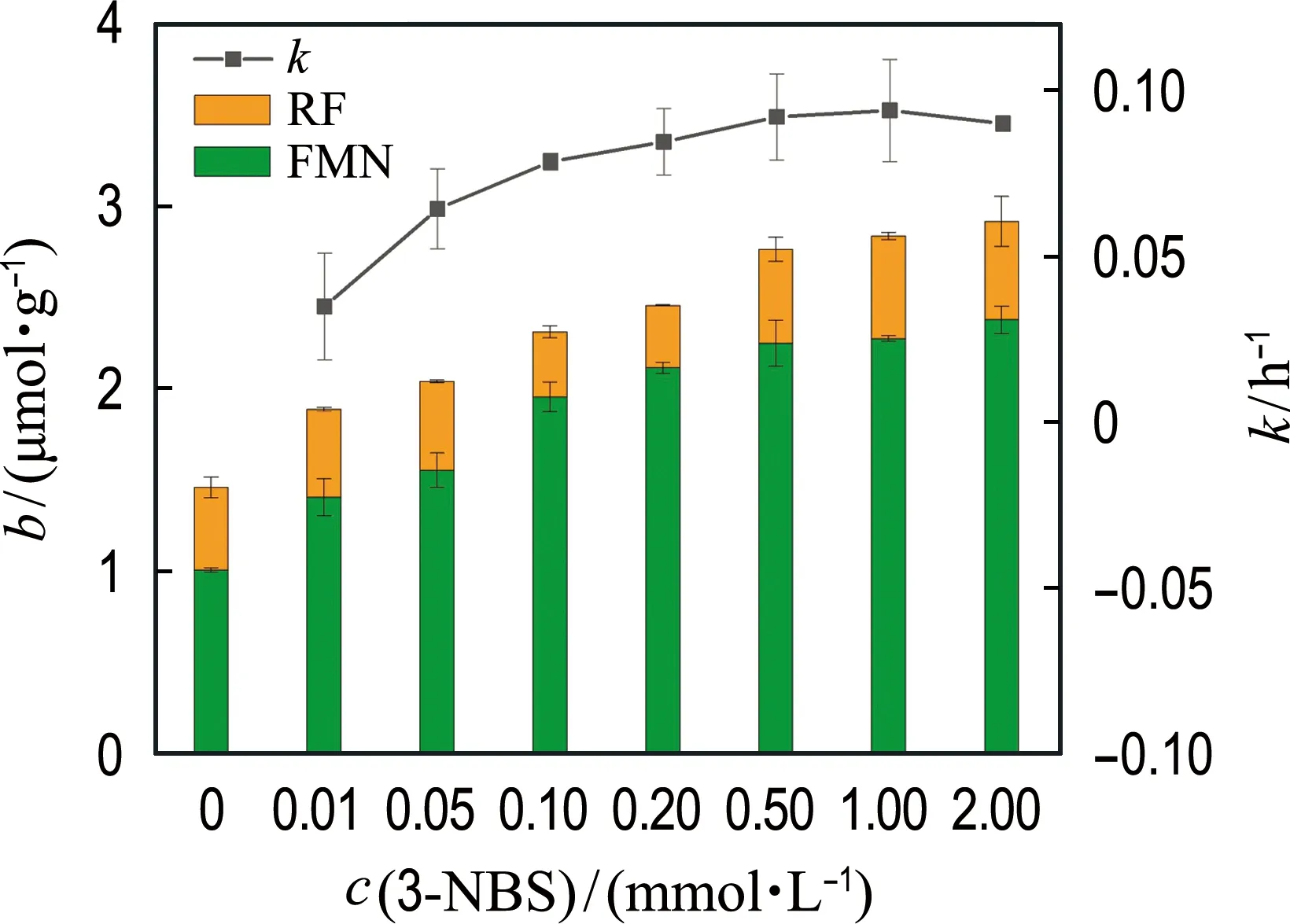
图2 3-NBS浓度对菌株RQs-106介导的生物
2.3 黄素对3-NBS生物还原的影响
比较了菌株RQs-106和菌株Δbfe还原3-NBS的能力,结果如图3(a)所示.与不加菌株的对照组相比,这两种菌株均具有还原3-NBS的能力,其还原3-NBS的动力学常数分别为0.074 h-1(ka,R2=0.93)和0.033 h-1(kb,R2=0.98).同时检测了胞内外黄素浓度的变化,如图3(b)所示,这两种菌株的胞内黄素浓度均随时间呈下降趋势,胞外黄素则逐渐增多,并且胞外黄素的增加量远高于胞内黄素的减少量,表明菌株RQs-106和菌株Δbfe均可以持续合成并分泌黄素.反应48 h后,胞外黄素浓度均达到最大,分别为2.41和1.86 μmol/g.可以看出,菌株Δbfe比菌株RQs-106胞外黄素分泌量减少了22.8%,这部分黄素对3-NBS生物还原的贡献率为55.4%.可见,菌株RQs-106厌氧还原3-NBS的过程是以乳酸钠为电子供体,将氧化产生的电子通过细胞外膜直接或者经黄素传递到胞外电子受体3-NBS,使其被还原为3-ABS.
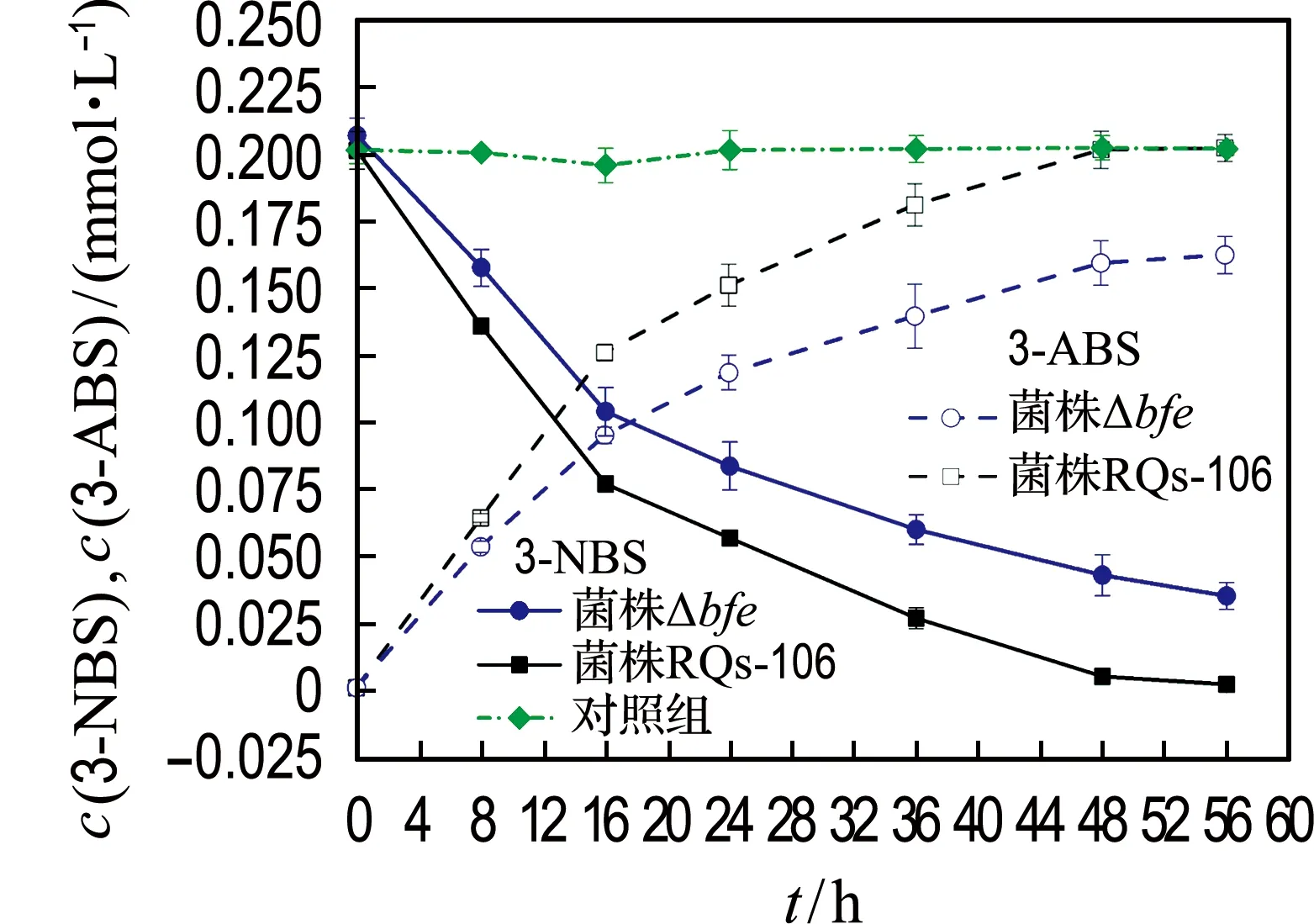
(a) 还原3-NBS
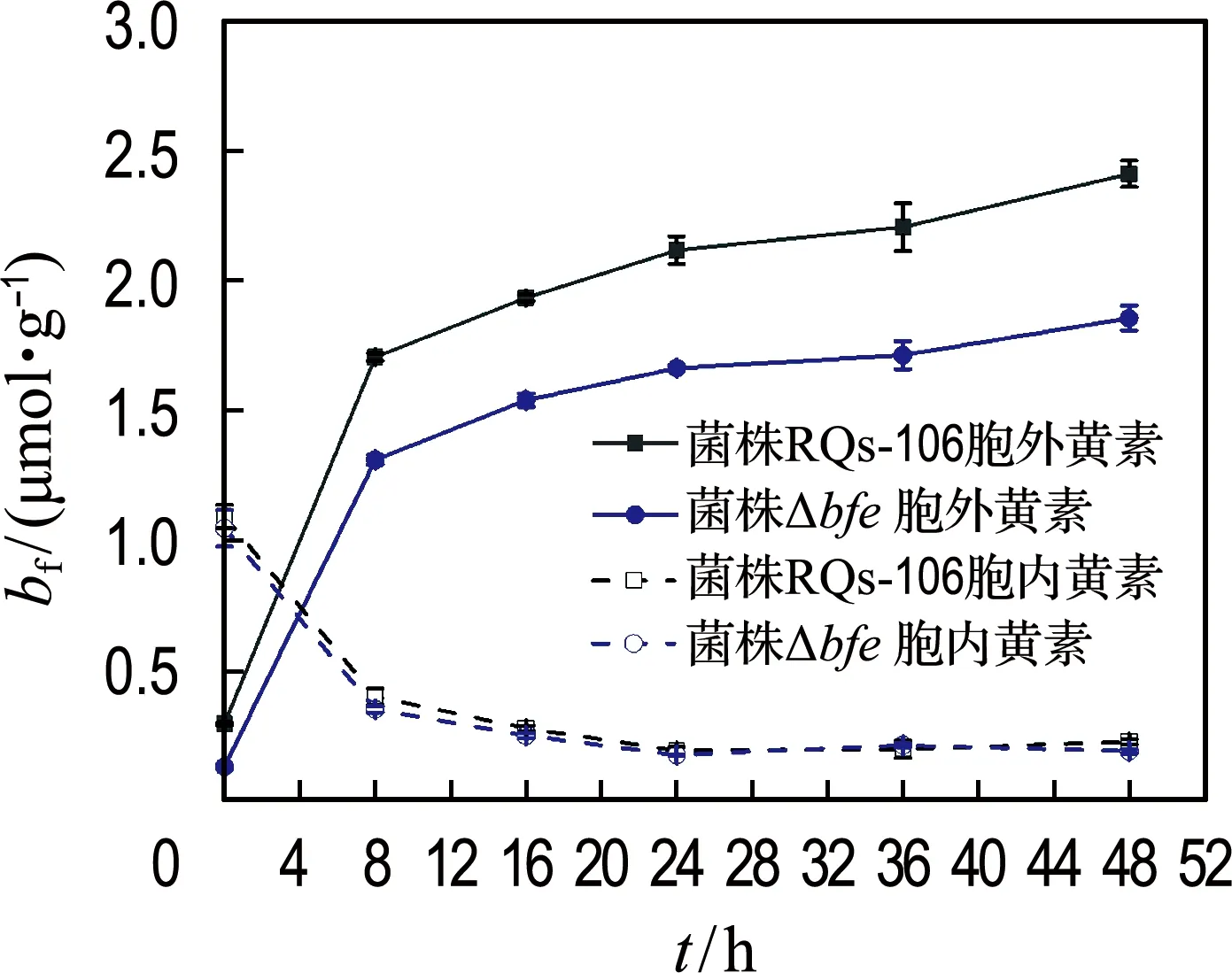
(b) 分泌黄素
2.4 黄素对GO介导的3-NBS生物还原的影响
如图4(a)所示,当加入20 mg/L GO时,菌株RQs-106和菌株Δbfe还原3-NBS的假一级动力学常数分别为0.122 h-1(kc,R2=0.99)和0.063 h-1(kd,R2=0.99).与图3(a)中无GO体系相比,GO介导的3-NBS还原速率分别提高了64.9%和90.9%.对反应体系中的GO进行XPS分析(图5)表明,反应42 h后,GO的n(C)/n(O)由反应初始的1.76增至1.96.上述结果表明,GO表面部分含氧基团被还原,即GO被还原为rGO.因rGO具有良好的电子传递性能,使其能够增大胞外电子传递速率,从而导致3-NBS还原速率增大.在GO存在条件下,bfe基因的缺失也导致了菌株Δbfe还原3-NBS的速率下降.这表明胞外分泌的黄素参与了GO介导的3-NBS还
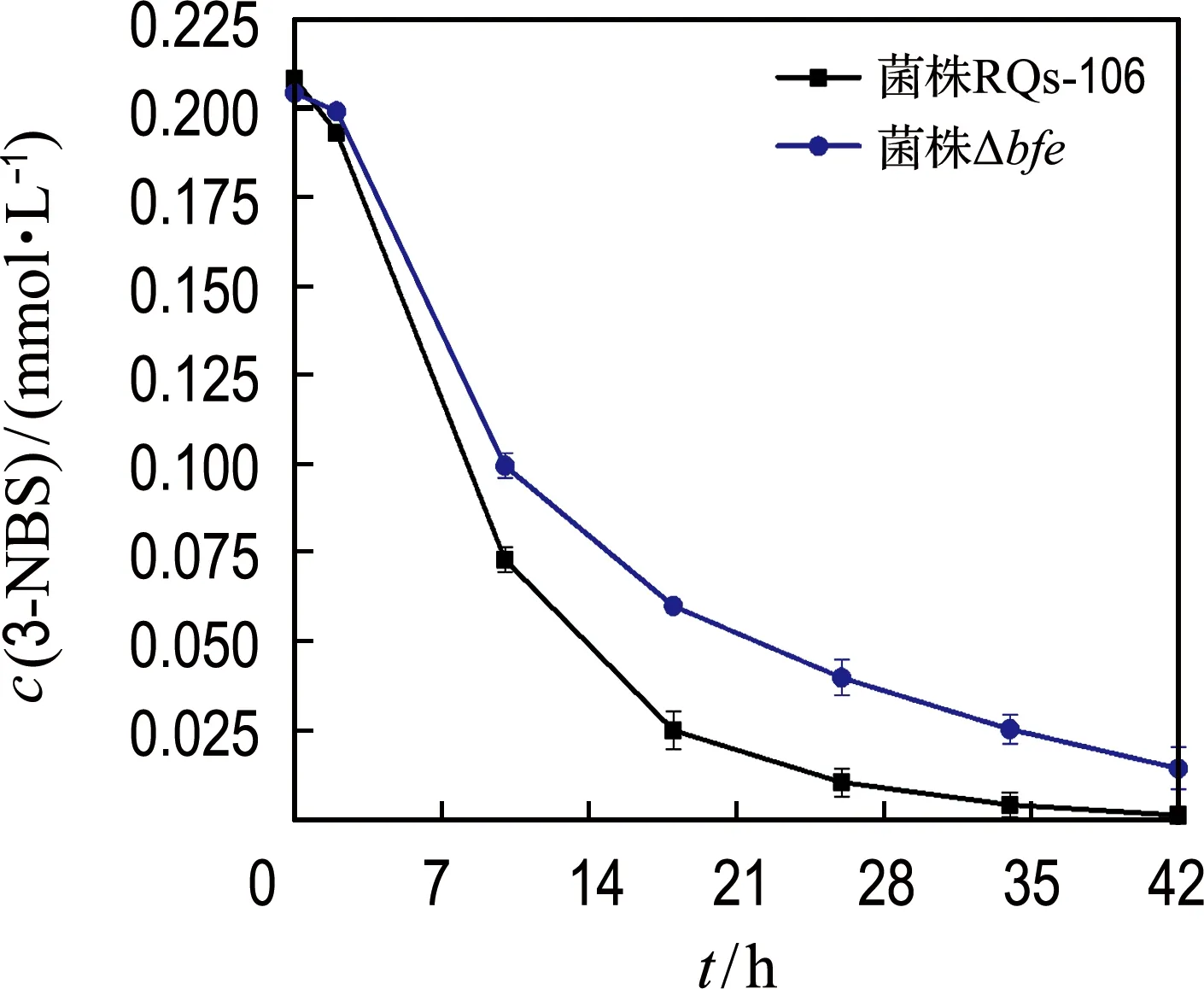
(a) GO介导3-NBS还原
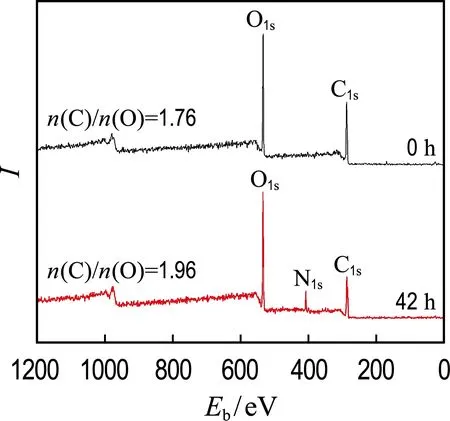
图5 GO反应前后的XPS图
原过程.反应42 h时,分析了反应体系中上清液以及细胞和GO复合体中的黄素,结果如图4(b)所示.菌株RQs-106体系中,细胞和GO复合体中的黄素浓度比菌株Δbfe体系略高,而其胞外游离的黄素浓度为2.12 μmol/g,比菌株Δbfe体系(1.52 μmol/g)高39.5%.这表明仅有少量的黄素吸附在GO上,参与了GO介导的3-NBS还原.
根据图3与图4中不同体系内3-NBS的还原速率,以20 mg/L GO介导的菌株RQs-106对3-NBS的假一级动力学常数为100%,经表1中的公式计算可得bfe基因缺失对不同体系中3-NBS还原的影响.如表1所列,bfe基因缺失会导致GO介导体系的3-NBS还原速率降低48.4%.其中,黄素对3-NBS直接还原的贡献率为33.7%,参与GO介导下的3-NBS还原的贡献率为14.7%.

表1 GO介导3-NBS厌氧生物还原体系中各部分贡献
外膜c-Cyts已被证明可作为电子穿梭体的胞外末端还原酶[24],缺失外膜蛋白MtrC和OmcA基因时,菌株MR-1还原3-NBS的速率会降低,但仍然具有还原能力[25].这表明菌株MR-1能够通过其他途径还原3-NBS.本研究发现,细胞分泌的黄素参与了3-NBS的厌氧生物还原.有研究表明,菌株MR-1分泌的黄素在细胞和外部电子受体之间能够循环进行电子穿梭作用[26].并且研究发现,在还原固态电子受体电极和不溶性铁过程中,胞外黄素的贡献率为75%~80%[8,14].可见,细胞分泌的微量黄素在还原固态电子受体过程中起到了重要作用.本研究发现胞外黄素对溶解态污染物3-NBS还原的贡献率超过了50%(图3),这表明胞外黄素在还原3-NBS过程中也起到重要作用.当外加固态电子传递体GO时,由于GO具有一定的吸附性能,黄素通过吸附到GO上来参与GO介导的3-NBS的还原.在这一过程中,黄素将电子传递给GO,使GO被还原为rGO.但黄素的贡献率并不高,推测可能是因为被吸附到GO上的黄素浓度很低,并且不能进行循环使用.在反应过程中,可以观察到细胞与GO易复合在一起.可见,GO主要是由细胞直接还原,从而加速3-NBS的还原.通过检测含有20 mg/L GO的反应体系中黄素的分布可知,游离态黄素浓度相对较高,因此其对3-NBS直接还原的贡献也较大.如果提高GO浓度,会有更多的黄素被吸附在GO上,但另一方面,GO浓度的提高也会对细胞产生更大的毒性[27].因此,可提高GO的吸附性能,使其能够吸附更多的胞外黄素,同时也可增强生物还原后的GO的氧化还原性能.
3 结 论
(1)当细胞浓度为0.15~0.20 g/L时,菌株RQs-106在48 h内对3-NBS的去除率均在90%以上.
(2)3-NBS浓度的增高会刺激菌株RQs-106分泌更多黄素类物质,从而促进3-NBS还原速率增大.
(3)bfe基因缺失导致GO介导体系的3-NBS还原速率降低48.4%.其中,游离态黄素对3-NBS还原的贡献率为33.7%,参与GO介导下的3-NBS还原的贡献率为14.7%.
本研究揭示了黄素在胞外高极性硝基芳烃污染物厌氧生物还原过程中的作用,以及在外加固态电子传递体GO条件下的贡献.为更深入阐明黄素的作用,底物浓度及电子传递体浓度的影响还有待研究,以期为细胞分泌的黄素类物质在实际环境污染物处理中的充分利用提供理论依据.
