生物基PEF和石油基PET微塑料对微藻生物效应
2023-11-30张瑛,张春香,姜敏,李钰炫,赵昱昊,周光远
张 瑛, 张 春 香, 姜 敏, 李 钰 炫, 赵 昱 昊, 周 光 远
( 1.大连理工大学 环境学院 工业生态与环境工程教育部重点实验室, 辽宁 大连 116024;2.中国科学院 大连化学物理研究所 能源材料研究部, 辽宁 大连 116023 )
0 引 言
据统计,2020年全球塑料产量高达3.67×108t[1],预计至2030年全球塑料垃圾年排放量可达5 300×104t[2],至2050年将有约120×108t的塑料垃圾被填埋或者排入自然环境中,约占人类产生垃圾总量的60%~80%[3].近几年医疗防护用品废料更加剧了当前的塑料污染状况.目前使用的塑料多为石油基塑料,不仅消耗大量的石油资源,且废弃后难以处理及降解,因此塑料垃圾在环境中能够长期存在,甚至被视为人类时代的地质指标.由此可见,塑料的生产及废弃所带来的环境风险问题不容忽视.
塑料在使用及废弃过程中,能够在物理磨损,以及生物、化学或光降解的作用下破碎成粒径小于5 mm的微塑料(MPs).目前,MPs被认为是一种新型环境污染物,在全球范围内的水体、沉积物、土壤和生物体等环境介质中[4-6]均被检测出来.其中,存在于水体中的MPs由于粒径小及疏水性强等特点,容易通过直接或间接方式对水生生物产生不利影响,如造成生长速率降低、摄食及繁殖能力下降、内分泌紊乱、出现炎症及基因损伤等[7].另外,MPs能够在食物链中不断积累,通过饮食甚至呼吸途径进入生物体内对健康造成威胁.因此,开展MPs生物效应及生态环境风险的相关研究显得尤为重要.
微藻,作为水生生态系统的初级生产者,在食物链中的地位至关重要.研究表明,MPs对微藻产生的生物效应是多方面的,包括影响微藻细胞的生长,降低光合作用,扰乱抗氧化平衡体系,阻碍生理生化活动,影响胞内胞外物质的分泌与积累等[8-10].同时,有研究指出MPs的生物效应与MPs的类型及暴露条件等有关[11],目前相关的研究多集中于石油基塑料,如聚丙烯(PP)、聚乙烯(PE)、聚苯乙烯(PS)、聚氯乙烯(PVC)等,对新型生物基塑料的相关研究还相对缺乏.
目前,为应对全球塑料污染及石油资源危机,生物基塑料的研发与应用成为新的行业热点.生物基塑料是指部分或全部以生物质为原料,如秸秆、玉米、甘蔗等,从中提取纤维素、木质素、脂类等物质作为单体合成的塑料,不仅能够大大降低对石油等化石能源的需求,同时可减少生产过程中对环境造成的污染[12].聚2,5-呋喃二甲酸乙二醇酯(PEF)作为一种新型的生物基塑料,其研发旨在替代石油基塑料聚对苯二甲酸乙二醇酯(PET).生物基PEF与石油基PET化学结构相似,但PEF具有更优异的气/水阻隔性和热性能,被认为是史上最有可能终结PET的材料[13].生物基PEF能够节约石油资源,并且在碳中和方面表现出巨大优势[14],但关于其环境生态风险还不甚了解.本文考察生物基PEF MPs在水环境中的生物效应,选用蛋白核小球藻作为受试生物,从细胞生长、叶绿素浓度、抗氧化平衡体系、胞外聚合物(EPS)分泌及胞内生化成分方面考察PEF MPs对微藻产生的影响及其相互作用,并首次将PEF MPs与被替代物石油基PET MPs进行对比及差异分析,为PEF替代PET的使用提供生态毒理学参考依据,为新型生物基塑料在实际应用中的生态风险评估提供研究基础.
1 材料与方法
1.1 MPs的制备及表征
研究对象生物基PEF和石油基PET均由中国科学院大连化学物理研究所提供[15].实验用的MPs是由大颗粒塑料经液氮冷冻后使用高速粉碎机研磨,清洗干燥后,用200目钢筛筛分所得.使用扫描电子显微镜(SEM,SU8010,日立,日本)、X射线衍射仪(XRD,D8 Advance,布鲁克,德国)以及傅里叶变换红外光谱仪(FTIR,6700,赛默飞世尔,美国)对MPs进行表征.
1.2 微藻的培养及MPs暴露
本实验使用的微藻为蛋白核小球藻(Chlorellapyrenoidosa),属普生性单细胞绿藻,富含多种有机物,繁殖能力强、生长周期短,是常用的水质评价指示生物.MPs对小球藻的生物效应实验根据OECD(No. 201)导则开展.在实验开始前,首先对藻种进行传代培养及扩大培养,取对数生长期的藻液进行MPs暴露,浓度分别为200、400、800 mg/L,以不添加MPs的藻液为对照组,实验共设7个处理组,每组3个平行样,暴露时间为96 h.使用250 mL锥形瓶培养微藻,选用常规BG-11培养基,在恒温光照培养箱中进行培养,光照强度为6 000 lx,温度为(25±1)℃,光暗比为12 h∶12 h.在培养过程中,每天定时进行3次摇动以及位置随机变换,以防止藻类沉淀并减小MPs分布不均或光照和温度差异所造成的误差.实验所用的玻璃器皿及培养基在使用前均进行高温高压灭菌,微藻的接种和暴露均在无菌操作台内进行.
1.3 生物效应指标测试方法
微藻的细胞生长抑制率,通过采用紫外分光光度计(UV-560,Jasco,日本)测定藻液在680 nm处的吸光度后计算得到[11].藻液的叶绿素(a+b)浓度,采用乙醇提取比色法[16]测定.微藻活性氧(ROS)含量、过氧化氢酶(CAT)及超氧化物歧化酶(SOD)活性,均采用试剂盒(南京建成生物工程研究所)及相应方法进行测定.微藻EPS的提取采用水热提取法进行[17],即取一定量的藻液于离心管中,40 ℃水浴加热2 h并伴随磁力搅拌,冷却至室温后离心获得上清液,测定上清液中EPS的含量,其中胞外蛋白质和胞外多糖分别采用考马斯亮蓝法(试剂盒,南京建成生物工程研究所)和蒽酮比色法[18]测定,并使用总有机碳(TOC)分析仪(multi N/C 2100S,耶拿,德国)测定胞外TOC含量.所有测定指标均取3个平行样.
1.4 微藻细胞与MPs的相互作用
暴露后的藻液经离心浓缩后使用2.5%戊二醛溶液进行细胞固定,并使用乙醇溶液进行梯度脱水,之后将样品进行冷冻干燥,样品经喷金处理后使用SEM观察微藻细胞在MPs表面的附着情况.
收集提取EPS之后的藻液,用400目滤网过滤以使MPs与微藻细胞分开,将离心浓缩后的微藻细胞冷冻干燥,使用FTIR测试干燥的微藻细胞样品,从而考察MPs对微藻细胞内生化成分的影响[19].
1.5 数据处理
采用单因素方差分析和事后多重比较(one-way ANOVA和Duncan)分析不同处理组之间的差异显著性.同一MPs不同浓度处理组间的差异显著性,采用不同的字母进行标注,相同浓度不同MPs处理组间的差异显著性(p<0.05)采用星号(*)标注.使用Origin 2021和SPSS 26.0作图和分析数据.数据表示为平均值±标准偏差.
2 结果与讨论
2.1 PEF和PET MPs的表征
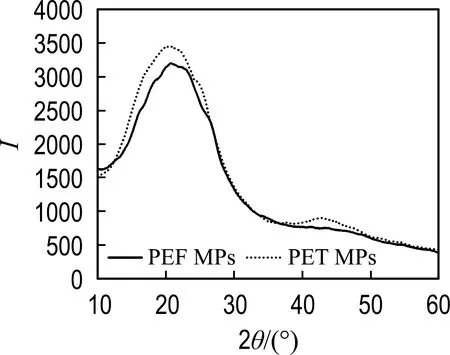
对实验中使用的PEF和PET MPs的物理化学性质进行了表征,其SEM、XRD及FTIR表征结果如图1和图2所示.
MPs的SEM图像和粒径分布如图1所示,PEF MPs的平均粒径为(57.47±19.41)μm,PET MPs的平均粒径为(65.83±19.13)μm,这说明本实验中使用的两种MPs颗粒大小相近;两种MPs呈现不规则的形状,颗粒表面粗糙且带有褶皱状,具有许多凹形结构,这可能增强了MPs颗粒表面的吸附能力.MPs颗粒表面粗糙度的不同,也是导致其生物效应差异的原因之一[20].

(a) PEF MPs

(b) PET MPs
(a) XRD
(b) FTIR

2.2 PEF和PET MPs对小球藻的生物效应及差异分析
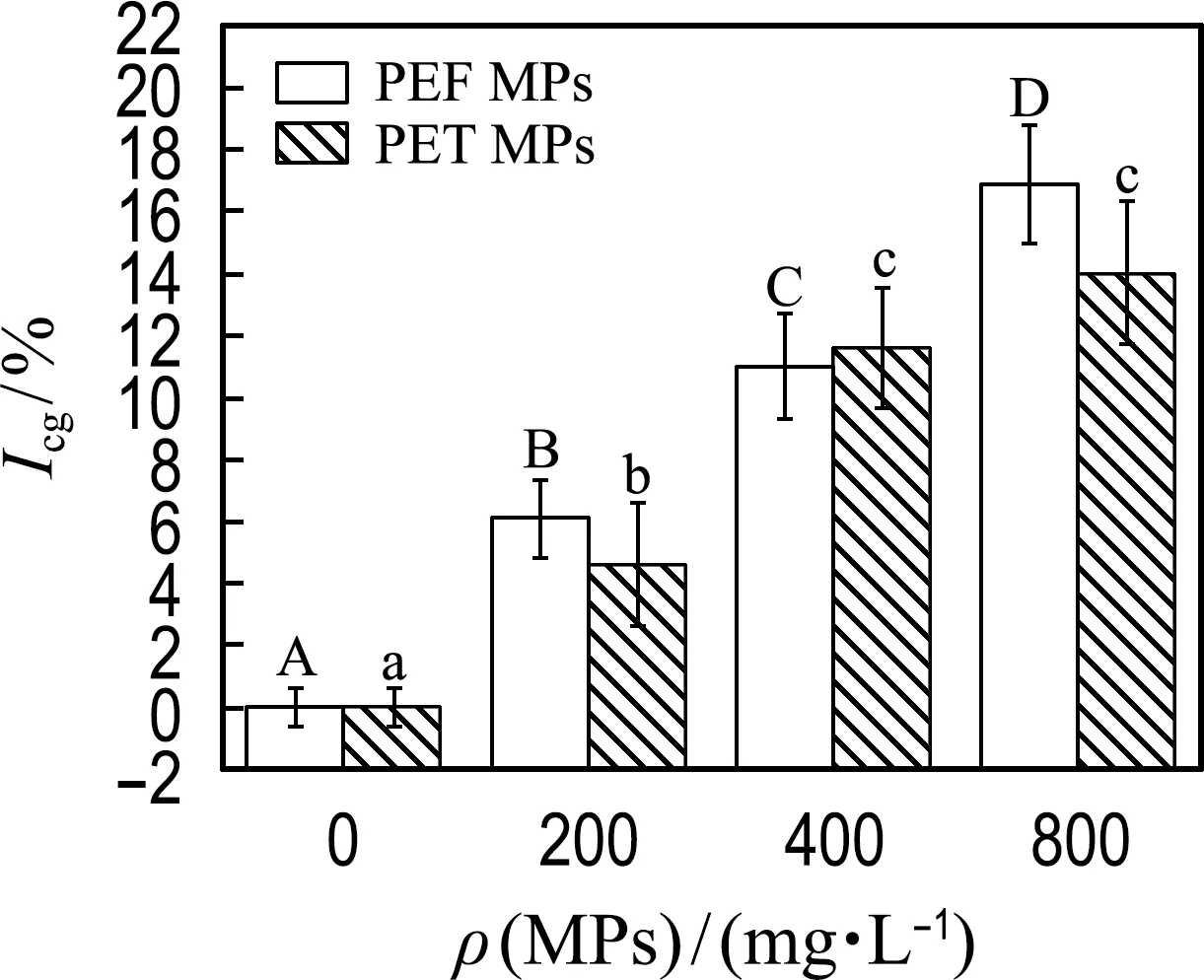
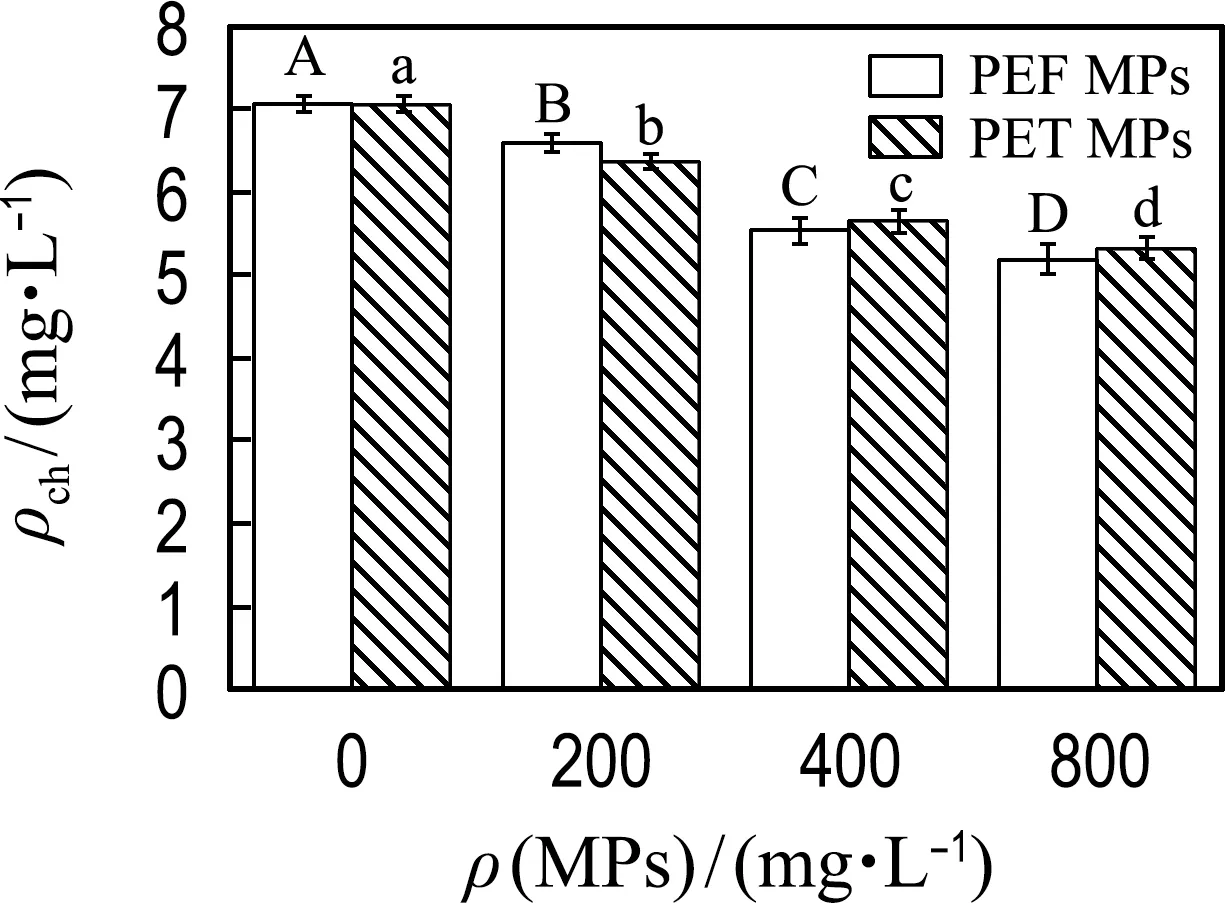
2.2.1 PEF和PET MPs对微藻细胞生长的影响 微藻细胞生长率和叶绿素浓度能够直接反映微藻种群的生长状况.为了比较培养基中不同浓度的PEF和PET MPs对小球藻生长的影响,对小球藻的细胞生长抑制率Icg及叶绿素浓度ρch进行了测定和比较,结果如图3所示.
(a) 细胞生长抑制率Icg
(b) 叶绿素浓度ρch
由图3(a)可知,当MPs浓度为200 mg/L时,抑制作用最小,PEF和PET MPs对小球藻细胞的生长抑制率分别为6.1%和4.6%;当MPs浓度为800 mg/L时,抑制作用最大,PEF和PET MPs对小球藻细胞的生长抑制率分别为17%和14%.因此,PEF和PET MPs均能够抑制微藻细胞的生长,并且抑制作用具有剂量依赖性;而相同浓度下,两种MPs对微藻细胞生长的抑制作用没有显著性差异.其他研究也有类似的发现,如PS、PE、PVC MPs均显著抑制杜氏盐藻[9]、莱茵衣藻[10]及普通小球藻[22]细胞密度的增大,这表明很多MPs对微藻的生长都具有不利影响;也有研究指出,PE MPs对扁藻种群生长没有显著影响[23],而对月牙藻种群生长具有促进作用[24].这说明MPs对微藻种群生长的影响不仅与MPs类型有关,也与微藻种类有关.MPs导致微藻细胞生长受到抑制,推测其原因是MPs的遮光效应[9]影响了小球藻类的光合作用,从而影响细胞的生长.
因此对小球藻细胞的叶绿素浓度进行了分析,如图3(b)所示,当MPs浓度为200、400和800 mg/L时,PEF和PET MPs使叶绿素浓度分别降低了6.6%~26%和9.8%~25%,说明MPs抑制了微藻的光合作用,并且抑制作用随MPs浓度的增大而增强,但两种MPs之间没有显著性差异.关于其抑制机理,有研究者指出石油基MPs(PVC和PP MPs)能够直接影响或破坏微藻细胞光合反应中心受体的氧化还原过程,阻碍胞内电子的转移与传递,从而降低光合作用效率,并进一步抑制细胞生长[25].
本研究表明PEF和PET MPs对微藻细胞生长和光合作用都具有抑制作用,但两者之间没有显著性差异,这表明PEF和PET MPs在结构及类型上的差异,并不足以引起两种MPs对微藻细胞生长的影响产生显著性差异.Zhu等的研究发现[26],不同类型的MPs,如PE、PVC、PS MPs等,对中肋骨藻细胞的生长抑制作用并未表现出显著性差异;也有研究发现,PP MPs能够抑制莱茵衣藻细胞增殖,而PE MPs对其没有显著性影响[27].因此,由于不同研究中使用的MPs类型、MPs粒径、暴露浓度、暴露时间以及微藻种类等条件存在差异,MPs对微藻细胞生长及光合作用的影响结果也不尽相同.由此可见,类似本研究这样的对比实验,能更好地比较不同MPs的生物效应.
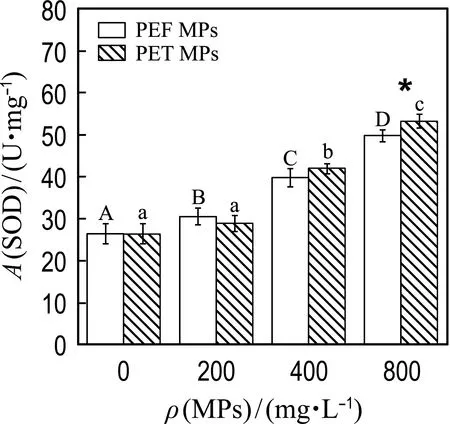
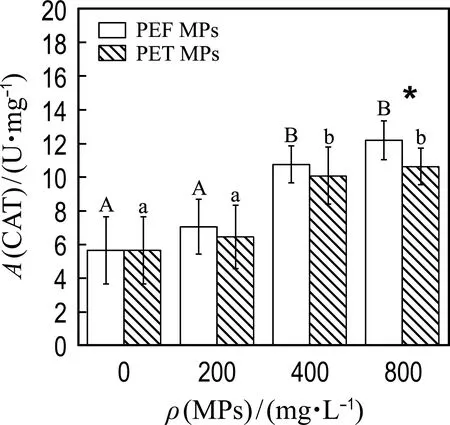
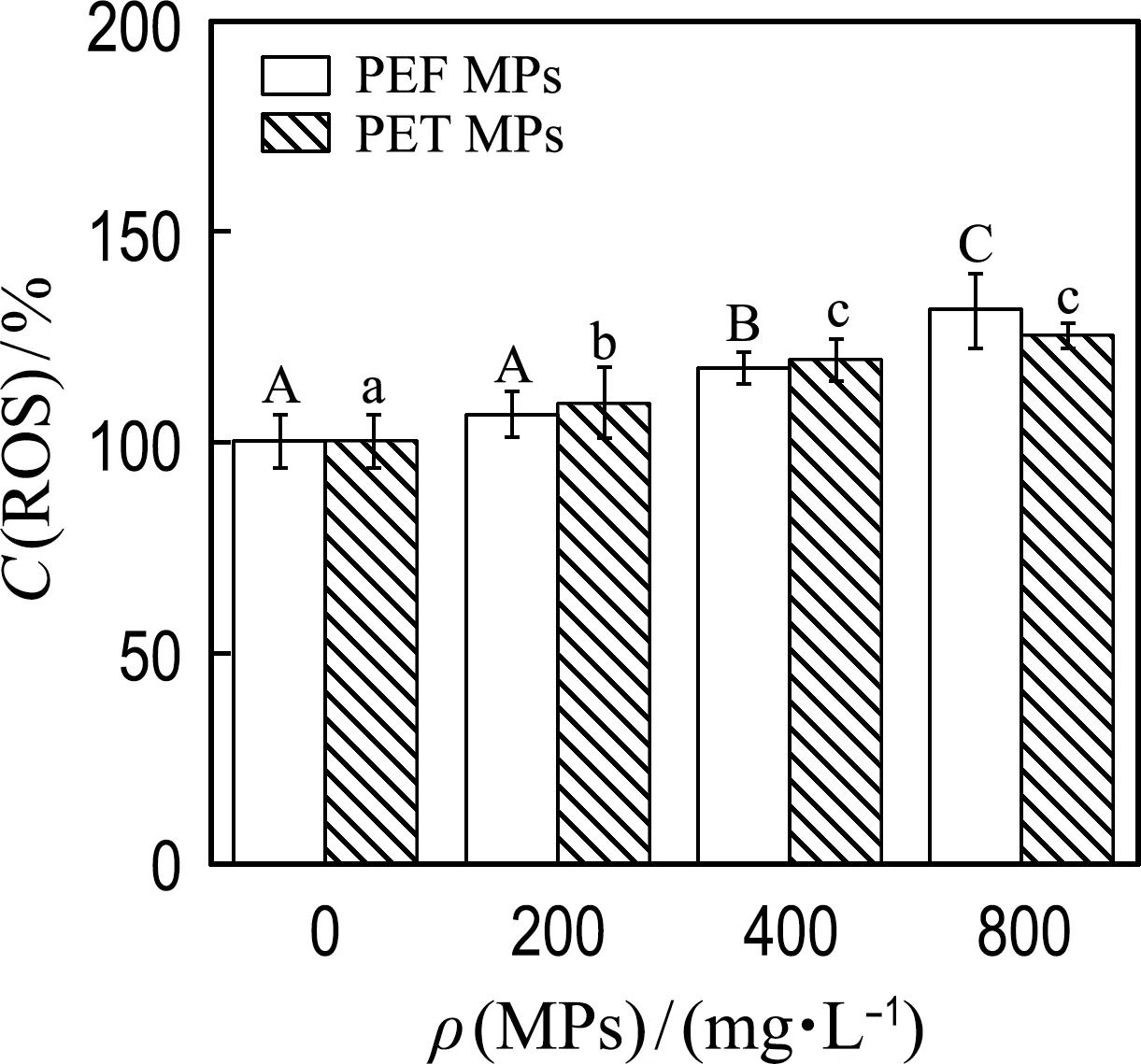
2.2.2 PEF和PET MPs对微藻细胞抗氧化平衡体系的影响 微藻细胞内存在抗氧化平衡体系使ROS的产生与清除维持动态平衡,ROS的过量积累会阻碍叶绿素合成等生理活动,降低微藻细胞代谢活性,而细胞能够通过调节抗氧化酶(SOD和CAT)的活性来缓解这种氧化损伤[28].为了比较培养基中不同浓度的PEF或PET MPs对小球藻抗氧化平衡体系的影响,测定了小球藻中SOD、CAT的活性及ROS相对含量.
如图4所示,PEF和PET MPs能刺激小球藻SOD、CAT酶活性的提高并诱导细胞内ROS积累,这是PEF和PET MPs对小球藻细胞产生氧化胁迫作用的结果.如图4(a)和(b)所示,当MPs浓度为400、800 mg/L时,PEF和PET MPs分别使得SOD酶活性提高了51%~88%和59%~101%,诱导CAT酶活性增加了90%~115%和78%~88%.浓度最高时,两种MPs对SOD和CAT酶活性的促进作用表现出显著性差异,同时,两种MPs对抗氧化酶活性的诱导均表现出剂量依赖性趋势.抗氧化酶活性的提高说明细胞内ROS水平的失衡,参照图4(c)中给出的两种MPs作用下小球藻细胞内ROS的积累情况,可以看出MPs能够诱导ROS的积累,且诱导作用随MPs浓度的增大而变大,这与SOD及CAT酶活性变化的规律一致.同时,在所有浓度条件下PEF和PET MPs对ROS的影响均没有表现出显著性差异.
(a) SOD酶活性
(b) CAT酶活性
(c) ROS相对含量
微藻细胞内ROS或MDA含量的增加能够反映MPs引起的氧化损伤或脂质过氧化的程度(细胞膜损伤),而抗氧化酶活性的提高表明微藻细胞在MPs刺激下产生了氧化应激.有研究[26]报道PE、PVC及PS MPs能显著提高中肋骨藻细胞MDA含量及SOD酶活性并且MPs浓度越高,其促进作用越强,这与本研究的结果一致.另外,在本研究中,当MPs浓度最大时,暴露于PEF和PET MPs下微藻细胞的抗氧化酶活性(SOD和CAT)存在显著性差异,这表明微藻细胞对不同类型MPs的氧化应激响应存在一定的差异性.
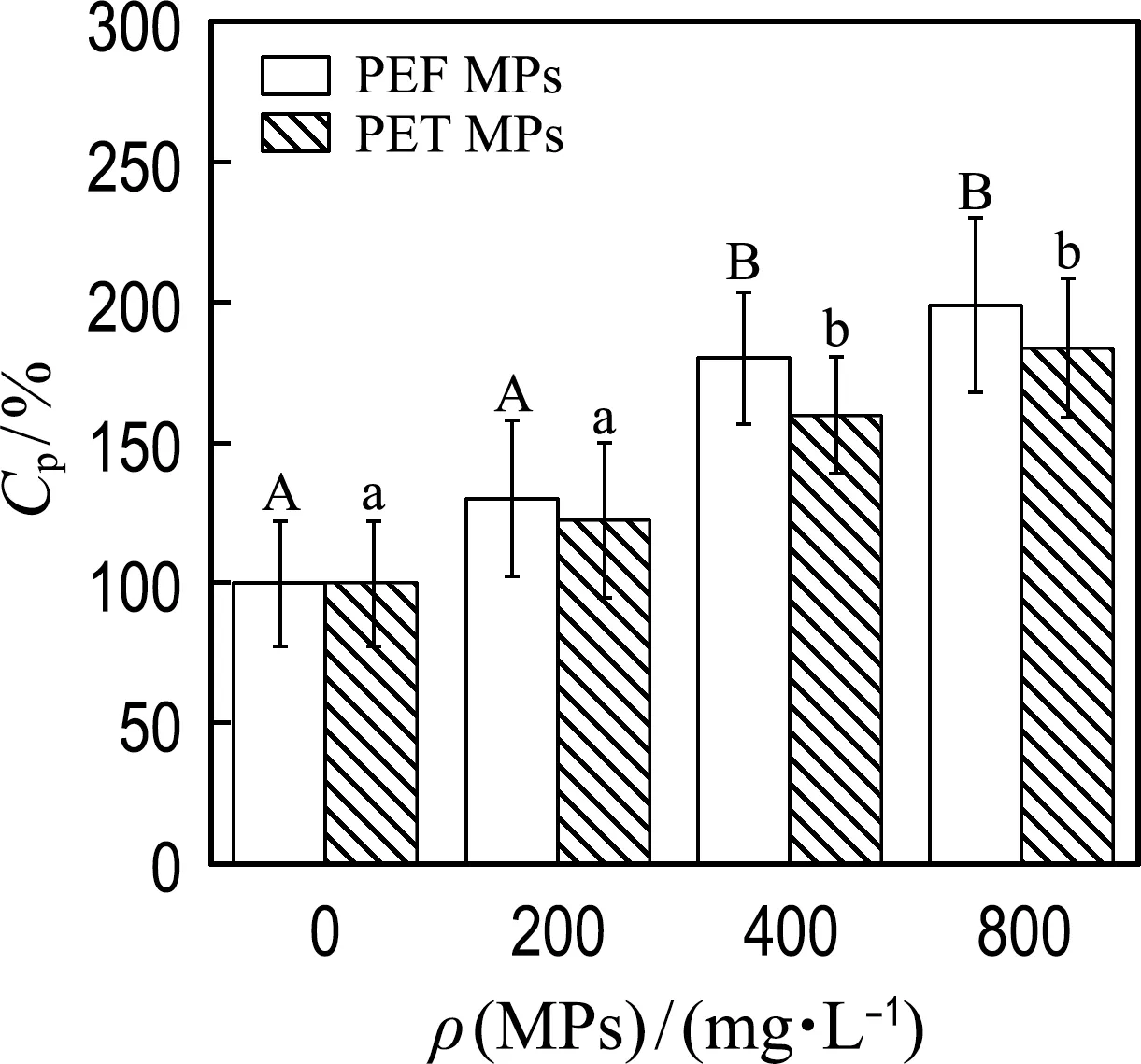
2.2.3 PEF和PET MPs对微藻细胞EPS分泌的影响 微藻能够分泌EPS来提高细胞表面的疏水性和黏性,从而加速细胞聚集和定殖,也可以增厚细胞壁以提高存活能力[29].胞外蛋白质和多糖是EPS的主要成分,胞外TOC可作为EPS总量的代表.为了比较培养基中不同浓度的PEF、PET MPs对小球藻EPS分泌的影响,测定了小球藻的胞外多糖、胞外蛋白质以及胞外TOC的含量(Cs、Cp和C(TOC)).
如图5(a)和(b)所示,PEF和PET MPs能够促进胞外多糖及胞外蛋白质的分泌,且促进作用随MPs浓度的增大而提高;当MPs浓度为400 mg/L时,PEF和PET MPs分别促使胞外多糖含量增加了59%和46%,两种MPs具有显著性差异,PEF MPs的促进作用大于PET MPs的.当MPs浓度为400、800 mg/L时,PEF和PET MPs分别使胞外蛋白质含量显著提高了30%~98%和22%~84%,而两种MPs没有显著性差异.如图5(c)所示,MPs浓度为200、400 mg/L时,PEF和PET MPs分别使胞外TOC含量增加了16%~44%和5.5%~37%,并且两种MPs具有显著性差异,PEF MPs的促进作用大于PET MPs的;当MPs浓度继续增大时,胞外TOC含量反而降低,这表明MPs对TOC的促进作用不具有明显的剂量依赖性.整体来看,PEF MPs对EPS的促进作用大于PET MPs的.上述研究表明PEF和PET MPs的存在刺激了微藻EPS的分泌.有研究发现,MPs使得微藻体内参与多糖生物合成的基因过度表达从而提高了胞外多糖的含量[27];也有研究发现暴露于MPs的微藻能够主动调整EPS的释放和组成,提高蛋白质/碳水化合物比例[30].富含多糖和蛋白质的EPS能够作为物理阻断或化学淬灭有害物质的保护屏障,有助于MPs的聚集和塑料表面生物膜的形成,从而利于细胞的自我防护[29].
(b) 胞外蛋白质
上述研究结果也表明,生物基PEF MPs对EPS分泌的促进作用大于石油基PET MPs.有研究表明,微生物的附着及定殖是塑料生物降解的先决条件,嵌入EPS中的微生物细胞形成的生物膜比单个浮游细胞更能定殖和降解疏水性底物[31].EPS不仅能够促进微生物在塑料表面的定殖,还含有多种胞外酶,能够在塑料生物降解过程中起到催化和水解作用[32].因此,从另一个侧面,即EPS对MPs的降解角度来看,生物基PEF MPs更容易促进EPS的分泌,因此也有可能更容易被水生生物产生的EPS所降解.
2.3 PEF和PET MPs与微藻细胞的相互作用
为了考察PEF和PET MPs与微藻细胞之间的相互作用,对微藻细胞和MPs进行了SEM和FTIR表征,结果如图6所示(图6(b)图例中数字代表浓度,F和T分别代表PEF MPs和PET MPs).
由图6(a)可见,PEF和PET MPs的粒径远大于微藻细胞的,并且形状不规则,粗糙的颗粒表面及褶皱结构为微藻细胞提供了大量的附着位点,因此许多微藻细胞附着在MPs的表面、褶皱或缝隙处,有的MPs几乎被微藻细胞完全包裹起来,形成微藻-MPs异质聚集体.微藻细胞在两种MPs表面的附着情况没有明显的差异.由于EPS富含多糖和蛋白质,具有更高的黏性,因此大量的细胞黏附在PEF和PET MPs颗粒表面;MPs也可以通过静电引力、氢键结合、疏水作用等方式与微藻形成异质聚集体[33].这种异质聚集体会造成藻类的沉淀,或者通过吸附营养元素造成微藻生长所需营养的限制,从而影响其生长[27,34-35].另外,较小的微藻黏附在较大的MPs表面也会影响藻类对光能的吸收,对光合效率和传质产生负面效应,最终抑制细胞生长.

(a) SEM
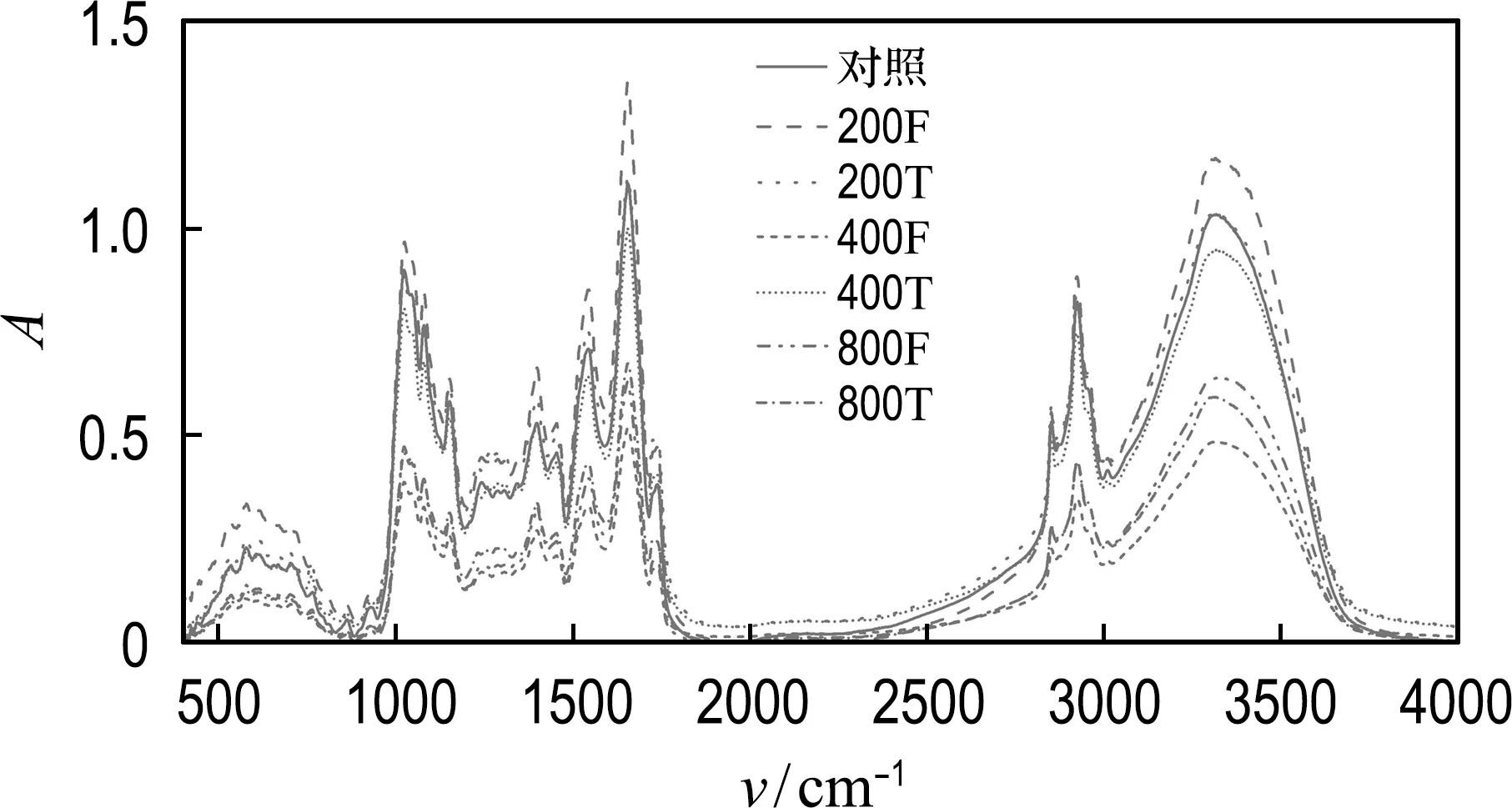
(b) FTIR
为考察PEF和PET MPs对微藻细胞内大分子物质的影响,使用FTIR对小球藻细胞进行了表征.如图6(b)所示,各处理组小球藻细胞的红外吸收光谱在3 312~3 322 cm-1、2 852~2 926 cm-1、1 399~1 656 cm-1及1 025~1 154 cm-1波数范围内出现特征峰,这些位置代表的物质分别为多糖、脂质、蛋白质及多糖[36].结果表明,除200 mg/L的PEF MPs处理组以外,PEF和PET MPs的存在使得小球藻细胞内多糖、脂质和蛋白质类大分子物质含量明显降低,并且MPs浓度越高,大分子物质含量越低,这说明水环境中MPs的存在可能阻碍小球藻细胞内大分子物质的合成与积累.
有研究也有类似的发现,如PE、PP和PVC MPs的存在可以改变富油栅藻细胞的生化成分,使小球藻细胞内的蛋白质、脂质及碳水化合物的含量降低[19];PP、PE和PET MPs能够降低螺旋藻细胞内蛋白质及多糖类物质生产力甚至导致某些物质的消失[37-38].为应对外界环境胁迫,微藻细胞可能会通过改变大分子物质含量及比例来调节细胞活动,因此,为进一步探索微藻与MPs的相互作用机制以及相关的代谢变化,还需要借助更多分子层面的相关研究.
3 结 语
本研究以蛋白核小球藻为例,考察了生物基PEF MPs和石油基PET MPs的生物效应.水环境中存在200、400、800 mg/L的PEF和PET MPs均能够在不同程度上抑制微藻细胞的生长,破坏其光合作用及抗氧化系统的平衡,并且刺激微藻EPS的分泌.通过对微藻和MPs之间相互作用的分析发现,微藻细胞能够大量黏附在MPs表面形成微藻-MPs异质聚集体,而MPs能够降低微藻细胞内多糖、脂质、蛋白质类大分子物质的含量.PEF和PET MPs对小球藻的生物效应表现出一定的差异性,尤其是在EPS的产生方面,PEF MPs的促进作用大于PET MPs的,这间接表明生物基PEF MPs可能具备更好的生物降解性能.本研究为不同来源(生物基或石油基)MPs的生物效应研究提供了基础数据,为生物基MPs的环境风险评估提供了研究基础.
