CD36 抗体引起的胎儿新生儿同种免疫性血小板减少症中人脐静脉内皮细胞通透性作用机理的初步研究*
2023-11-30唐颖怡陈大伟夏文杰徐秀章叶欣何博
唐颖怡 陈大伟 夏文杰 徐秀章 叶欣 何博
(广州血液中心 广州市血液安全重点实验室,广东 广州 510095)
胎儿新生儿同种免疫性血小板减少症(FNAIT)是由于母体与胎儿之间的血小板抗原不相容而导致胎儿/新生儿血小板减少的妊娠相关疾病[1]。 临床表现为血小板减少至轻度的皮肤出血(瘀斑和瘀点),有时会出现内脏器官出血,更严重者会发生颅内出血(intracranial hemorrhage, ICH)[2]。新生儿出现严重FNAIT 的发生率约为1 ∶1 000,其中20%左右会发生ICH[3-4]。 FNAIT 是由于母体和胎儿的血小板抗原不相容,母体针对胎儿的血小板抗原产生了血小板抗体,这些抗体结合不相容的胎儿血小板并促进其从循环中清除所导致的[5]。 近年来,CD36 抗体引起胎儿/新生儿同种免疫性血小板减少症的病例屡见报道,胎儿/新生儿出现血小板减少的同时会出现胎儿水肿的症状,严重者会导致胎儿死亡[6-9]。 本研究组一直致力于CD36 抗体引起胎儿水肿机理的探索,根据本研究组前期研究,CD36 抗体可以通过增加红细胞前体细胞的凋亡,从而影响红细胞的生成,引起胎儿宫内贫血,从而引起胎儿水肿[8]。 此外,我们还在CD36 抗体引起的FNAIT 模型中,发现CD36 抗体可以影响胎盘内皮细胞的血管形成,进而影响胎盘的发育导致胎儿血小板减少和死亡[10]。 但是CD36 抗体能否增加血管内皮细胞通透性,进而导致胎儿水肿尚未见报道。 我们拟在前期建立的CD36 单克隆抗体的基础上,研究CD36 单克隆抗体对于人血管内皮细胞通透性的影响,现报道如下。
1 材料与方法
1.1 细胞和抗体
1.1.1 人外周血单个核细胞(PBMC) 选取2020 年2—6 月CD36 抗原表达阳性(CD36+/+)的献血者,抽取外周血,利用Ficoll 法离心获得人PBMC。 按照5.0×105/200 μL 的密度接种于96 孔板中。
1.1.2 人脐静脉内皮细胞(HUVEC) 选取2020 年1—6 月人脐静脉内皮细胞来源于新鲜的脐带,经过酶处理消化获得。 所有脐带均获得孕产妇的知情同意。
1.1.3 CD36 单克隆抗体 利用稳定表达人血小板CD36 的HEK293T 细胞免疫CD36-/-小鼠,获得CD36 抗体阳性的小鼠脾脏,然后与骨髓瘤细胞SP2/0-Ag14 进行细胞融合,利用有限稀释法获得单克隆细胞株[11]。 首先用含10%胎牛血清的RPMI 1640 培养基饲养单克隆细胞株,待细胞数充足,转移至无血清培养基中培养1 周,离心取无细胞培养上清。 收集单克隆细胞株的细胞培养上清,并借助Protein G 亲和层析柱分离纯化CD36 单克隆抗体,利用BCA 法进行单克隆抗体浓度测定[11]。
1.2 主要材料与试剂 CD36 单克隆抗体(克隆号:FA6-152)(批号:HM2122,Hycult 公司);BCA protein assay kit(批号:23225,Thermo 公司);兔抗鼠IgG-FITC(批号:F0313,Dako 公司);RPMI 1640(批号:C11875500BT,Gibco 公司);CD无血清培养基(批号:11279023,Gibco 公司);Protein G 亲和层析柱(批号:SH-34-1608-07,中科森辉);Ficoll 淋巴细胞分离液(批号:17144002,GE 公司);EBM-2 内皮细胞培养基(批号:CC-3162,Lonza 公司);FITC-albumin(批号:A9771,Sigma-Aldrich 公司);人TNF-α 和IL-1β 细胞因子检测试剂盒(批号:DY210,DY201,R&D system 公司);细菌内毒素(LPS,Escherichia coli O111:B4) (批号:L2630,Sigma-Aldrich 公司);Collagenase Ⅱ型(批号:17101015,Gibco 公司);transwell培养小室,(批号:3470,Corning 公司);CD31 抗体(批号:ab9498,Abcam 公司);Donkey anti-Mouse IgG (H+L) Alexa Fluor 488(批号:A-21202,Thermo 公司);同型对照抗体(mouse isotype IgG2a,批号:BP0085,BioXcell 公司)。
1.3 CD36 单克隆抗体流式细胞检测 选取CD36 表达阴性和阳性的献血者各1 人,抽取5 mL 外周血,EDTA 抗凝,提取PBMC。 将PBMC(5.0×105)与0.5 μg 的CD36 单克隆抗体在4℃条件下孵育30 min,阳性对照为单抗FA6-152,PBS/1%FBS 洗涤PBMC 后,二抗使用兔抗鼠IgG-FITC(1:100 稀释),4℃避光孵育30 min,PBMC 洗涤后重悬上流式细胞仪检测。流式细胞检测数据使用软件FlowJo 进行分析。
1.4 CD36 单克隆抗体与人PBMC 共同孵育 将人PBMC接种于96 孔板中,加入10 μg/mL 的CD36 抗体,置于37℃,5% CO2的细胞培养箱中共同培养20 h。 利用LPS(1μg/mL)作为阳性对照。 共同孵育后,12 000 g 离心,取无细胞培养上清,冻存于-80℃,备用。
1.5 细胞因子检测 利用ELISA 法检测CD36 单克隆抗体与人PBMC 共同孵育的细胞上清中的细胞因子。 按照ELISA 试剂盒的说明书,分别检测细胞上清中TNF-α 和IL-1β 的浓度。
1.6 人脐静脉内皮细胞提取和培养 截取15 ~20 cm 的新鲜的脐带,利用50 mL 的针筒对脐静脉进行冲洗,直到无血水为止。 将脐带一段用手术带结扎后,在另一端的静脉插入钝口针头,用手术带捆绑结实,将含有Collagenase Ⅱ型的洗液注入静脉中,直至静脉充盈为止。 将脐带置于干净的手术盘中,转移至细胞培养箱孵育20 min。 孵育后,轻轻按摩脐带壁,充分使细胞脱离,将结扎的一段剪开,将脐带中的消化液转移至50 mL 离心管中,继续充分冲洗并收集冲洗液。 将离心管进行离心,400 g,5 min,弃掉上清。 将管底的细胞用内皮细胞培养基重悬后,置于培养瓶中进行培养。 待培养瓶中的细胞长满时,对细胞进行传代,收集部分细胞进行流式细胞鉴定,获得人脐静脉内皮细胞。
1.7 人脐静脉内皮细胞鉴定 通过流式细胞技术检测分离的细胞是否是脐静脉内皮细胞。 收集1.0×106个细胞,用PBS/1% FBS 洗涤1 次后,加入抗-CD31,在4℃条件下孵育30 min,洗涤1 次后,二抗使用Donkey anti-Mouse IgG (H+L)Alexa Fluor 488(1 ∶100 稀释),4 度避光孵育30 min,重悬,进行流式细胞检测。 使用isotype IgG FITC 作为同型对照。 流式细胞检测数据使用软件FlowJo 进行分析。
1.8 内皮细胞通透性检测 首先,将1.0×105个passage 5 代的HUVEC,接种于0.4 μm 的transwell 培养小室中,培养箱中培养1~2 d,待细胞形成完整的单层细胞层。 将CD36 单克隆抗体和PBMC 孵育后的细胞培养上清加入内皮细胞上层(50%,v/v 体积比),transwell 下室加入600 μL 的内皮细胞培养基,细胞培养箱中培养6 h。 之后,将tranwell 培养上室中的液体换成含有FITC-albumin(400 μg/mL)的培养基,培养箱中孵育2 h 后,利用荧光检测酶标仪FLX-800,检测transwell 下室中FITC-albumin 的荧光强度,这反映了HUVEC 的通透性。
2 结果
2.1 CD36 单克隆抗体可以与人单核细胞结合 首先,检测此CD36 单克隆抗体能否与人的单核细胞结合。 将CD36 单克隆抗体与分离的人PBMC 进行孵育,和商业化的CD36 单克隆抗体(FA6-152)一样,我们的CD36 单克隆抗体也可以识别人单核细胞表面的CD36 抗原(图1)。
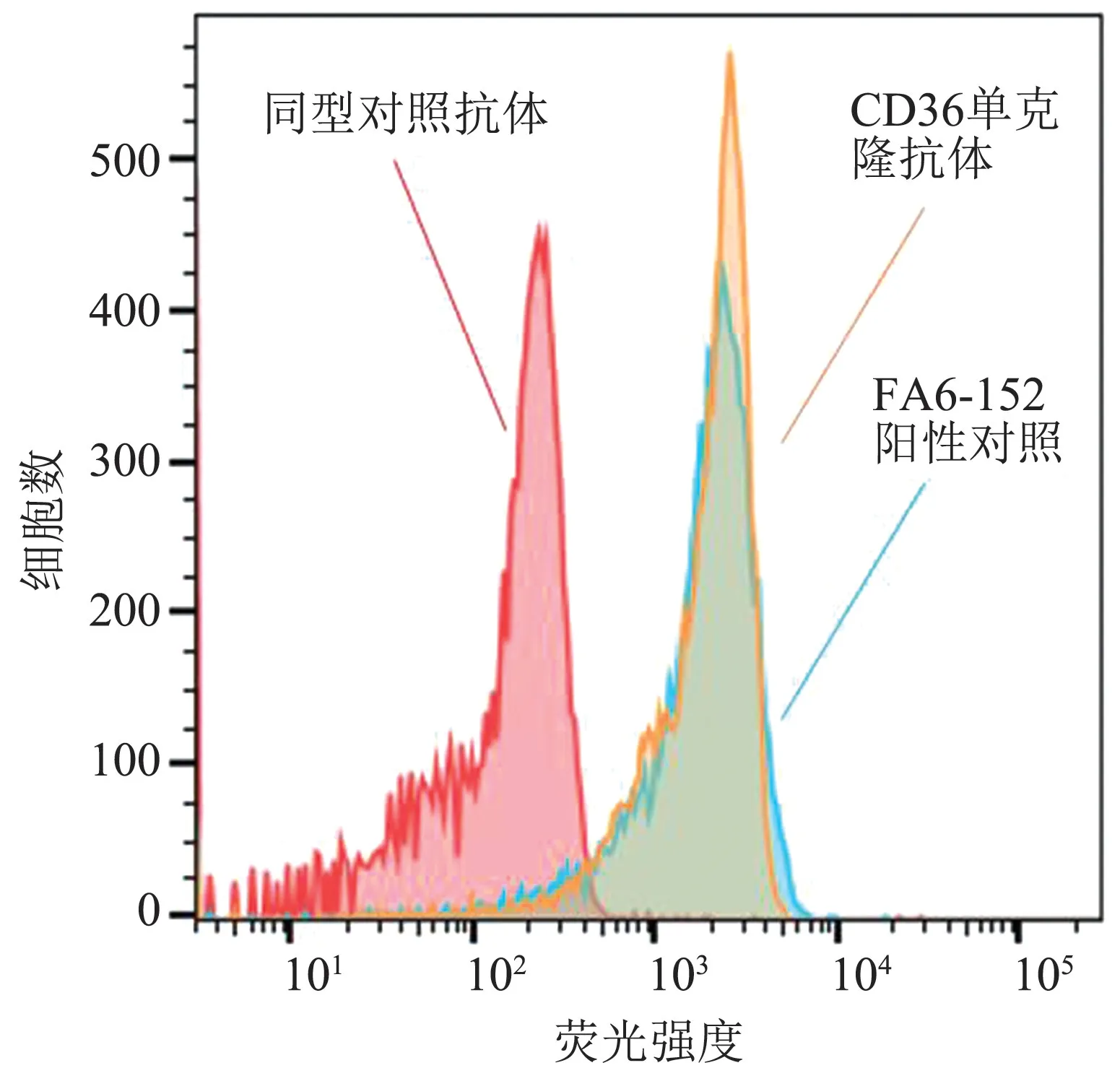
图1 CD36 单克隆抗体与人PBMC 流式细胞检测图
2.2 CD36 单克隆抗体与人PBMC 共同孵育的细胞上清中分泌细胞因子TNF-α 和IL-1β 将CD36 单克隆抗体与人PBMC 共同孵育后,检测细胞培养上清中的细胞因子浓度。与同型对照抗体相比,CD36 单克隆抗体可以刺激人PBMC产生TNF-α(pg/mL)(407.73±20.40vs29.38±4.72,P<0.05)和IL-1β(pg/mL)(247.14±83.59vs53.68±26.96,P<0.05)(图2)。
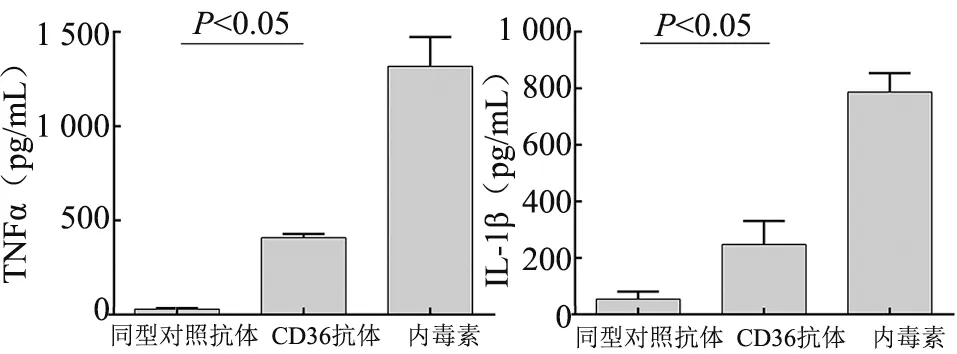
图2 CD36 抗体与人PBMC 孵育细胞上清中TNF-α 和IL-1β 浓度检测图
2.3 HUVEC 形态学检查和流式细胞检测 将酶消化获得的人脐静脉内皮细胞饲养后,进行形态学检查和流式细胞术鉴定。 显微镜下观察,细胞呈现鹅卵石样和铺路石样,符合HUVEC 的形态学特征。 通过流式细胞技术对HUVEC 细胞表面的标记蛋白-CD31 的表达情况进行检测,结果发现,细胞高表达CD31。 综上所知,由脐静脉所得的细胞是HUVEC(图3、图4)。
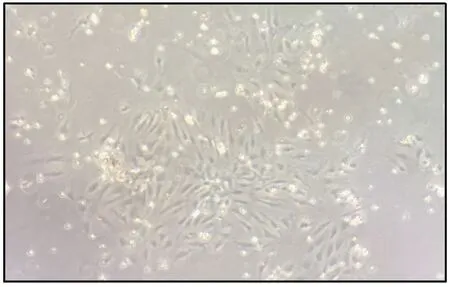
图3 HUVEC 细胞形态学检查
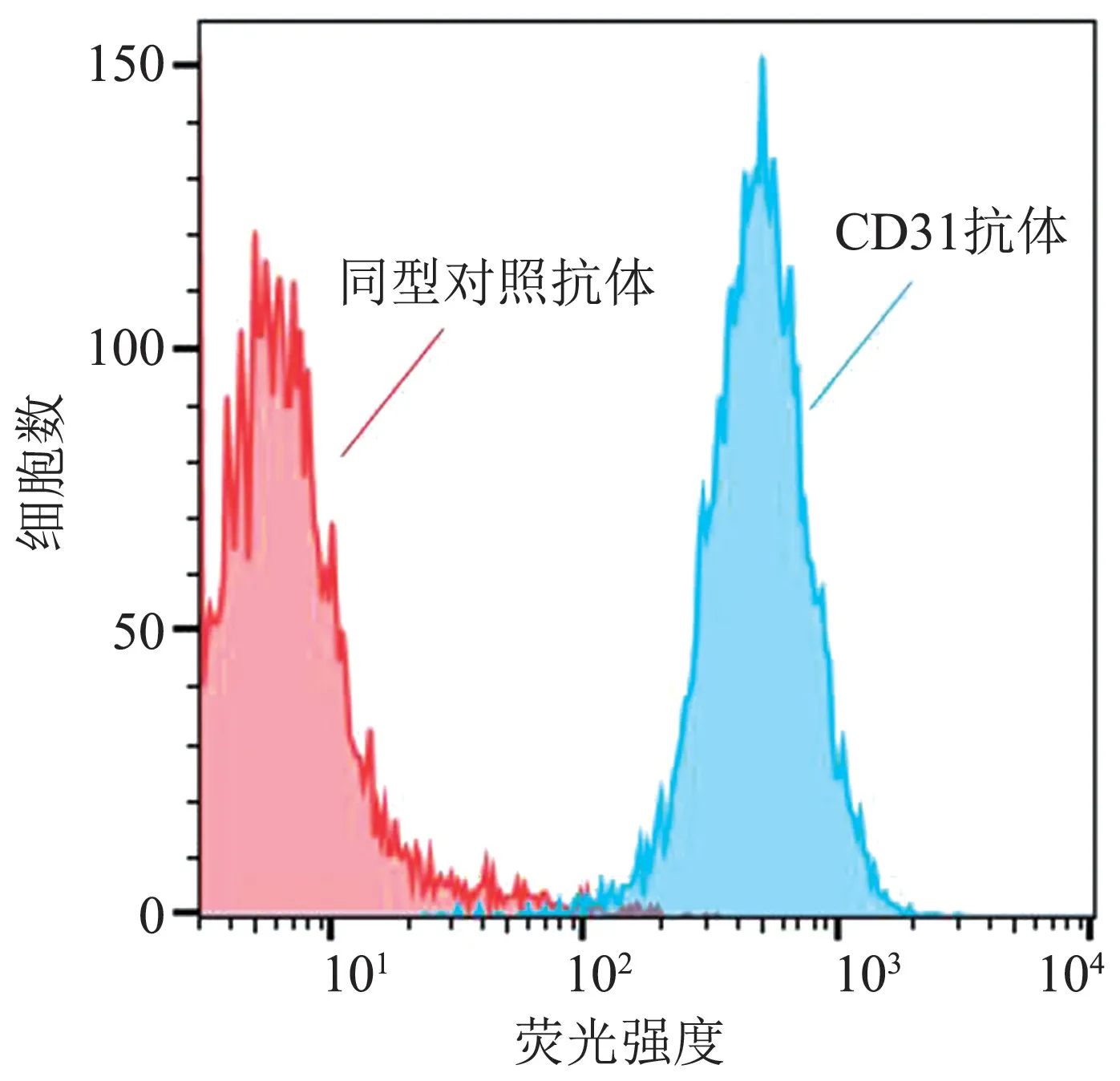
图4 HUVEC 流式细胞检测图
2.4 HUVEC 通透性检测 CD36 单克隆抗体与人PBMC 共同孵育后,将获得的富细胞因子上清加入HUVEC 的单细胞层上,通过检测transwell 下室中FITC-almumin 的荧光强度来检测内皮细胞的通透性。 与同型对照抗体相比,单独加CD36 单克隆抗体实验组的荧光强度是322±6vs315±3,P>0.05,未见HUVEC 通透性增加。 而与同型对照抗体孵育的上清相比,CD36 单克隆抗体孵育所得上清的实验组的荧光强度是492±16vs320±11,P<0.05,HUVEC 的通透性显著增加(图5)。
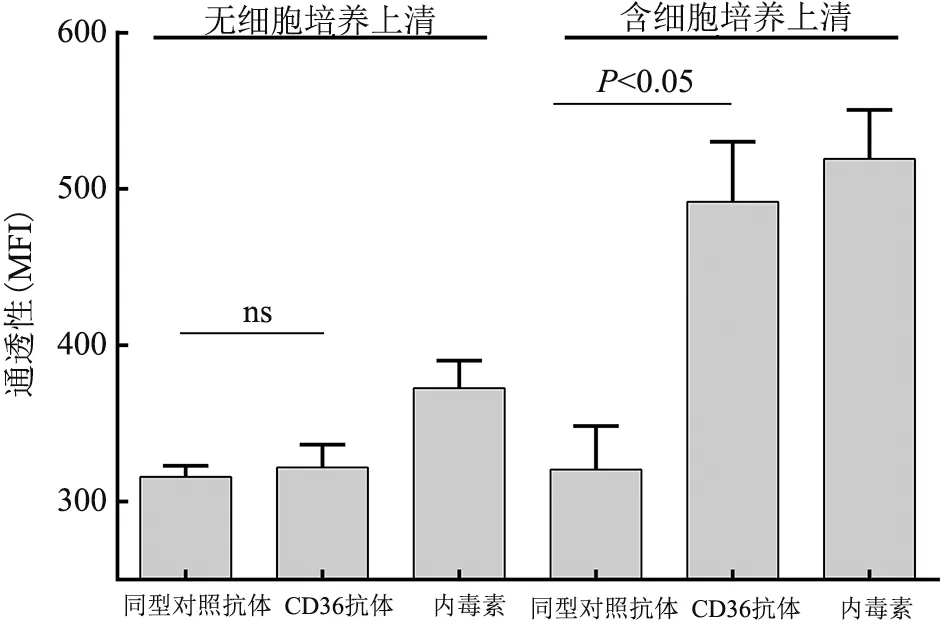
图5 HUVEC 通透性检测图
3 讨论
FNAIT 是1 种危及胎儿生命的妊娠疾病,可导致胎儿或新生儿出血并发症,包括致死性的颅内出血并发症[12]。 据统计,高加索白种人中,约80%的FNAIT 是由抗人血小板抗原1a (HPA-1a)抗体引起的[3]。 而中国人群,由于血小板HPA-1b 表达频率低,所以HPA-1a 抗体引起的FNAIT 较少发生[13]。 根据本研究组前期研究,我国CD36 缺失表达者约2%,其中Ⅰ型缺失高达0.5%[7]。 在不同的省份,CD36 缺失的频率为0.81%到1.99%;在不同的民族中,CD36 缺失的频率也有很大的差异,其中壮族缺失频率最高,为3.69%[14]。近年来,我国陆续发现并报道了多例由CD36 抗体引起FNAIT 的病例[6-8],本研究组协助临床对1 例CD36 抗体引起FNAIT 的孕妇进行宫内输注CD36 阴性的血小板和红细胞,纠正了胎儿贫血和血小板减少症,取得良好的临床疗效[9]。CD36 抗体引起的FNAIT 逐渐成为我国新生儿发病率和死亡率的主要威胁因素之一。 与抗HPA-1a 导致的FNAIT 不同,CD36 抗体介导的FNAIT 更常见的症状是胎儿水肿和反复流产[10]。 我们在前期研究中发现,CD36 抗体可以通过增加CD34+红细胞/骨髓前体细胞的凋亡,进而导致CFU-E/BFUE 细胞形成显着减少,从而影响成熟红细胞的生成导致胎儿贫血和水肿,通过宫内输注洗涤后的红细胞可以改善胎儿的贫血症状[8]。 血管内皮细胞对液体,细胞等从血液进入组织的通道的调节起至关重要的作用。 血管完整性被破坏与各种炎症性疾病的发病机制相关。 大量研究证实,细胞因子可以增加内皮细胞的通透性,介导血管损伤和血管功能障碍[15],研究也证实血管内皮细胞功能障碍也是导致水肿的重要因素[16]。 目前,CD36 抗体能否导致胎儿的血管内皮细胞出现功能影响目前尚未见报道。
研究表明在抗HLA-Ⅱ抗体活化的PBMC 细胞上清中,检测出大量的细胞因子,并且这些富细胞因子的细胞上清可以显著地增加内皮细胞的通透性;而细胞因子中TNF-α 和IL-1β 对内皮细胞通透性的影响是最主要的[17]。 因此我们推测母源性的CD36 抗体可能通过激活单核细胞产生大量细胞因子对血管内皮细胞产生影响。 为了验证这一假设,我们使用体外模型评估了CD36 单克隆抗体对脐静脉内皮细胞通透性的影响。 首先,通过CD36 单克隆抗体与PBMC 共同孵育,我们发现CD36 单克隆抗体孵育后的PBMC 会产生大量的细胞因子TNF-α(407.73±20.40) pg/mL 和IL-1β(247.14±83.59)pg/mL,进一步证实了CD36 单克隆抗体可以激活单核细胞。 其次,将HUVEC 单层细胞层与CD36 抗体刺激后的PBMC 细胞上清孵育,通过检测FITC-albumin 荧光强度发现HUVEC 的通透性增加;而HUVEC 与CD36 抗体单独孵育时,通透性未增加,说明单独的CD36 抗体并不能引起内皮细胞通透性的改变。 在这项研究中,我们证实CD36 单克隆抗体与PBMC 共培养时,会产生大量的细胞因子TNF-α 和IL-1β 等,这些细胞因子可以增加脐静脉内皮细胞的通透性而导致内皮细胞功能障碍,这可能是导致胎儿水肿的另1 个重要因素。
本研究通过CD36 抗体与PBMC 的作用,研究CD36 抗体活化单核细胞对脐静脉内皮细胞通透性的影响,提示了CD36 抗体可以通过激活单核细胞产生细胞因子增加血管内皮细胞的通透性,导致血管内皮细胞功能障碍,这可能是CD36 抗体导致胎儿水肿出现的机制之一,对于深入研究CD36 抗体引起FNAIT 的发病机制和临床治疗和预防,有重要的指导意义。
利益冲突:所有作者均声明不存在利益冲突。
