重度阻塞性睡眠呼吸暂停患者脑静息态镜像同伦连接的分析
2023-11-29沈过张慧姸高静吴丹黄刚张文文赵莲萍
沈过,张慧姸,高静,吴丹,黄刚,张文文,赵莲萍*
0 前言
阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)是患者睡眠过程中出现上呼吸道狭窄或呼吸肌无力而引起的睡眠性疾病,其特征是睡眠期间完全或部分上气道塌陷导致气流减少或反复停止,从而导致间歇性缺氧、高碳酸血症和睡眠片段化[1]。成人OSA的患病率为9%~38%,且男性多于女性[2]。有研究发现重度OSA 患者合并症(如肥胖、高血压、冠心病、充血性心力衰竭、糖尿病及卒中等)的发生率较非重度OSA 明显增加[3-4]。长期OSA 可能会导致患者大脑结构或功能受损,但其神经病理生理机制尚不明确[5]。研究发现,在轻度认知障碍患者中,约有45%的人在5 年内会发展为阿尔茨海默病[6],而OSA 可能是导致轻度认知障碍、痴呆和阿尔茨海默病的可改变危险因素[7-8],因此,对OSA 患者的认知障碍的早期诊断和及时干预治疗具有重要的临床意义。
既往研究应用静息态功能MRI(resting-state functional MRI, rs-fMRI)分析了OSA患者的脑局部一致性[9-10]、低频振幅[11-12]、度中心性[13-14]及基于种子点的功能连接(functional connectivity, FC)[15-16]等指标改变,从不同的角度阐述了其静息态脑功能变化,然而鲜有学者报道OSA 患者双侧大脑半球功能协同性的变化。基于体素镜像同伦连接(voxel-mirrored homotopic connectivity, VMHC)是rs-fMRI的重要指标之一,可反映一侧大脑半球中的每个体素与对侧大脑半球中镜像体素之间的同位连接的变化,通过分析大脑半球间神经元的同步活动性反映大脑半球间的信息整合功能[17-18]。迄今为止,关于OSA 患者大脑半球间功能协同性变化仍不清楚。
本研究拟采用rs-fMRI 的VMHC 分析结合基于种子点的FC,探讨重度OSA 患者大脑半球间功能协同性,尝试从新的角度分析并进一步阐明重度OSA患者认知功能损伤的神经病理生理机制,为其早期诊断提供客观神经影像标记。
1 材料与方法
1.1 研究对象
前瞻性分析2017 年10 月至2022 年12 月于甘肃省人民医院睡眠中心首诊未治疗的重度男性OSA患者资料62例,广告招募性别、年龄和受教育程度相匹配的健康对照53例。OSA组纳入标准:(1)汉族;(2)18~70 岁;(3)右利手;(4)受教育年限≥6 年;(5)符合2017年版《美国睡眠医学会睡眠及其相关事件判读手册规则、术语和技术规范2.3版》重度OSA的诊断标准,呼吸暂停低通气指数(apnea hypopnea index, AHI)>30 次/h。HC 组纳入标准:(1)汉族;(2)18~70 岁;(3)右利手;(4)受教育年限≥6 年。两组共同排除标准:(1)合并其他睡眠障碍;(2)心脏病、精神疾病史;(3)左利手及双利手;(4)脑外伤史;(5)酗酒、滥用毒品及精神类药物史;(6)常规MRI 扫描存在头颅器质性病变;(7)有MRI扫描禁忌证。
本研究遵守《赫尔辛基宣言》,经甘肃省人民医院伦理委员会批准,批准文号:2017-319,全体受试者均签署了知情同意书。
1.2 临床资料采集及神经心理量表评估
收集所有受试者的年龄、性别、受教育程度及体质量指数(body mass index, BMI);对所有受试者行神经心理量表评估,包括:失眠严重程度指数、Epworth 嗜睡程度评价表、匹茨堡睡眠指数量表、2004 年版蒙特利尔认知评估量表、汉密尔顿焦虑量表及汉密尔顿抑郁量表。所有量表评估均由经过专门培训的具有2 年以上工作经验的住院医师在主任医师指导下于MRI扫描前3 h内完成。
1.3 多导睡眠监测
OSA 组患者均在头颅MRI 采集前3 天内进行多导睡眠监测(澳大利亚compumed-greal 多导睡眠监测仪),监测前24 h 内禁止摄入任何影响睡眠的饮品(茶、咖啡及酒精等),总监测时间≥8 h,根据受试者的睡眠习惯确定监测开始时间。所有数据由经过专门培训的具有5 年以上工作经验的主治医师进行解读。
1.4 头颅MRI数据采集及数据处理
1.4.1 头颅MRI数据采集
所有受试者头颅MRI数据采集均使用3.0 T超导MR 扫描仪(MAGNETOM Skyra, Siemens Healthcare,Erlangen, Germany),配备32 通道相控阵表面头线圈。嘱受试者平卧,保持清醒,尽可能避免做专注思维活动,使用海绵垫固定头部。所有受试者头颅MRI数据采集由经过专业培训的具有2年以上工作经验的放射科住院医师完成。结构像扫描采用三维磁化准备梯度回波(three-dimensional magnetization-prepared rapid gradient echo, 3D-MPRAGE)序列矢状位扫描,重复时间2530 ms,回波时间2.35 ms,翻转时间1100 ms,翻转角7°,视野256 mm×256 mm,矩阵256×256,层厚1.33 mm,层间距0.665 mm,层数192,激励次数1,扫描时间5 min 23 s。rs-fMRI 扫描采用血氧水平依赖梯度回波-平面回波成像序列(blood oxygenation level-dependent gradient recalled echo-echo planar imaging, BOLD GRE-EPI)轴位扫描,重复时间2000 ms,回波时间30 ms,翻转角90°,视野224 mm×224 mm,矩阵64×64,层厚3.5 mm,层间距0.7 mm,层数33,激励次数1,每次采集420个时间点,扫描时间14 min 8 s。
1.4.2 头颅MRI数据预处理
使用基于MATLAB 平台的DPABI_V6.2(http://restfmri.net/forum/dpabi)和SPM12(http://www.fil.ion.ucl.ac.uk/spm)软件对静息态脑影像数据进行预处理。主要步骤包括:(1)DICOM 数据格式转换;(2)剔除前10个时间点;(3)层时间校正;(4)头动校正(剔除头动平移>2 mm,旋转>2°的受试者);(5)空间标准化(重采样3 mm×3 mm× 3 mm);(6)高斯平滑(半高全宽6 mm);(7)去线性漂移和低通滤波(0.01-0.10 Hz);(8)回归去除协变量(脑白质、脑灰质、脑脊液及Friston-24参数)。
1.4.3 VMHC指标计算
提取预处理后配准到标准MNI 模板的一侧大脑半球每个体素的时间序列,并计算该时间序列与对侧大脑半球镜像体素之间时间序列的Pearson 相关系数(r),通过Fisher'sr-to-Z变换得到Z值以改善数据的正态性用于后续统计分析。
1.4.4 基于种子点的FC分析
使用DPABI 软件,基于VMHC 分析结果,选择差异脑区为种子点,提取其峰值点MNI坐标,以6 mm为半径做球形种子点为感兴趣区。计算感兴趣区内各个体素的平均时间序列,然后与全脑各个体素的时间序列进行Pearson相关分析,得到每个受试者感兴趣区与全脑各个体素之间的FC 图,最后经过Fisher'sr-to-Z转换改善数据的正态性用于后续的统计分析。
1.5 统计学分析
使用IBM SPSS 26.0软件进行统计分析,符合正态分布的计量资料以±s表示,组间比较用两独立样本t检验,不符合正态分布的计量资料以M(Q)表示,组间比较用Mann-WhitneyU检验,以P<0.05 为差异有统计学意义。使用DPABI 软件的统计模块对两组的VMHC和基于种子点的FC进行两独立样本t检验,将年龄、性别、受教育程度及头动参数作为协变量,进行高斯随机场多重比较校正(体素水平P<0.001,簇水平P<0.05)。提取组间差异脑区的VMHC值和FC 值与临床变量及神经心理量表评分进行Pearson相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 临床资料与神经心理量表评分
预处理过程中OSA 组因头动超标剔除12 例,健康对照组因头动超标剔除2 例,图像不全剔除1 例,最终纳入OSA 组和健康对照组各50 例受试者。两组受试者的年龄、受教育年限差异无统计学意义(P>0.05)。两组BMI、蒙特利尔认知评估量表、汉密尔顿抑郁及焦虑量表、失眠严重程度指数量表、Epworth嗜睡程度指数量表及匹茨堡睡眠指数量表评分差异有统计学意义(P<0.05),见表1。OSA 组病程为(8.69±6.28)年,AHI为(57.27±18.49)次/h,平均血氧饱和度(oxygen saturation of blood, SaO2)为(90.05±3.80)%,最低SaO2为(65.70±15.44)%,快速眼动睡眠阶段占总睡眠时间的百分比(12.40±9.28)%,N1占总睡眠时间百分比(23.12±15.94)%,N2占总睡眠时间百分比(44.28±17.94)%。

表1 OSA组和对照组临床资料及神经心理量表的比较Tab.1 Comparison of clinical data between OSA group and control group
2.2 VMHC和基于种子点的FC分析组间差异
与对照组相比,OSA 组双侧距状回及双侧顶上回VMHC 值降低(t=-4.8113,P<0.05;t=-4.6344,P<0.05)。FC 分析显示,OSA 组右侧距状回与对侧距状回的FC 值减低(t=-5.7940,P<0.05);左侧距状回与双侧舌回的FC 值减低(t=-5.5117,P<0.05;t=-4.7268,P<0.05);右侧顶上回与左侧颞中回的FC值增高(t=4.6690,P<0.05),与左侧顶上回的FC 值减低(t=-5.3718,P<0.05);左侧顶上回与右侧枕中回(t=-5.5077,P<0.05)、左 侧 顶 下 缘 角 回(t=-5.2640,P<0.05)及双侧顶上回的FC 值减低(t=-4.0282,P<0.05;t=-4.7906,P<0.05),具体结果见表2~3、图1~3。

图1 OSA 组与健康对照组VMHC 组间比较的结果。1A:OSA 组双侧距状回VMHC 值显著低于对照组;1B:OSA 组双侧顶上回VMHC 值显著低于对照组(冷色,高斯随机场多重比较校正,体素水平P<0.001,簇水平P<0.05)。OSA:阻塞性睡眠呼吸暂停;VMHC:基于体素的镜像同伦连接。Fig.1 Results of intergroup comparison between OSA and healthy control groups based on the voxel-mirrored homotopic connectivity.1A:The VMHC value of bilateral calcarine in OSA group are significantly lower than those in healthy control group; 1B: The VMHC value of bilateral superior parietal gyrus in OSA group are significantly lower than those in healthy control group (cool colors, Gaussian random field multiple comparison correction, voxel level P<0.001, cluster level P<0.05).OSA: obstructive sleep apnea; VMHC: voxel-mirrored homotopic connectivity.
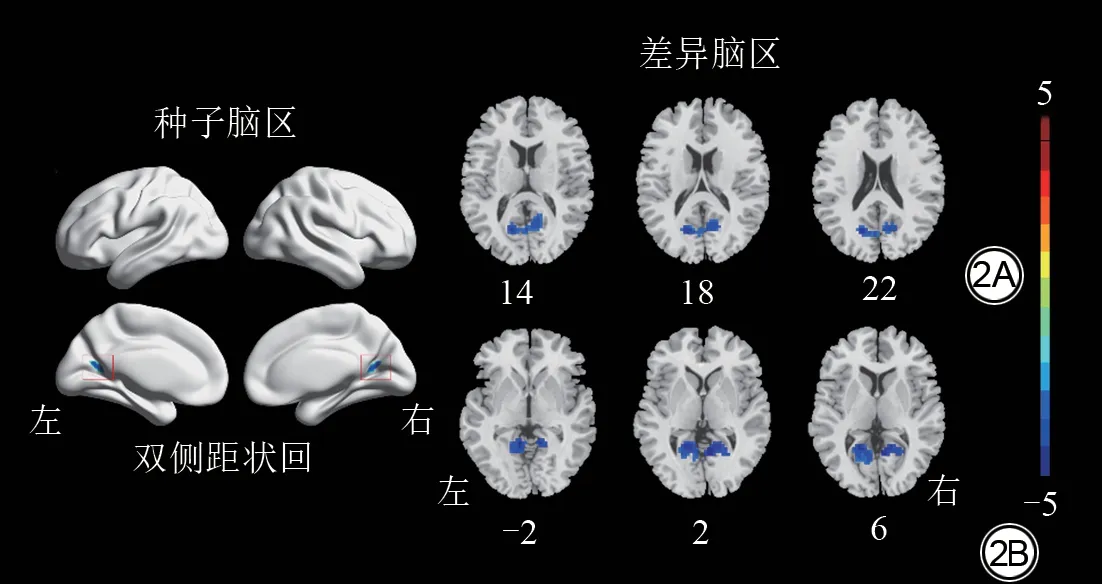
图2 以双侧距状回为种子点的功能连接的组间比较结果。2A:OSA组右侧距状回与左侧距状回的FC减低(冷色);2B:OSA组左侧距状回与双侧舌回的FC减低(冷色)(高斯随机场多重比较校正,体素水平P<0.001,簇水平P<0.05)。OSA:阻塞性睡眠呼吸暂停;FC:功能连接。Fig.2 Intergroup comparison results of functional connectivity with bilateral calcarine as seed point.2A: The FC of right bilateral calcarine and left bilateral calcarine is decreased in OSA group (cool colors).2B:The FC of left bilateral calcarine and bilateral lingual gyrus is reduced in OSA group (cool colors) (Gaussian random field multiple comparison correction, voxel level P<0.001, cluster level P<0.05).OSA: obstructive sleep apnea; FC: functional connectivity.

图3 以双侧顶上回为种子点的功能连接的组间比较结果。3A:OSA组右侧顶上回与左侧颞中回的FC 增加(暖色);3B:OSA 组右侧顶上回与左侧顶上回的FC 减低(冷色);3C:OSA 组左侧顶上回与右侧枕中回间的FC 减低(冷色);3D:OSA 组左侧顶上回与左侧顶上回及顶下缘角回间的FC减低(冷色);3E:OSA组左侧顶上回与右侧顶上回间的FC减低(冷色)高斯随机场多重比较校正,体素水平P<0.001,簇水平P<0.05。OSA:阻塞性睡眠呼吸暂停;FC:功能连接。Fig.3 Intergroup comparison results of functional connectivity with bilateral superior parietal gyrus as seed point.3A: The FC of right superior parietal gyrus and left medial temporal gyrus is increased in OSA group(warm colors); 3B: The FC of right superior parietal gyrus and the left superior parietal gyrus is decreased in OSA group (cool colors); 3C: The FC of left superior parietal gyrus and right middle occipital gyrus is decreased in OSA group (cool colors); 3D: The FC of left superior parietal gyrus and left superior parietal gyrus and inferior parietal marginal angular gyrus is decreased in OSA group (cool colors); 3E: The FC of left superior parietal gyrus and right superior parietal gyrus was decreased in OSA group (cool colors).Gaussian random field multiple comparison correction, voxel level P<0.001, cluster level P<0.05.OSA: obstructive sleep apnea; FC: functional connectivity.
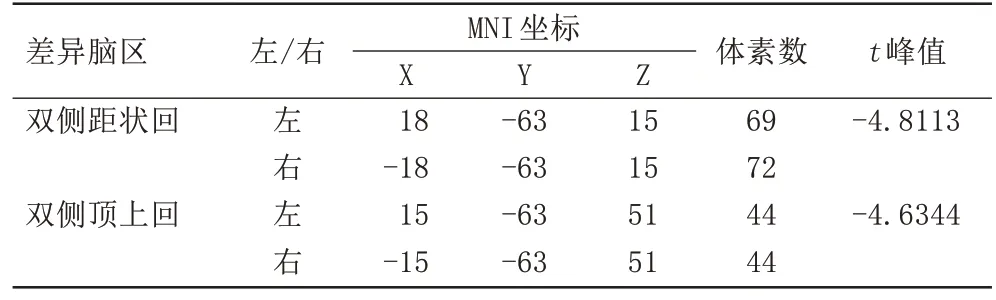
表2 OSA组和健康对照组VMHC的组间差异脑区Tab.2 Brain regions with group differences in VMHC between OSA and healthy controls
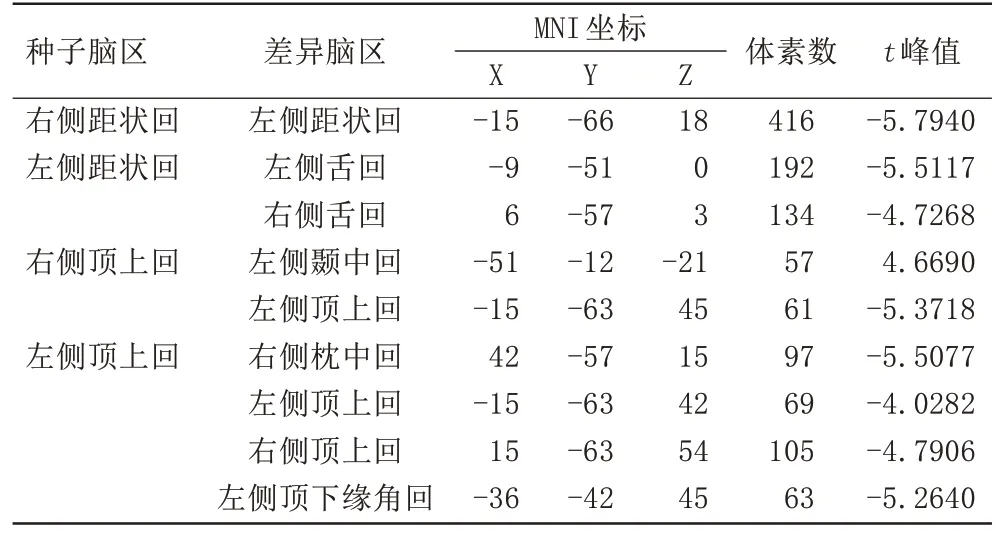
表3 OSA组和健康对照组基于VMHC差异脑区的种子点FC分析结果Tab.3 Results of seed-based FC analysis of VMHC difference brain region between OSA group and healthy controls
2.3 Pearson相关分析
重度OSA 组双侧距状回的VMHC 值与AHI 呈负相关(r=-0.31,P=0.027),与平均SaO2呈正相关(r=0.30,P=0.033);双 侧 顶 上 回VMHC 值 与BMI(r=-0.46,P<0.001)呈负相关,与平均SaO2(r=0.29,P=0.039)及最低SaO2(r=0.31,P=0.028)呈正相关。右侧顶上回与左侧颞中回的FC 值与BMI(r=0.32,P=0.023)呈正相关;左侧顶上回与左侧顶上回的FC 值与AHI(r=-0.29,P=0.043)呈负相关;左侧顶上回与右侧顶上回的FC 值与BMI(r=-0.36,P=0.011)呈负相关,与平均SaO2(r=0.29,P=0.044)呈正相关;左侧顶上回与左侧顶下缘角回间FC 值与平均SaO2(r=0.29,P=0.041)呈正相关,见图4。

图4 重度OSA患者功能异常脑区与临床变量及神经认知量表的相关性。4A:重度OSA患者VMHC异常的脑区;4B:双侧距状回的VMHC与呼吸暂停低通气指数;4C:双侧距状回的VMHC与平均血氧饱和度;4D:双侧顶上回的VMHC与体质量指数;4E:双侧顶上回的VMHC与平均血氧饱和度;4F:双侧顶上回的VMHC 与最低血氧饱和度;4G:OSA 组基于种子点FC 具有相关结果的脑区;4H:右侧顶上回与左侧颞中回的FC 与体质量指数;4I:左侧顶上回与左侧顶上回的FC 与呼吸暂停低通气指数;4J:左侧顶上回与右侧顶上回的FC 与体质量指数;4K:左侧顶上回与右侧顶上回的FC 与平均血氧饱和度;4L:左侧顶上回与左侧顶下缘角回的FC与平均血氧饱和度。OSA:阻塞性睡眠呼吸暂停;VMHC:基于体素的镜像同伦连接;FC:功能连接。Fig.4 Correlation of functional abnormal brain areas with clinical variables and neurocognitive scales in patients with severe OSA.4A: Brain regions with abnormal VMHC in severe OSA patients; 4B: The VMHC of bilateral calcarine and apnea hypopnea index; 4C: The VMHC of bilateral calcarine VMHC and mean blood oxygen saturation; 4D: The VMHC of bilateral superior parietal gyrus and body mass index; 4E: The VMHC of bilateral superior parietal gyrus and mean blood oxygen saturation; 4F: The VMHC of bilateral superior parietal gyrus and minimum blood oxygen saturation; 4G: Brain regions in OSA group with associated results based on seed point FC; 4H: The FC of right superior parietal gyrus and left middle temporal gyrus and body mass index; 4I: The FC of left and left superior parietal gyrus and apnea hypopnea index; 4J: The FC of left and right superior parietal gyrus and body mass index; 4K: The FC of left and right superior parietal gyrus and mean blood oxygen saturation; 4L: The FC of left superior parietal gyrus and left inferior parietal angular gyrus and mean blood oxygen saturation.OSA:obstructive sleep apnea; VMHC: voxel-mirrored homotopic connectivity; FC: functional connectivity.
3 讨论
本研究首次以重度OSA 患者为研究对象,采用VMHC和基于种子点的FC分析其静息态脑功能异常及其与认知情绪评分间的相关关系,发现重度OSA患者存在认知功能减退、潜在抑郁及焦虑风险。同时还发现重度OSA 患者双侧距状回和顶上回VMHC 值减低,及其与双侧舌回、左侧颞中回、右侧枕中回及左侧顶下缘角回间的FC 存在差异。此外,重度OSA 患者双侧距状VMHC 值与平均SaO2呈正相关,与AHI 呈负相关;双侧顶上回VMHC值与平均SaO2呈正相关,与BMI 呈负相关;左侧顶上回与左侧角回的FC 值与平SaO2呈正相关;左侧顶上回与右侧顶上回间的FC 值与BMI 呈负相关;右侧顶上回与左侧颞中回的FC 值与BMI 呈正相关。本研究是对既往重度OSA 患者认知功能损伤研究的重要补充。
3.1 重度OSA患者脑损害的神经病理生理机制
本研究中重度OSA患者的认知评分减低、抑郁和焦虑评分增高,提示重度OSA患者存在认知功能减退及潜在抑郁和焦虑的风险。既往研究表明,约27%的OSA患者合并轻度认知功能受损[19]。睡眠连续性、慢波睡眠、快速眼动睡眠和睡眠纺锤波在神经发生、突触的形成、记忆的形成和巩固中具有重要作用[20],因此长期的OSA导致反复间歇性缺氧及睡眠结构的改变可能逐渐导致大脑神经退行性过程,从而导致认知功能减退。最近一项荟萃分析显示,约有35%和32%的OSA患者伴有抑郁和焦虑症状[21],这可能与白日嗜睡程度、睡眠质量、间歇性缺氧及海马结构损伤等因素相关[22-23]。间歇性低氧血症是引起OSA患者认知功能损伤的潜在因素[24-25],这可能与其促进氧化应激反应有关,如活性氧和血管生成的增加、交感神经的激活以及全身和血管炎症的发作[26-27]。此外,睡眠片段化和慢波睡眠减少使OSA 患者脑内的β-淀粉样蛋白和tau 蛋白异常沉积,进一步加重OSA患者认知功能损伤[28-29]。
3.2 OSA 患者VMHC 和基于种子点FC 异常的脑区及其作用
距状回和舌回是视觉网络的重要组成部分,主要处理视觉相关的信息[30-31]。本研究发现重度OSA患者双侧距状回VMHC 减低,提示该脑区半球间信息交流和整合功能障碍。另外,本研究还发现双侧距状回间的FC减低,左侧距状回与双侧舌回间的FC减低,提示重度OSA 患者视觉网络可能存在损伤。也有学者应用rs-fMRI技术结合机器学习的方法研究OSA患者的脑功能变化,发现OSA患者的距状回与其他脑区的FC 减低[32-33],与本研究结果一致。YANG 等[31]发现OSA患者在视觉任务中反应时间明显长于对照组,提示OSA 患者存在视觉信息处理功能受损。HUANG 等[34]发现,阿尔茨海默病患者中的任务状态和静息状态MRI研究表明,视觉网络完整性的改变与认知障碍相关。既往研究显示,成人OSA患者舌回局部一致性和低频振幅减低[32,35],支持本研究结果。此外,本研究发现重度OSA患者双侧距状回VMHC值与AHI呈负相关,与平均SaO2呈正相关,提示缺氧和睡眠片段化是重度OSA患者双侧距状回功能受损的重要病理生理机制。
顶上回与感觉信息的处理有关,是触觉和实体觉的重要脑区;角回在语言理解、空间注意力及数量感知中起重要作用,是认知功能的重要枢纽[36];颞中回对听觉信息的处理和记忆保存具有关键作用,也参与了语言理解和表达,是人脑中功能多样的脑区之一。本研究发现重度OSA 患者双侧顶上回的VMHC值及双侧顶上回间的FC 减低,提示双侧顶上回间信息交流及功能协同性受损。另外,还发现右侧顶上回与左侧颞中回间的FC 增加、左侧顶上回与角回的FC 减低。既往rs-fMRI 研究发现,成人OSA 患者顶上回局部一致性及角回低频振幅减低[37-38],颞中回的低频振幅值在slow-5 亚频段明显升高[39],均支持本结果。结构MRI 研究发现OSA 患者顶上回皮质变薄[40],这可能是其静息态脑功能改变的重要结构基础。因此,重度OSA 引起的双侧顶上回及其FC 的变化可能与认知功能受损有关。此外,本研究还发现重度OSA患者左侧顶上回与右侧枕中回FC减低。枕中回是枕叶中间的部分,在视觉信息的处理中发挥重要作用。研究发现OSA患者枕中回的度中心性显著降低,且与AHI 呈负相关,这可能是反复发作缺氧的结果[41]。另外,本研究中重度OSA 患者双侧顶上回VMHC 值与平均SaO2和最低SaO2呈正相关,左侧顶上回与角回的FC值与平均SaO2呈正相关,这可能与重度OSA患者长期缺氧所导致的睡眠结构紊乱有关。本研究还发现双侧顶上回的VMHC 值和FC 值与BMI 呈负相关,右侧顶上回与左侧颞中回的FC 值与BMI 呈正相关,提示肥胖是重度OSA患者脑功能受损的重要危险因素。
3.3 不足与展望
本研究的主要创新点是通过将rs-fMRI中的VMHC及基于种子点的FC分析方法结合研究重度OSA患者的脑功能损伤,并进一步探索了异常脑区与临床变量及神经心理量表的相关关系。然而,本研究尚存在以下不足:第一,本研究为了排除性别差异的影响,只纳入了男性重度OSA患者,结果可能不适用于推广应用到女性患者;第二,因为本研究样本量相对较小,无法对OSA 患者进行亚组分析研究,研究结果可能无法应用到轻中度OSA患者,后续研究需要进一步扩大样本量来研究不同程度OSA患者脑功能损伤;第三,本研究属于横断面研究,只初步探索了重度OSA患者的脑功能改变,未来研究应考虑纵向研究设计,探索OSA患者治疗前后脑功能的变化;最后,本研究仅分析了OSA患者的静息态脑功能变化,潜在形态学和微观结构改变尚不清楚,未来研究可联合结构和功能影像学技术进一步系统研究OSA患者脑损伤的神经病理机制。
4 结论
总之,本研究发现重度OSA患者存在认知功能受损及潜在抑郁和焦虑风险,其双侧距状回和顶上回半球间功能协同性及FC 受损可能是重度OSA 患者脑损害的重要神经病理机制,为OSA患者脑影像的研究提供了不同的见解。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:赵莲萍设计本研究方案,对稿件重要内容进行了修改;沈过起草和撰写稿件,获取、分析和解释本研究数据;张慧姸分析数据、统计分析,对稿件内容进行修改;高静采集数据,对稿件内容进行修改;吴丹:采集、整理数据,对稿件内容进行修改;黄刚获取、解释数据,对稿件内容进行修改;张文文分析数据,对稿件内容进行修改;赵莲萍获得了国家自然科学基金项目、甘肃省自然科学基金项目资金资助。全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。
