基于临床表现及MRI特征的诺莫图早期预测急性胰腺炎胰周积聚的转归
2023-11-29罗江刘婷婷张学英蒋东林张小明
罗江,刘婷婷,张学英,蒋东林,张小明
0 前言
急性胰腺炎(acute pancreatitis, AP)是一种突然发生的胰腺急性炎症[1]。由于其不同的严重程度和各种并发症,具有潜在的致命风险[2]。胰周积聚(peripancreatic collections, PPCs)是AP 的主要局部并发症之一,其发病率较高[3]。PPCs被定义为胰腺附近没有明确的肉芽组织或纤维组织壁的可能含有坏死碎屑的同质/异质液体集合[4]。PPCs与AP严重程度及病程密切相关[5]。2012年修订的《亚特兰大分类标准》重新明确了AP的类型和并发症,其中包括PPCs的四种主要类型:胰腺假性囊肿(pancreatic pseudocyst,PPCyst)、包裹性坏死(walled-off necrosis, WON)、急性胰周积聚(acute peripancreatic fluid collection,APFC)、急性坏死性积聚(acute necrotic collection,ANC)[6-7]。PPCs 的形成通常是多种因素共同作用的结果,包括炎性渗出液、液化性坏死和胰管损伤[8]。此外,研究还发现PPCs本身含有较多的毒性物质,如淀粉酶、脂肪酶、磷脂酶和白介素等介质和细胞因子等,这些物质都可能加重AP的严重程度,是独立的危险因素[9-10]。对PPCs 的诊断可以在AP 发病期间或数月后进行,它们在大小、数量和一致性上存在差异,可以局限在多个部位,如肠系膜根部、胃脾韧带、胰腺周围间隙、横结肠系膜、肝十二指肠或胃肝韧带、右前或后肾旁间隙、左前或后肾旁间隙等[11]。有研究表明,基于胰周区域增强CT 图像的影像组学模型在早期预测AP 严重程度方面表现良好[12]。通过研究胰周区域和PPCs,可以获得其相关的潜在信息,用于提示患者的严重程度、病程和预后,从而有助于改善临床治疗和管理,最终改善患者的预后。
对于AP 的形态学改变和不同类型的PPCs 的鉴别,主要依赖于影像学检查[13-14]。尽管CT 广泛用于AP 患者的诊断,但超声(ultrasound, US)和MRI 在诊断PPCs的异质性和可视化非液化坏死物质的存在方面更具优势[15]。然而,MRI 检查通常需要较长的时间,成本较高,不适用于AP急性发作时检测。但T2WI压脂序列对于胰腺周围非液体和液体成分的敏感性较高,同时T1WI 还有助于出血的诊断。此外,MRI 对于早期胰周坏死的鉴别更有优势,而且对患者没有电离辐射,可用于复查随访[16-17]。总之,MRI 在评估PPCs 方面具有潜在的重要价值,但目前研究主要集中在PPCs 与AP 严重程度、临床治疗和管理之间的关系,尚缺乏关于AP PPCs 患者的临床表现及MRI 特征与转归之间关系的系统性研究。因此,本研究旨在探讨AP PPCs 的预后因素,基于临床表现及MRI 影像学特征建立诺莫图模型,以早期预测AP PPCs转归。
1 材料与方法
1.1 研究对象
本研究遵守《赫尔辛基宣言》,经川北医学院附属医院伦理委员会批准,免除受试者知情同意,批准文号:2023ER242-1。本研究回顾性分析了从2016年1 月1 日至2023 年2 月28 日期间我院收治的AP 住院患者。根据2012年修订的《亚特兰大分类法》标准[6],AP 诊断至少符合以下三个标准中的任意两个:(1)持续性腹痛;(2)血清淀粉酶(或脂肪酶)高于正常水平的3 倍;(3)AP 的典型MRI/CT 影像学表现。纳入标准:(1)首次诊断为AP 并有PPCs 的住院患者;(2)入院1 周内治疗前接受MRI 平扫+增强检查(每例患者同时包含平扫和增强检查);(3)入院后3周内进行临床和影像(MRI、CT、超声三者任何一个随访都可,但是至少有一项)随访、复查的患者。排除标准:(1)患者有PPCs,但是合并肿瘤、慢性疾病(肝硬化、心衰、肾衰、慢性胰腺炎等);(2)小于18岁及孕妇患者。病例纳排流程见图1。

图1 患者选择流程图。Fig.1 Flowchart of patient selection.
1.2 临床观察
临床、生化和影像学诊断参数与AP的临床病程有关,可以预测其严重程度[18]。临床和实验室观察指标包括:年龄、性别、病因、住院时间、有无并发症[全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)、多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS),或者两者同时存在],首次MRI检查前3 d内血钙离子总数、中性粒细胞数、白细胞数、超敏C 反应蛋白(hypersensitive C-reactive protein, hs-CRP)。临床上运用急性生理与慢性健康评分Ⅱ(Acute Physiology and Chronic Health Evaluation Ⅱ, APACHE Ⅱ)[19]以及AP 严重程度床边指数(Bedside Index for Severity in AP, BISAP)评分[20]来系统性评价AP 的严重程度。
临床随访资料包括:患者3周内病情是否减轻或者加重(查阅临床病例系统);是否经过手术干预治疗,患者5周后最终转归情况,患者生存/死亡情况。
1.3 预后判断
BALTHAZAR[21]的研究指出,腹部并发症主要发生在单发或复发性AP发作后的第2周至第5周之间,其发生频率在数月至数年后逐渐下降。此外,随访结果显示,13.7%的PPCs 患者病程超过两周[22]。因此,本研究根据入院治疗后3 周影像随访复查结果来划分患者的转归情况,分为两组:转归良好和转归不良。转归良好定义为PPCs 消失或明显减少,而转归不良定义为PPCs 未见明显减少或者加重。当PPCs无明显变化时将主要依据临床随访结果来确定患者的转归情况。这种方法将有助于对患者的临床转归进行分类和评估。
1.4 MRI检查
检查机型包括美国GE 公司3.0 T MRI(MR750,GE Medical Systems, Waukesha, Wis)和中国联影公 司3.0 T(uMR790, United Imaging, Shanghai)。MR750扫描参数:脂肪抑制快速恢复快速自旋回波T2加权成像(fast recovery fast spin-echo T2-weighted images, FS-FRFSE T2WI),TR 2500-3000 ms,TE 90-120 ms,矩阵384×384,FOV 34 cm×34 cm,层厚6 mm,层间距1 mm;磁共振胰胆管成像(magnetic resonance cholangiopancreatography, MRCP),TR 4000-5000 ms,TE 90-1000 ms,矩阵384×256,FOV 34 cm×34 cm;T1 加权脂肪抑制三维肝脏容积快速采集成像(three-dimensional liver acquisitions with volume acceleration flexible, 3D LAVA-flex)以及轴位3D LAVA-flex 对比增强MRI(contrast-enhanced MRI, DCE-MRI),TR 3.6-4.4 ms,TE 1.7-1.9 ms,矩阵224×192,FOV 36 cm×36 cm,层厚5.2 mm,层间距0 mm。uMR790 扫描参数:T2WI采用快速自旋回波序列,TR 2500-3000 ms,TE 90-120 ms,矩阵384×384,FOV 34 cm×34 cm,层厚5 mm,层间距1 mm;T1WI采用三维容积内插快速扰相梯度回波序列及增强,TR 3-4 ms,TE 1-2 ms,矩阵368×276,FOV 40 cm×30 cm,层厚3 mm,层间距0 mm;冠状面MRCP采用单次激发快速自旋回波序列,TR 5000-6000 ms,TE 700-800 ms,层厚60 mm,FOV 30 cm×30 cm,矩阵384×256。增强扫描:通过高压注射器将钆对比剂(马根维显,中国广州先灵公司)注入肘正中静脉,剂量为0.2 mmol/kg,流速为3.0 mL/s,并以相同速度注射生理盐水20 mL 冲洗,在注射对比剂后16 s(早期肝动脉期)、30 s(肝动脉期)、60 s(静脉期)和120 s(延迟期)进行动态增强扫描。
1.5 MRI观察
识别AP 及其并发症的影像学表现至关重要[23]。先前有文献报道AP 的严重程度与周围血管并发症[24]、积聚在腹膜下间隙的扩散程度[25]以及双侧腹壁受累情况[26]密切相关。在本研究中,MRI 观察指标包括:积聚最大层面的面积、胰周间隙积聚受累的数量、胰腺周围血管受累情况(有或无)、腹壁水肿情况(无、一侧、双侧)、积聚在腹膜下间隙扩散程度(Ⅰ级、Ⅱ级、Ⅲ级)等MRI 表现,以及AP 严重程度评估(MRSI评分、EPIM 评分)[27],评见表1。两名腹部放射科医师(医师1:年资3 年,初级职称;医师2:年资5 年,初级职称)在不知道患者预后的情况下负责评估患者的MRI 特征及评分,并用加权Kappa 检验分别验证MRSI、EPIM 评分的一致性,最后对于有分歧的观察指标通过讨论达成一致。

表1 MRSI及EPIM评分系统Tab.1 MRSI and EPIM scoring system
首先在横断位T2WI压脂序列上计数胰周间隙积聚受累的个数、观察腹壁水肿情况及积聚在腹膜下间隙的扩散程度分级;接着用3D Slicer软件(5.2.2,美国国家卫生院,http://www.slicer.org/)在T2WI 压脂序列图像上勾画积聚最大层面的范围,软件自动生成相应的面积;再从不同断面(冠状位、横断位)及序列(平扫及增强)观察胰周血管(动脉:肠系膜上动脉、脾动脉、肝总动脉及分支、腹腔干;静脉:门静脉、肠系膜上静脉、脾静脉)是否有下列胰源性门静脉高压、假性动脉瘤、炎症、静脉血栓等异常改变,并按结果分为有、没有两组。最后根据上述MRSI 和EPIM 评分标准,在T2WI 压脂序列上分别对每个患者进行评分。
1.6 统计学方法
统计学分析采用SPSS 27.0(Chicago, IL,USA)软件进行;连续性变量资料(住院时间、年龄、C反应蛋白、白细胞、中性粒细胞、钙离子总数、积聚最大层面面积、胰周间隙受累个数、EPIM 评分)用均值或中位数表示。根据资料分布类型,检验方法采用独立样本t检验和Mann-WhitneyU检验。等级变量或分类变量(病因、积聚类型、腹壁及胰周血管受累情况、积聚腹膜下扩散程度、MRSI 评分)均用卡方检验或Fishier's 确切检验进行比较。P<0.05 为差异具有统计学意义。
1.7 预测模型的建立与验证
使用R语言(4.2.3版本,http://cran.r-project.org)软件建立早期预测AP PPCs转归的诺莫图:第一步,每次针对一个变量的单变量分析被用来确定潜在的危险因素;第二步,对第一步重要变量进行逆向多因素二元logistic 回归分析,筛选PPCs 预后独立预测因子;第三步,通过R软件处理第二步结果,生成诺莫图。通过校准曲线及ROC 曲线下面积(area under the curve, AUC)来评估诺莫图的性能。最后用决策曲线评估模型的临床获益度。
2 结果
2.1 一般资料
本研究中最终纳入102 例AP 患者资料,男性占比58.90%(60/102),女性占比41.10% (42/102);年龄为46(38, 58)岁;住院时间15(10, 21)d,最常见的病因是胆源性(41.18%),其次是特发性(39.22%)、高脂血症型(18.63%),酒精源性反而最少(0.98%)。4 例(3.92%)患者出现MODS 或者SIRS,其中转归良好1 例[1/77 (1.30%)]、转归不良3 例[3/25 (12.00%)]。通过后期(3周)临床随访,25例(24.51%)患者接受了手术干预治疗,在转归良好和转归不良组分别占比18.18%(14/77)、44.00%(11/25);最终(5 周)随访结果显示,早期临床及影像随访转归良好组全部转归良好,而早期转归不良组中,有8 例(32.00%)最终转归良好,剩余17 例(68.00%)仍然转归不良;另,转归不良组中1例患者死亡。
2.2 临床观察结果
在102 例AP 中,转归良好有77 例,转归不良有25 例。转归良好与不良两组的基线资料比较详见表2。两组间的临床观察指标中,并发症(P=0.045)和BISAP 评分(P<0.001)差异具有统计学意义,其余指标包括年龄、性别、病因、住院时间、白细胞、C反应蛋白、中性粒细胞、钙离子数、APACHE Ⅱ评分等差异均无统计学意义(P>0.05)。
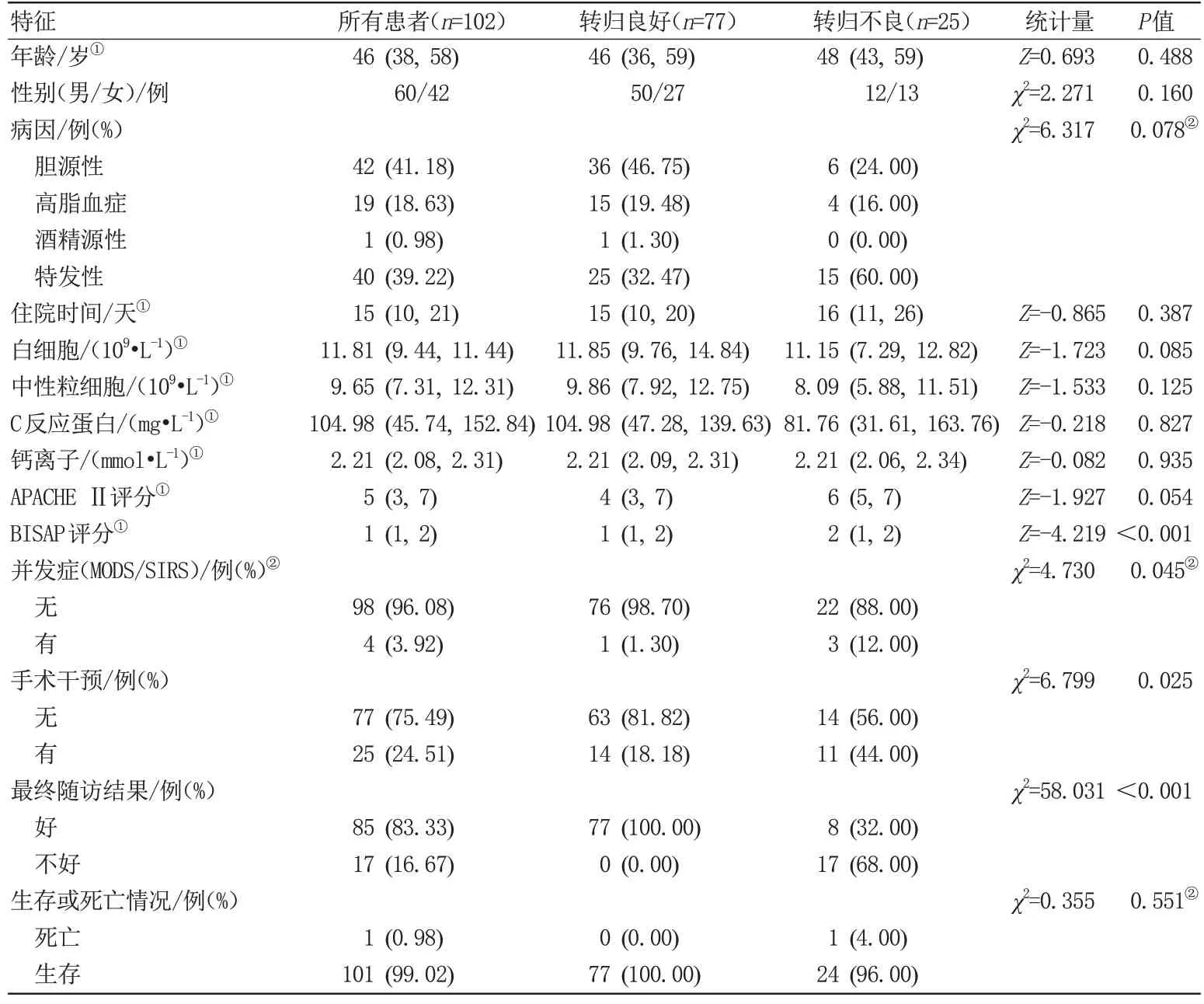
表2 临床指标的单因素分析Tab.2 Univariate analysis of clinical indicators
2.3 MRI观察结果
在MRI 上,转归不良组的胰周间隙受累个数、积聚最大层面面积、积聚分类、积聚腹膜下扩散程度、腹壁及胰周血管受累情况的比例均比转归良好组升高,且差异具有统计学意义(P<0.05)(表3);不同转归之间AP 严重程度评估显示,EPIM 评分(P=0.038)、MRSI 评分(P=0.009)提示不同转归PPCs 患者严重程度差异具有统计学意义(P<0.05)。对于MRSI 评分和EPIM 评分的加权Kappa 一致性检验结果显示,MRSI 评分Kappa 值为0.873(95%CI: 0.781-0.965),P<0.001;EPIM 评 分Kappa 值 为0.848(95%CI:0.760-0.936),P<0.001,说明MRSI 和EPIM 评分一致性良好。不同转归患者MRI影像表现见图2、图3。

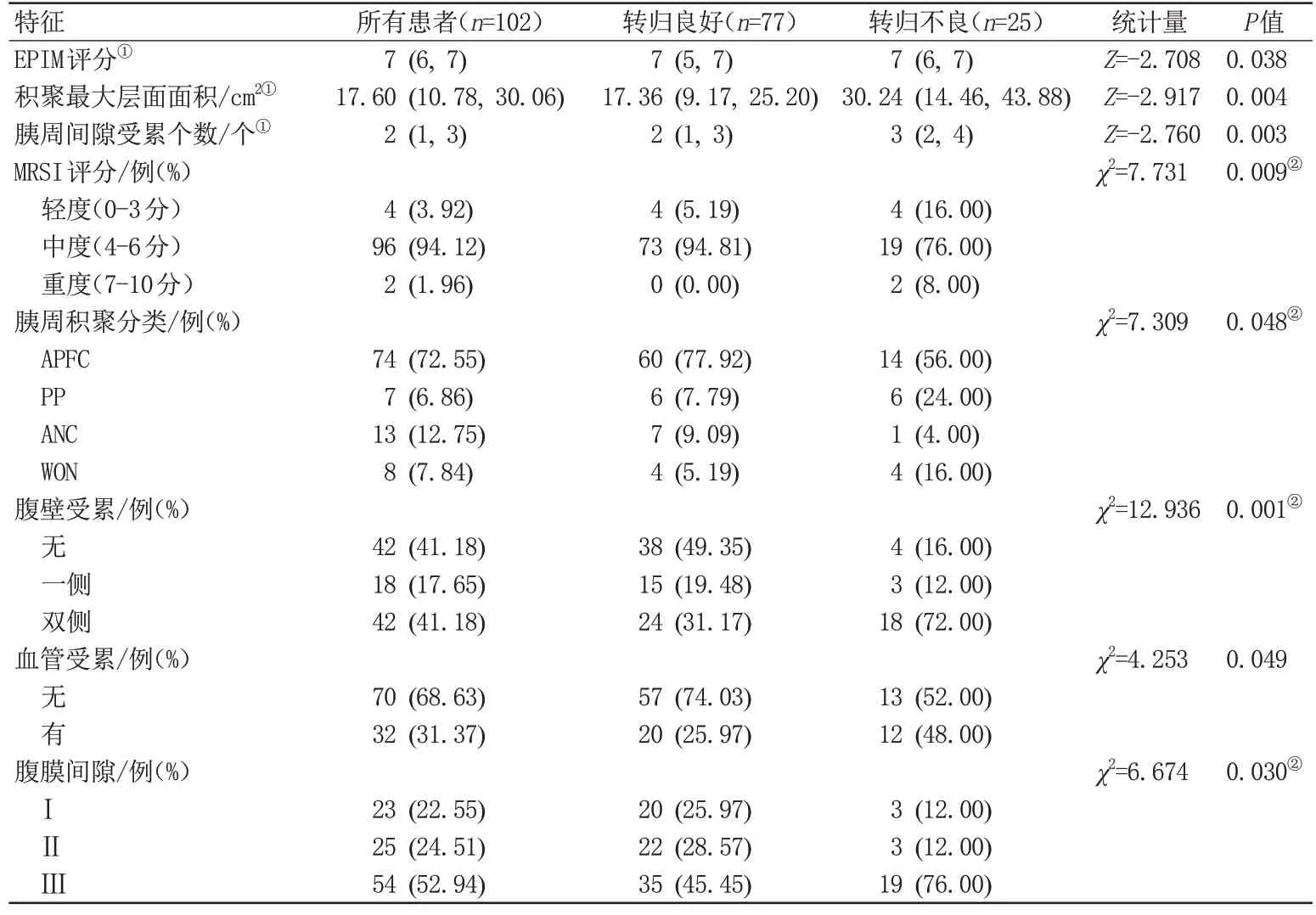
表3 MRI观察指标的单因素分析Tab.3 Univariate analysis of MRI indicators

2.4 多因素logistic回归分析
对表2和表3中具有统计学意义的10个指标(并发症、BISAP 评分、EPIM 评分、MRSI 评分、胰周间隙受累个数、积聚最大层面面积、积聚分类、积聚腹膜下扩散程度、胰周血管及腹壁受累)进行多因素逻辑回归分析,提示MRSI 评分、EPIM 评分、积聚最大层面面积、BISAP 评分与AP PPCs 转归不良的风险增加显著相 关(P<0.05)(表4),其 对 应 的 优 势 比(odds ratio, OR)分 别 为3.006(95%CI: 1.382-6.357)、0.454(95%CI: 0.217-1.159)、1.077(95%CI:1.002-1.159)、5.004(95%CI: 1.077-23.244)。虽然积聚的类型、胰周间隙受累个数、积聚腹膜下扩散程度、并发症、胰周血管受累差异无统计学意义(P>0.05),但是OR>1 提示这些因素是患者转归不良的危险因素;此外腹壁是否受累OR<1(0.090)提示其可能为患者转归不良的保护因素。

表4 急性胰腺炎胰周积聚早期转归的危险因素的多因素二元逻辑回归分析Tab.4 Multifactorial binary logistic regression analysis of risk factors for early regression of PPCs in acute pancreatitis
2.5 诺莫图模型构建
基于多因素logistic 回归分析,我们构建了一个早期预测AP PPCs 转归风险的诺莫图。每个变量的每个值分别对应一个具体的分数,然后再将诺莫图中包含的四个变量相应分数相加而得到每个个体的总分,最后将总分投影到总分量表上,以获得每个患者转归不良的概率(图4)。

图4 预测急性胰腺炎(AP)胰周积聚(PPCs)患者转归不良的风险的诺莫图。MRSI:MR严重指数;EPIM:MRI胰腺外炎症;BISAP:急性胰腺炎严重程度床旁指数;S:积聚最大层面的面积。 图5 预测模型的受试者工作特征(ROC)曲线及校准曲线。5A:ROC曲线,预测模型的曲线下面积(AUC)=0.946,95%可信区间为(0.905-0.988),敏感度为92%,特异度为86%;5B:校准曲线,预测模型的Bootstrap重采样(1000次),当实线(预测模型)更接近虚线(观测模型)更接近时,模型的校准效果更好。 图6 预测模型的决策分析曲线。红线表示预测模型;灰色斜线代表所有转归不良患者;黑色横线代表没有患者转归不良。Fig.4 Nomogram for predicting the prognosis of peripancreatic collections (PPCs) in acute pancreatitis (AP) patients.MRSI: MR Severity Index; EPIM:Extrapancreatic Inflammation on MRI; BISAP: Bedside Index for Severity in AP; S: maximal dimensional area of PPCs.Fig.5 Receiver operating characteristic(ROC) curves and calibration curves for predictive models.5A: The area under the curve (AUC) of ROC for the predictive model is 0.946, with a 95% confidence interval ranging from 0.905 to 0.988.The sensitivity of the model is 92%, and the specificity is 86%.5B: Bootstrap resampling of the predictive model is conducted 1000 times.In the graph, when the solid line representing the predictive model closely aligns with the dashed line representing the observed model, it indicates that the model calibration is better.Fig.6 Decision curve analysis (DCA) of the predictive model.The red line represents the predictive model, the gray line represents all patients with poor prognosis, and the horizontal solid line represents no patients with poor prognosis.
2.6 模型的验证
首先,多因素回归分析中,内戈尔科R 方等于0.684,霍斯默-莱梅肖检验P=0.973,证明了回归分析结果的可靠性;诺莫图展现了良好的预测能力(图5A),预测转归特征曲线的AUC 为0.946(95%CI:0.905-0.988),敏感度为92%,特异度为86%,约登指数为0.78;校准曲线(图5B)显示,三条曲线的走行高度一致,提示模型预测值与实际值差异无统计学意义。此外,决策曲线(图6)表明,随着模型曲线的扩展,在很大的风险阈值范围内,模型的净收益均高于极端情况下(实横线)的净收益,这证实了整个诺莫图的临床获益度良好。
3 讨论
本研究通过回顾性分析102 例AP PPCs 患者资料,探讨临床表现及影像特征影响其转归的独立危险因素,发现在MRI 上PPCs 最大层面面积、MRSI 评分、EPIM 评分,以及临床BISAP 评分是早期预测AP PPCs 转归的独立危险因素;随后构建了结合这些预测因子的诺莫图,并且其显示了良好的预测能力,是国内外首次通过构建基于临床表现及MRI 影像特征的诺莫图具体量化PPCs患者转归的风险;因此,可以在入院后对每个患者转归不良的概率进行预测,从而做到早期、快速、有效地筛查高危患者,这有助于患者的临床治疗及管理,从而改善患者的转归。
3.1 主要研究结果分析
在本研究中,共有25(24%)例转归不良;转归不良的发生率相对较高,可能的原因有:(1)本研究纳入的都是中重症、重症AP,排除了炎症较轻的患者;(2)本研究样本量较小,这可能导致转归不良的概率升高。
根据我们的诺莫图,随着PPCs最大层面面积增加,AP胰周积聚患者转归不良的风险相对增加。ZHOU等[16]研究发现PPCs 的最大层面面积与患者的严重程度密切相关,与单纯AP 患者相比,在胰周坏死的患者中,其指标相应升高;还有研究表明,胰腺外坏死的位置和范围大小为评估AP患者的临床结局提供了可靠和客观的信息[28]。本研究也取得了近似的结果,PPCs最大层面相应的面积在转归不良组增大,同时在一定程度上提示PPCs的体积增大,先前文献指出,胰腺外坏死体积有可能用作预测AP 不良结局的宝贵工具[29]。此外,该指标单因素和多因素分析同时具有统计学意义。不仅随后构建的诺莫图具有良好的预测性能,而且诺莫图的准确性也经受住了检验;因此,我们有充分理由将之用于早期预测PPCs患者转归。
通过logistic 分析和诺莫图,我们发现MRSI 是早期预测AP PPCs 转归的第二大预测因子。与CT 评分系统相比,MRI评分系统更能准确预测AP的严重程度和预后[30]。本研究证实了MRSI 评分可以直接用于早期预测PPCs 患者的转归。此外,MRSI 评分还可以被用来评估AP的严重程度[31]。我们的诺莫图将MRSI评分作为一个独立危险因素来进行更个性化的风险预测,进一步挖掘了其潜在价值。
尽管有文献报道EPIM 评分不仅可以在AP 早期评估严重程度,还可以提示潜在的重症AP 及早期器官衰竭[27]。此外有人提出了一种新的基于EPIM 和APPACH Ⅱ早期预测AP 严重程度的逻辑回归模型[32]。但本研究诺莫图显示,EPIM 可能某种程度上降低了AP PPCs 转归不良的风险。在一定程度上说明早期AP 的EPIM 评分与转归不良没有直接关系;本研究中PPCs患者大多是中重度、重症患者,这些患者EPIM评分都普遍较高,但是最终大多数预后良好,结合研究结果,可能提示:(1)EPIM 有降低转归不良风险的潜在能力;(2)对于EPIM 较高但转归不良的患者,可能原因是合并其他影响PPCs 转归不良的因素,且EPIM影响相对较小所致。
临床指标BISAP评分是影响患者转归的最大危险因素。有研究表明BISAP评分系统可作为AP患者随访和治疗的实用且可靠的指南[33]。此外BISAP评分还可以早期评估AP的严重程度及预后[34-35],这与本研究结果几乎一致。此外,有研究表明,BISAP评分是预测AP严重程度及死亡率的可靠工具[36]。进一步证明BISAP在预测AP的严重程度及预后方面具有良好的性能。
此外,本研究还发现积聚的类型、胰周间隙受累个数、积聚腹膜下扩散程度、并发症、胰周血管受累单因素分析差异具有统计学意义,然而多因素分析差异没有统计学意义(P>0.05),但OR>1是患者转归不良的独立危险因素,导致差异无统计学意义的最可能的原因是样本量较小,尚需加大样本量进一步验证。
3.2 本研究的临床价值及局限性
本研究将基于临床表现及MRI 特征的诺莫图作为临床事件个体化预测的统计模型,早期预测了AP PPCs 的转归风险,有助于临床医师决策、最佳治疗方案的选择以及患者的管理,从而改善患者的预后;提供了早期预测AP PPCs的转归更直观和可视的方法。尽管本研究发现具有一定前景,但因是回顾性研究,也存在一些固有的缺点:第一,本研究样本量偏小;第二,回顾性地进行数据收集可能会影响评估数据的可靠性;第三,本研究是一项单中心研究。未来仍需要更多具有更大样本量和涉及外部验证队列的研究来整合目前的结果。
4 结论
综上所述,本研究探讨了AP PPCs 的预后因素,并且建立的基于临床表现及MRI 特征的诺莫图能早期预测AP PPCs的转归,从而做到早期、快速、有效地筛查高危患者,这有助于患者的临床治疗及管理,从而改善患者的转归。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:张小明设计本研究的方案,对稿件重要内容进行了修改,获得了2022 年度川北医学院附属医院科研发展计划(揭榜挂帅)项目和川北医学院2022 年省级重点实验室及培育专项资金资助;罗江起草和撰写、修改稿件,获取、分析或解释本研究的数据;刘婷婷、张学英、蒋东林分析、解释本研究数据,对稿件的重要内容进行了修改;全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。
