基于胶原异三聚体的成骨不全症机理研究
2023-11-29强书敏
强书敏,吕 成,许 菲
(江南大学 生物工程学院,江苏 无锡 214122)
0 引 言
胶原蛋白是动物体内含量最丰富的蛋白质,可以作为结构蛋白为皮肤、骨骼、血管等提供支撑与张力.同时,胶原蛋白具有生物活性,可以与许多细胞外基质相互作用[1-3],人体内的胶原蛋白占总蛋白的三分之一[4].胶原蛋白的序列包含大量重复的(Gly-X-Y)n单元,其中X 位通常是脯氨酸(Pro),而Y 位通常为(2S,4R)-4-羟脯氨酸(Hyp)[5-6].3 条胶原蛋白链相互缠绕,折叠形成特有的三螺旋二级结构.当3 条链序列相同时,称为同三聚体,反之则称为异三聚体.三聚体螺旋结构中的两条肽链之间通过一个残基的错位排列,促使甘氨酸(Gly)亚氨基的氮(N-H)与相邻肽链X 位残基的羰基氧(C=O)形成氢键,按照顺序将3 条链命名为前链、中链、尾链.从胶原蛋白N 端到C 端形成一系列梯状排列的氢键,这是稳定三螺旋结构的主要驱动力来源.
人体中包含28 种类型的天然胶原蛋白,其中占比最大的是Ⅰ型胶原蛋白,是由两条α1 链与一条α2 链构成的异三聚体.医学研究发现,当Ⅰ型胶原蛋白中发生单点突变,往往是Gly 被其他残基替代,会引起包括成骨不全症(osteogenesis imperfecta,OI)在内的多种结缔组织疾病[1,7-9].OI 患者的症状差别很大,有轻度的多发性骨折,也有重度的围产期致死[7-10],但突变类型与疾病症状之间的联系尚不清楚.
天然胶原具有尺寸大、溶解度差和序列重复等特点,因此,很难利用全胶原序列在原子水平上进行分析,在生物物理方面主要通过主客体模型对OI 致病机理进行研究[11].将OI 突变插入具有高稳定性的主体序列中构建突变体,利用X 射线衍射,核磁共振(nuclear magnetic resonance,NMR)光谱和圆二色谱(circular dichroism,CD)实验表征突变对胶原三螺旋结构造成的影响[10-21].这些主体序列称为类胶原多肽(collagen model peptides,CMP),多包含Gly-Pro-Hyp 重复序列,在溶液中形成稳定的同三聚体螺旋结构.研究者在同三聚体序列中引入包含不同类型的OI 突变模体序列,破坏了三螺旋的分子结构,导致热稳定性显著降低,并且发现位于不同链的突变可引发不同的破坏效果[10,22-24].最经典的研究是在同三聚体(POG)103 条链中引入Gly→Ala 突变,结晶得到突变模型(PDB ID 1CAG),突变后的熔融温度(Tm)值由初始的60℃降至29℃[25].NMR 的研究集中于Ala 突变对局部三螺旋结构的影响.比如,尾链Ala 突变的氨酰质子升温速率高于未突变的Gly,表明突变破坏了尾链上的氢键,但是其他两个突变位点氨酰质子升温速率保持不变.耦合值(J)可以与氨基酸二面角φ 角对应,在正常Gly-X-Y 中Gly 的耦合值为(4.7±0.3)Hz,突变后只有中链Ala 的耦合值增大,其他链保持不变,表明虽然3 条链均引入Ala 突变,但只有一条链偏离三螺旋主链构象[26].由于Ⅰ型胶原是由两条α1(Ⅰ)链和一条α2(Ⅰ)链组成的异三聚体,为了更贴近Ⅰ型胶原的成分,近些年随着异三聚体理性合成技术的发展,也开始以异三聚体为主体肽来研究OI 突变[27-30].例如,将Gly→Ala 分别引入AAB 模型A、B 链时,A 链的突变同时发生在前链与中链,Tm值降低32.0℃,破坏1 个氢键[31],B 链突变在尾链中引入一个突变,其热稳定性降低20.5℃,破坏5 个氢键[32].尽管可以从NMR 中获取大量的定量动力学数据,但是这些研究集中在突变位点,缺乏突变对整体结构影响的描述.
除了生物物理实验之外,研究者们还利用了分子动力学(molecular dynamics,MD)模拟表征了主客体模型中OI 突变对胶原三螺旋结构的影响.从含有突变的CMP 模拟轨迹中提取主链氢键的构象变化,发现突变位点附近的氢键一部分遭到破坏,另一部分重构为水介导的氢键.同时,与晶体中棒状的三螺旋分子不同的是,突变后的CMP 模拟轨迹中,分子弯曲度明显增加[23,33-34].在一个包含数个OI 突变且长度为1 014 个残基的Ⅰ型胶原蛋白模型中进行MD 模拟,结果显示,突变位点附近结构有些呈现完整的三螺旋结构,有些部分解折叠并出现分子弯曲,这表明突变在不同的区域对结构的破坏也存在差异[35].尽管这些研究表明胶原序列中的Gly 突变会影响三螺旋结构,但是如何精确地描述突变对三螺旋分子整体运动模式的影响仍有待进一步研究.
利用三螺旋阶梯中相邻三角形的欧拉旋转参数和平移参数对胶原进行建模,并通过从PDB 数据库中提取参数的离散度来构建统计势能,得到了一种可以定量描述胶原形变的弹性函数[36].该模型将CMP 螺旋结构转化为Cα 三角形之间的移动.取Gly 与相邻氨基酸的Cα,构建三角形平面并建立坐标轴,量化平面之间的移动,利用该模型可以定量描述胶原自身结构的弯曲与拉伸.
本文利用abc(PDB ID: 5YAN)异三聚体,引入OI 突变位点,将第17 位Gly 突变为Ala,构建了7 种突变体.结合差示扫描量热(differential scanning calorimetry,DSC)、MD 模拟、梯阶模型分析等方法,定量描述了突变对胶原蛋白三螺旋热稳定性、分子结构与运动模式的影响,发现氢键的形成与分子形变具有高相关性,为进一步揭示OI 的致病机理奠定了理论基础.
1 材料与方法
1.1 差示扫描量热
在Nano DSC(TA Instruments)中对组装后的三螺旋进行DSC,并结合Nano Analyze 软件分析数据.本文所用的类胶原多肽序列购于上海吉尔生化有限公司,胶原自组装方法参照文献[37].自组装后的三螺旋浓度为1 mg·mL—1.水与PB 缓冲混合溶液至少扫描3 次作为基线,在 20℃下将样品溶液装入池中,并以 1℃·min—1的速率加热.从相应缓冲液的吸热曲线中减去样品的吸热曲线并归一化浓度.使用数据分析软件Nano Analyze 计算ΔH和Tm的值.
1.2 分子动力学模拟
在GROMACS 中的Amber99sb*-ILDN 力场下进行模拟[38-39].将不同胶原模型结构分别置于十二面体周期盒中,其中TIP3P[40]模型水分子约39 291 个.从盒子表面到最近的溶质原子的距离设定为10 Å(1 Å=10—10m).模拟的时间步长为2 fs.长程静电相互作用使用粒子-网格Ewald 方法[41]进行评估,其中,FFT 网格的最大间距为12 Å,并且通过六阶多项式进行插值.静电和范德华相互作用的最小截止距离设定为12 Å.使用最速下降法将系统降至局部能量最小值.随后,通过速度重新缩放算法(0.1 ps 弛豫时间)保持297 K 的温度,并且使用Berendsen 的弱耦合方法[42]控制压力P=1 × 105Pa,进行10 ns NPT 和100 ns NVT 模拟.
1.3 Cα 三角形
将胶原蛋白的运动看作一系列三角形的相互位移,三角形的顶点为Gly 与相邻非Gly(A1,A2)的Cα[43].按照右手原则建立坐标系,A2指向A1的方向为y轴.A1与A2之间的中点定义为坐标轴原点.x轴垂直于y轴,并且与原点到Gly 的向量呈锐角.z轴是在三股螺旋的N 端到C 端的轴方向上具有正值的x轴和y轴的叉积.通过最小二乘拟合将标准坐标系叠加到给定的Cα 构成三角形上,从而得到Cα 三角形的参照系.
1.4 梯阶参数与形变分数
两个成功构建的三角形之间按照运动模式可分为6 种不同的相对关系,分别为在x-,y-,z-轴的3 个位移: Rise,Shift,Slide;3 个旋转: Roll,Tilt,Twist[36].利用已知弹性函数[44]来估算胶原在形变时的程度,形变分数(deformation score E,记为EDS)取自6 个梯阶参数中两两成对的弹性贡献之和:
式(1)中:E0为基准线,本文中取E0=0. Δθiθi-是第i步梯阶参数与平衡态之间的差值.平衡态和力场参数fij取自40 个结晶良好的胶原蛋白的梯阶参数数据库.i,j分别代表梯阶的6 个参数.具体参数计算方法详见文献[26].
1.5 氢键参数
胶原三螺旋结构中甘氨酸亚氨基(N-H)与相邻肽链X 位置的氨基酸的羰基氧(C=O)能够形成氢键,模拟中氢键的定义为氢供体和受体重原子之间的原子间距离R小于3.5 Å,同时氢-供体-受体构成的α 角小于30°[45].氢键能量(EHB)的计算采取以下公式:
式(2)中:R0为稳定时氢键的平均距离,本文取2.95 Å,R为某时刻的氢键距离,D0为对应原子在该力场下的井深.F(θ)cos2(θ)cos2(φ),氢键中N-O 原子成键按照sp3-sp2 轨道杂化[46],θ角是NGly-HGly-OXaa,φ角为CXaa-OXaa-HGly,N 和H 原子来自Gly,而C 和O 原子来自X 位置的氨基酸.
2 结果
2.1 DSC 表征
为了描述OI 突变对胶原结构的影响,使用先前设计的异三聚体胶原abc作为宿主模型并引入Gly→Ala 突变,其中a为前链,b为中链,c为尾链,突变后的链分别为a′、b′、c′.本文所用abc序列如图1(a)所示,避免首尾端摆动影响,选取中间区域Gly,将每条链第17 位突变为Ala.分别将突变模型命名为单点突变a′bc、ab′c、abc′,双点突变a′b′c、ab′c′、a′bc′,三点突变a′b′c′.

图1 abc (PDB ID 5YAN)的序列和整体结构Fig.1 Sequence and overall structure of abc(PDB ID 5YAN)
为了检测Gly 突变对胶原热稳定性的影响,使用DSC 表征abc与突变体的焓变(ΔH)及焓变发生温度(Tm).DSC 结果显示,与abc相比,突变导致Tm值降低约15℃,ΔH减少10~ 20 kcal·mol—1(表1).相对于单点突变体,双点突变未测量到明显的放热峰,即ΔH,这表明双点突变导致了大部分三螺旋结构解折叠.结果表明,在引入Gly→Ala 突变后,胶原模型热稳定性降低,突变点越多,下降越明显.
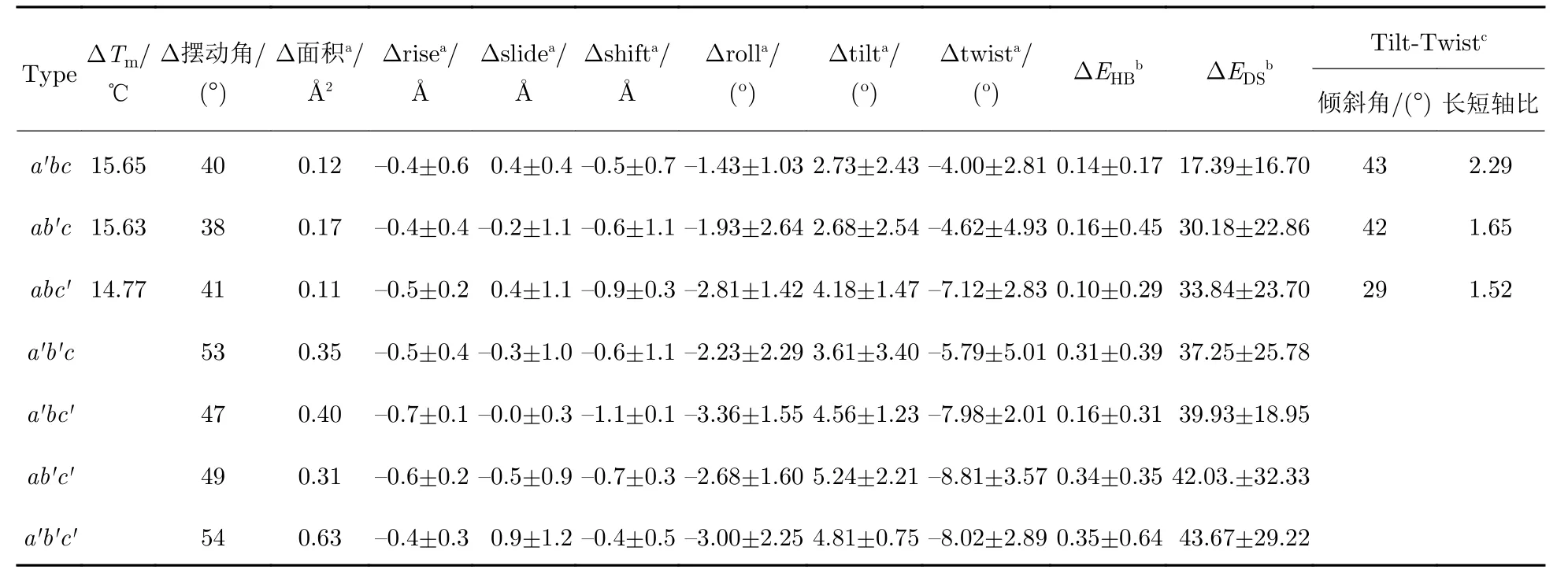
表1 胶原参数平均值的变化Tab.1 Average of parameters changes in collagen
2.2 结构变化
为了分析突变对于胶原分子全局的结构变化,提取系统平衡后模拟轨迹,将N 端第1—10 位氨基酸进行重叠,定义侧视图中轨迹边缘构成的角度为三螺旋摆动角度,仰视图中轨迹构成的形状为三螺旋摆动方向.结果显示,所有模型在溶液中均存在一定的摆动角度,abc中摆动角度约为 30°,而摆动方向的集合近似圆形(图2(a)).与abc相比,Ala 突变后摆动更加明显.a′bc摆动方向的集合呈椭圆形,摆动角度增加至40°(图2(b)).与a′bc相似,ab′c和abc′的摆动角度约为40°(图2(c—d)),但摆动方向也近似圆形.在多点突变体中发现了更大的摆动,与单点突变相比,摆动的角度增加了10°,约为50°(表1).同时,摆动的形状仍然大致呈圆形.结果表明,突变后主链整体结构受到破坏,摆动角度均有增加;突变引入的越多,摆动角度增加越多.而摆动方向的集合则出现不规则变化,有时与abc一致保持圆形,有时则变为椭圆形.虽然晶体中三螺旋往往呈棒状结构,但是在水溶液中会产生动态的结构形变,导致分子在各个方向上的摆动[47].引入突变后,发生较大的摆动角度与方向的变化,可能与突变引发的局部结构形变有关.

图2 从abc 和突变体的MD 轨迹中提取主链结构Fig.2 Main chain movement extract from MD trajectory of abc and single chain mutants
2.3 Cα 三角形
在胶原蛋白中,由于G-X-Y 序列的重复,可以将其运动轨迹视为一系列三角形的位移[36],而每一个三角形的面积可以表示为该区域的解旋程度.为了描述Gly-Ala 突变后局部区域结构的变化,排除N-与C-端的摆动影响,提取轨迹5 000 帧轨迹,计算第13—18 个三角形的平均边长与面积(图3(a)).以Cα 为顶点,三角形在胶原中的结构如图3(a)所示,Gly 以紫色表示,按照右手螺旋选取A1、A2,表示的氨基酸在图中标出.

图3 Cα 构成的三角形以及突变后边长与面积变化Fig.3 The change of side length and area after mutation in Cα triangle
abc中三角形的边长为(4.81±0.09)Å,同时三角形的平均面积为(10.28±0.10)Å2,每个区域表现为一个边长为4.8 Å 的等边三角形,表明在未突变时3 条链的距离相近且变化较小,结构非常稳定(图3(b—d)).在突变体中,Gly-A1边长增加(a′bc的第15 个、ab′c的第16 个、abc′的第17 个三角形),增量为1.03~ 1.33 Å.同时A1-A2边长也出现增加(a′bc的第16 个、ab′c的第17 个、abc′的第18 个三角形),最大增量为1.58 Å.由于边长增加,相对应的三角形面积也出现增加,这些三角形分别为a′bc的第14—16 个、ab′c的第15—16 个、abc′的第16—17 个三角形(图3(e)),增量最大依次为(1.52 ±0.97)Å2、(1.79±1.28)Å2、(1.40±0.95)Å2.结果表明,由于Gly 变为侧链更大的Ala,虽然在整体上依旧保持三螺旋的胶原结构,但是突变所在三角形的Gly-A1边长,以及相邻且位于C 端的三角形的A1-A2边长增加,同时伴随对应面积的增大.为了观察多点突变对局部结构的影响,在双链突变中计算三角形的边长与面积.在a′b′c突变体中,突变的引入会增加第15—16 个三角形的Gly-A1边长,以及第16—17 个三角形的A1-A2边长.面积的增加出现在第14—17 个三角形,而突变区域第14—18 个三角形的平均面积为(11.57±0.75)Å2.与单链相比,影响的区域具有一定的叠加性,包含a,b链单点突变时的区域(第14—17 个三角形).其中b链突变所在的三角形面积变化最大,增大(2.60±1.18)Å2.在ab′c′突变体中,与a、b链组合突变类似,当组合b、c链突变后,边长与面积的增加区域为单链突变的叠加: 第16—17 个三角形的Gly-A1边长,以及第17—18 个三角形的A1-A2边长增加;第16—18 个三角形的面积增大,最大的一个增加了(3.34±1.53)Å2.与其他两个双点突变体不同,a′bc′突变体虽然导致了整体面积的增大((10.69±0.73)Å2),但影响的区域(第15—18 个三角形)小于两个单链突变区域(第14—18 个三角形)的叠加,三角形面积增大(1.77±0.15)Å2.同时引入3 个点的突变,a′b′c′突变体,也仅仅是影响到了4 个三角形的面积.结果显示,当突变发生在相邻两个三角形区域时,变化的区域包含单点突变所在的区域,而当突变出现在相隔三角形时(a′bc′),变化的区域大于单点突变,小于两个单点突变的和.三点突变则表现为大于单点突变、小于3 个突变的数值之和.
2.4 梯阶参数
为了解析胶原蛋白突变前后运动模式的变化,利用6 种梯阶参数,将胶原的结构形变分解为一系列Cα 三角形的旋转与位移,计算突变前后参数的变化,第14—18 个梯阶参数变化平均值如表1 所示.在3 个单点突变体中,突变所在的及相邻N 端梯阶Tilt 值增加(a′bc的第14—15 个梯阶,ab′c的第15—16 个梯阶,abc′的第16—17 个梯阶),增加分别为6.67°(a′bc)、5.77°(ab′c)、7.82°(abc′)(图4(a)).在相同区域中Twist 的绝对值变大(图4(b)),最大变化量分别为 —8.34°(a′bc)、—12.96°(ab′c)、—14.28°(abc′).双点突变体中,a′b′c中Tilt 值在第15—16 步变大(8.32°、6.21°),而Twist 值在第14—17 步均有增大,最大增量—13.77°,包括了两个单链突变位点.与之类似地,ab′c′、a′bc′中Tilt 与Twist 变化区域包含组合的两个突变.三点突变体a′b′c′虽然在最大变化量上大于双点突变,但是在变化的区域上没有影响更多的梯阶.这一结果与面积参数变化相似,在相邻与相隔三角形发生的突变会影响其变化区域的叠加程度.

图4 类胶原多肽结构参数的变化Fig.4 Changes of structural parameters of CMP
胶原构象与参数之间的耦合程度可以通过梯阶参数两两关联得到的散点图展现,拟合椭圆区域进行可视化.采用2D 置信区间拟合,取值95%拟合变化程度最大的Tilt 与Twist 参数,如果构成的椭圆与x轴形成的角度在(45±25)°,同时长短轴之比大于1.2 则认为这两个参数具有强关联性.abc及单点突变所在三角形的Twist-Tilt 的椭圆值如表1 所示.结果显示,在abc中Twist-Tilt 参数之间显示了良好的相关性(表1),表现为狭长的椭圆,长轴与x轴的夹角为38°,长短轴之比为3.06,这表明Tilt 与Twist 之间有较高的耦合度.引入突变后,Twist-Tilt 的分布更广泛(图5(a—c)),椭圆区域面积变大,并且往图形右下角偏移,即Tilt 由负变正,Twist 绝对值增大.同时皮尔森相关系数分别为—0.80(abc)、—0.67(a′bc)、—0.45(ab′c)、—0.31(abc′),在大于100 个数据点时,相关系数绝对值大于0.3就表现为良好的相关性.Ala 突变侧链增加一个 -CH3,胶原内部空间位阻增加(图5(d—f)),Tilt 值由负转正,耦合Twist 绝对值增大,导致三螺旋局部结构弯曲,与前文中发现的摆动幅度增大相一致.
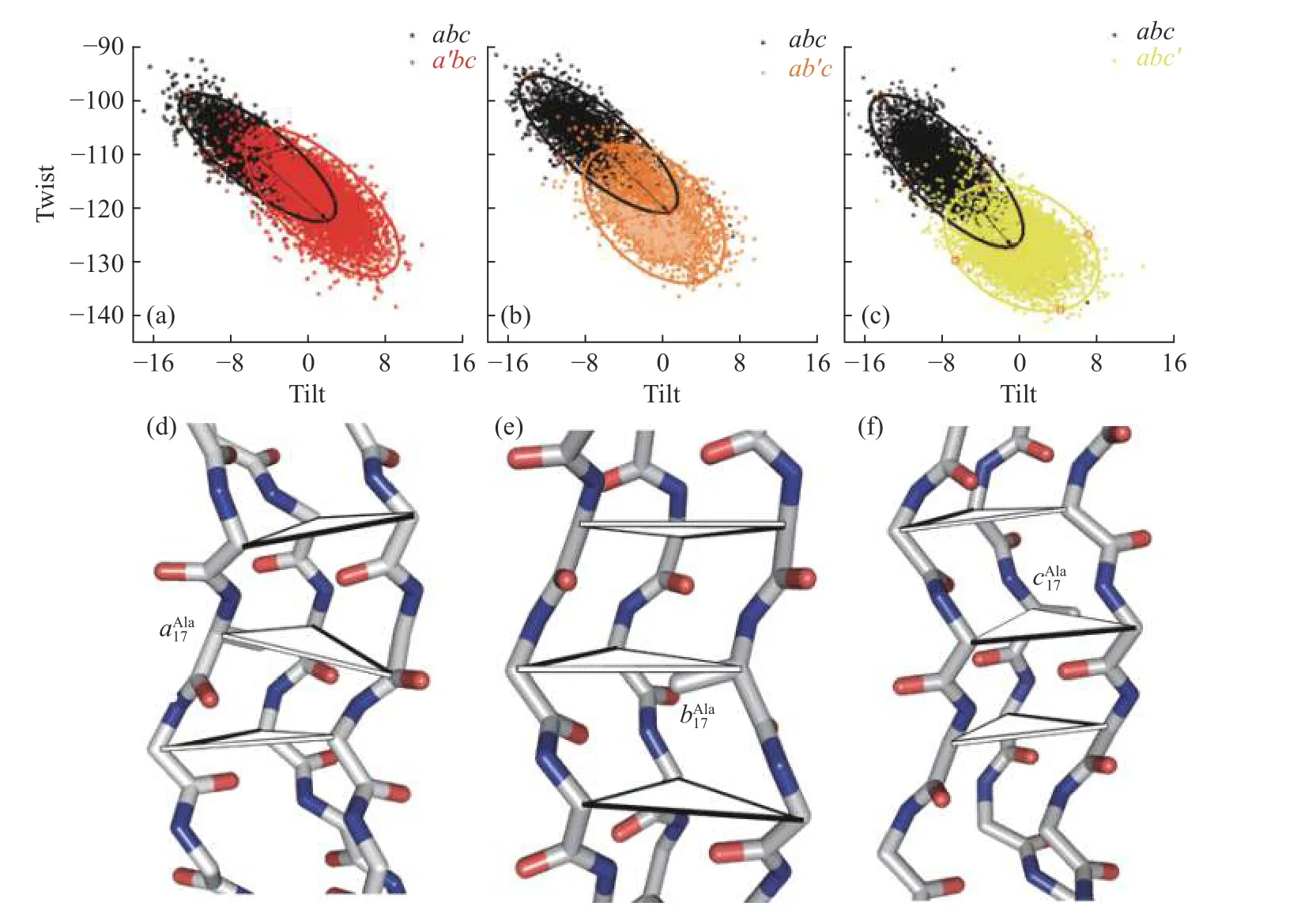
图5 单点突变体与abc 相应步骤Twist-Tilt 的散点图Fig.5 Scatter plot of abc and corresponding Twist-Tilt step in single mutants
2.5 氢键与形变分数相关
为了描述胶原结构的整体变化,在第7—22 个梯阶中利用公式(1),结合6 个梯阶参数,计算不同突变体的形变分数(deformation score).结果显示,与abc相比,突变会增大附近区域中各梯阶的形变分数(图4(c)).在单点突变中c链影响4 个梯阶,其余两个均只影响3 步梯阶,形变分数平均值排序为abc′(69.88)>ab′c(59.44)>a′bc(47.24),表明在不同的链中引入的突变导致不同程度的结构形变.
Gly 作为胶原蛋白主链氢键氢供体,同时作为梯阶参数三角形的顶点,氢键变化可能与梯阶参数的变化有关.为了探索氢键能量变化(ΔEHB)和形变分数变化(ΔEDS)之间的相关性,选取第7—22个三角形内包含的氢键,计算胶原在模拟时间内的氢键平均能量与结构的平均形变分数,去除包含盐桥变化的结构区间与相关氢键,整合7 种突变体的数据,拟合了每一个氢键ΔEHB和与之对应梯阶ΔEDS之间的相关性(图6).当ΔEHB为0 时,ΔEDS的数值也在0 附近,表现出结构的稳定.随着突变位点的引入,氢键被破坏,ΔEHB的值增加.同时,胶原蛋白的整体结构被破坏,ΔEDS的值增加.在0.01 显著性水平上,在数据点大于80 时当相关系数大于0.5 就表现为较好的相关性[48],拟合得到R2为0.76.结果表明,突变不仅破坏了局部的氢键,而且导致了胶原三螺旋的形变.
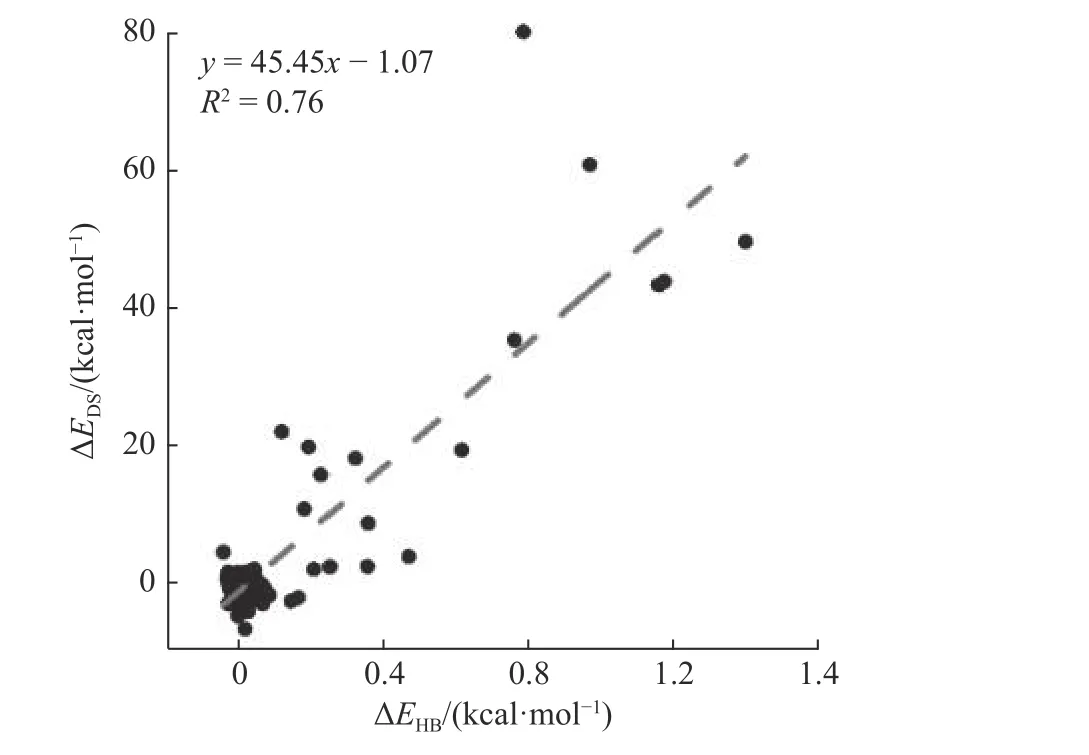
图6 突变体氢键能量变化与对应区域形变分数的相关性Fig.6 The correlation between the hydrogen bond energy change of the mutant and the deformation score of the corresponding region
3 讨 论
本文通过在abc异三聚体3 条链中引入Gly-Ala 突变,利用DSC 实验测定了突变体热稳定性,采集了分子动力学模拟轨迹中的结构信息,表征突变前后的变化.结果显示,突变引入后热稳定性降低,单点突变降低15℃,双点及三点突变体无明显焓变.分子动力学模拟的结果表明,Gly-Ala 突变的邻近区域发生了结构的变化,包括突变所在Cα 三角形的Gly-A1边长与相邻C 端Cα 三角形的A1-A2边长显著增加;随着突变个数的增加,Cα 三角形的最大面积增量呈上升趋势,增量排序为三点突变(4.82 Å2)>双点突变(3.67 Å2)>单点突变(1.99 Å2),这表明面积的变化具有一定的叠加性;同时在梯阶参数中,突变所在区域弯曲度增加,Twist-Tilt 分布范围变大,Tilt 值增量范围为2.01°~9.11°,Twist 值减量范围为8.33°~15.61°;突变位点附近1—3 个氢键受到破坏.Ala 突变不仅破坏了胶原的局部结构,而且影响了胶原分子的整体运动模式,摆动角度随着突变的引入增加10°以上.摆动方向在不同的突变中呈现不同的趋势,例如:ab′c突变体摆动方向呈现出与原序列类似的随机分布,而a′bc突变体则出现了特定方向的倾向性;突变体形变分数和氢键能量与原序列相比有着显著增加,两者的变化具有高相关性.表明突变导致三螺旋局部解折叠,热稳定性下降及焓变降低,同时局部结构的破坏会导致胶原分子整体形状与运动状态的改变.
胶原蛋白G-X-Y 重复序列中的Gly 被更大的氨基酸替代会导致各种表型的成骨不全症,大多数Gly→Ala 的突变是温和且不致命的[7,9].天然胶原中OI 突变的不稳定性在短肽模型中会被放大,这可能是由于类胶原短肽中更短的序列和更高的亚氨基含量.在之前的研究中,将Gly-Ala 突变引入(GPO)10同源三聚体后进行分子动力学模拟,结果显示,突变后整体结构摆动幅度增加,平均增量为2°[47].尽管该模型可以模拟胶原蛋白中Gly 突变,但它们不能准确地解释在天然异源三聚体突变中发现的结构破坏.本研究中使用的abc异三聚体模型相较于传统的高脯氨酸含量胶原序列柔性更高,模拟中原序列的摆动角度为30°,突变体的摆动角度的增量均在10°以上.原纤维中的研究发现,Gly 位置的突变会使分子弯曲,突变分子与正常分子共聚时可能会导致原纤维的形成延迟,影响纤维形貌[49-50],成骨不全动物模型中常出现形貌异常的原纤维[51-52].由此推测,点突变导致的三螺旋曲度变化,除了可以降低胶原蛋白的热稳定性,还可能影响胶原纤维的形成,从而影响其力学性质、纤维矿化、骨骼形成等与成骨不全症相关的生理病理过程.
本文将突变引入不同的3 条链,结果表明不同链上Ala 突变对结构破坏存在如下差异: 在b链与c链中出现更严重的氢键破坏,最大ΔEHB为1.15 kcal·mol—1;3 种单点突变体呈现不同的摆动方向,a′bc突变体摆动方向相较于ab′c、abc′倾向性更为明显;Cα 三角形面积变化中,a′bc突变体只有1 个三角形的增量超过1 Å2,而ab′c与abc′突变体中均有2 个.在不同的胶原主体序列中也发现了类似的趋势,肖建喜等[53-54]在包含天然胶原序列的同源三聚体中引入Ala 突变,NMR 结果显示在不同链上的Ala 对链间氢键的破坏出现区别,Hartgerink 等利用异三聚体模型AAB 也观察到了相似的现象[31-32].这可能是因为胶原3 条链中突变位点所处化学环境存在差异,相同突变会有着不同的影响效果.本文结合实验与计算方法,解析了Gly→Ala 突变对临近区域和整体运动模式的影响,研究了OI 对胶原结构在生物物理方面的作用,为进一步揭示成骨不全症等相关胶原疾病的致病机理打下了理论基础.
