不同悬液滴加剂量在人类染色体制备中的应用
2023-11-29杨丽霞李淑云齐山芹
杨丽霞,陈 坤,张 帆,李淑云,齐山芹
1.山东中医药大学第二附属医院生殖科,山东济南 250001;2.山东中医药大学,山东济南 250014
染色体常规G显带检测作为细胞遗传学的经典检测技术,是染色体病诊断的金标准,在产前诊断、辅助生殖等领域也具有重要的作用[1-2]。在染色体制备过程中滴片环节是其中重要的步骤之一,制作出高质量的标本玻片是保障染色体核型诊断准确的前提和必要条件。本研究使用染色体分散仪制片,在相对固定的温度及湿度环境设定下,采用4种不同剂量细胞悬液滴加制片,通过制片后自动扫描分析系统采集有效细胞图占比、分裂相展开面积、染色体带纹辨析度等指标评价,以期探讨制片环节中适宜的细胞悬液滴加剂量,制作出更加有利于核型分析的标本玻片,提高分析效率及诊断准确性,现报道如下。
1 材料与方法
1.1标本采集 在2021年9-10月山东中医药大学第二附属医院(以下简称本院)10个不同批次的外周血染色体检测标本中随机选取标本各1份,共计选取10份标本为研究对象,在正式发放检测报告后剩余的细胞悬液标本用于本研究。
1.2仪器与试剂 主要仪器:染色体分散仪(美国IDEX)、染色体自动扫描分析系统(德国蔡司)、移液枪、超净工作台、恒温培养箱、离心机、医用冰柜、鼓风干燥箱、电热恒温水温箱等;主要试剂:离心管式T型淋巴细胞培养基(广州拜迪)、秋水仙素、胰蛋白酶、吉姆萨染色液、低渗液、甲醇、冰乙酸等,均为国产试剂;玻片:病理级显微镜载玻片(10127107P-G,江苏世泰)。
1.3方法
1.3.1细胞悬液制备 采用常规方法接种及收获外周血细胞标本:采集外周血标本3 mL于肝素抗凝管中,5 mL注射器7号针头垂直接种26~28滴于淋巴细胞培养基中,倾斜放置于37 ℃培养箱中培养68~72 h,1 mL注射器5号针头垂直加入秋水仙素(20 μg/mL)2滴,继续培养1.5 h,再经过离心、低渗、预固定、3次固定后制成细胞悬液,放置于-18 ℃医用冰柜中保存备用。
1.3.2滴片 染色体分散仪预设参数:温度为27 ℃,相对湿度为55%,玻片编号后平置于染色体分散仪内镂空架上,细胞悬液自低温冰柜中取出后立即滴片。采用移液枪吸取悬液滴加,每份标本调整4种不同剂量各滴加2张玻片,每张玻片分别在两端近中心点1/2处各滴加悬液2滴,分别制作10、20、30、40 μL 4组各20张标本玻片,共计制片80张。滴片后静置15 min,玻片装入铜质染色架放置75 ℃鼓风干燥箱中烤片3 h。
1.3.3常规G显带 参照文献[3]及《全国染色体病诊断与产前诊断培训班——细胞遗传学实验室工作手册》[4],进行常规G显带操作。
1.3.4扫描分析 采用染色体自动扫描分析系统采集细胞图,设置每张玻片高倍镜扫描70个细胞图,用于众数分析及核型诊断。
1.4评价指标 (1)有效细胞图占比,染色体自动扫描分析系统所采集的细胞图图像清晰、细胞相对完整、可用于分析诊断的细胞图作为有效细胞图,并计算有效细胞图占比。(2)分裂相展开面积(R值),4组剂量分别选取20个有效细胞图,计算其R值:R=πab/4AB[5]。(3)染色体带纹辨析度评价,评价标准参照《人类细胞遗传学国际命名体制ISCN2016》所示染色体核型示意图,质评条带及评分标准参考文献[6-7],制订以下评分标准:320~<400条带计1分;400~<550条带计2分;550条带计3分;>550条带计4分。

2 结 果
2.14组有效细胞图占比比较 染色体自动扫描分析系统采集有效细胞图占比随着滴加剂量增大而降低:10 μL组、20 μL组、30 μL组采集有效细胞图占比均大于40 μL组,差异有统计学意义(10 μL组与40 μL组比较χ2=17.106,P<0.001;20 μL组与40 μL组比较χ2=11.683,P=0.001;30 μL组与40 μL组比较χ2=13.378,P<0.001)。10 μL组、20 μL组、30 μL组采集有效细胞图占比比较,差异无统计学意义(P>0.05)。见表1。

表1 4组有效细胞图占比比较
2.24组R值比较 10 μL组、20 μL组、30 μL组、40 μL组R值分别为0.16±0.03、0.21±0.04、0.25±0.07、0.28±0.08,4组R值比较,差异有统计学意义(F=16.059,P<0.001)。10 μL组与20 μL、30 μL、40 μL组R值比较,差异有统计学意义(P<0.05);20 μL组与40 μL组R值比较,差异有统计学意义(P<0.05);20 μL组与30 μL组R值比较,差异无统计学意义(P>0.05);30 μL组与40 μL组R值比较,差异无统计学意义(P>0.05)。随着悬液滴加剂量增加,R值随之增加,但是达到一定阈值后,展开面积过大,将影响扫描系统采集到完整的细胞图。见图1。
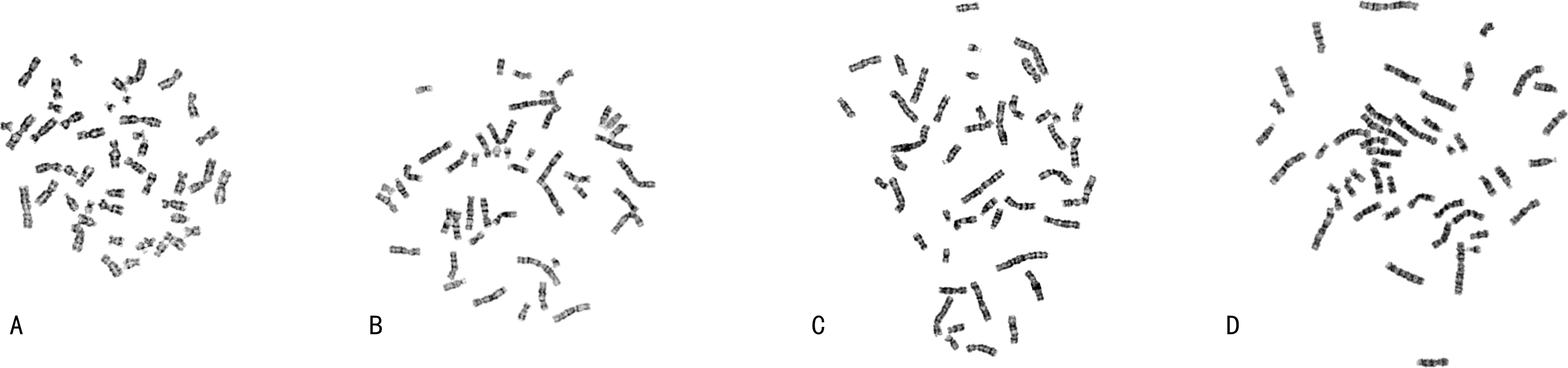
注:A为10 μL组;B为20 μL组;C为30 μL组;D为40 μL组。
2.3染色体带纹辨析度比较 10 μL组、20 μL组、30 μL组、40 μL组染色体带纹质量评分分别为(1.60±0.60)、(2.25±0.72)、(2.45±0.83)、(2.65±0.81)分,随滴加剂量增大而逐渐升高,差异有统计学意义(F=7.493,P<0.001)。40 μL组染色体带纹质量评分与30 μL组、20 μL组比较,差异无统计学意义(P>0.05);20 μL组染色体带纹质量评分与30 μL组比较,差异无统计学意义(P>0.05)。10 μL组染色体带纹质量评分低于其他3组,差异均有统计学意义(P<0.05)。见图2。

注:A为10 μL组;B为20 μL组;C为30 μL组;D为40 μL组。
3 讨 论
近年来,遗传学检测在优生优育及产前诊断、染色体疾病诊断等领域得到广泛应用,染色体核型分析目前仍然是遗传学诊断重要的检测方法之一[8]。外周血染色体检测技术在1960年由MOORHEAD等建立,是细胞遗传学研究的重要基础。如何制备出高质量的染色体标本,提高分析效率及核型诊断的准确性,以便给予临床诊断及治疗更加精准的参考指标,是各个细胞遗传实验室不断追求的目标。染色体制备步骤繁琐,影响因素较多,制备过程中的实验室条件控制,尤其是制片环节的标准化及可重复性条件的建立是研究的重点之一[9-10]。SPURBECK等[11]首次提出了染色体分散动力学理论,为解决染色体分散问题提供了理论基础。依据染色体分散动力学原理设计的染色体分散仪在染色体制备中的应用,为实验室制片环节的条件控制提供了可能性。在滴片时可设定相对稳定的温度及相对湿度等参数,从而保证染色体制备的重复性和一致性。尽管如此,不同的实验室设置参数也略有差异[9,12-13],温度波动范围为25~30 ℃,相对湿度波动范围为50%~55%。本研究采用染色体分散仪滴片时设定温度为27 ℃,相对湿度为55%。但是即使对染色体分散仪进行相对稳定的参数设置,不同实验人员制片及不同批次制片效果仍有差异。因此,制片环节中只对滴片环境温度及湿度的控制尚不足以保证稳定的制片效果,如何进一步完善制片环节中的条件设定,以保证制片效果的稳定性是急需解决的问题。
染色体制备环节中滴加悬液剂量对制片效果影响的研究较少提及,本实验室在染色体制备的各个环节,如标本接种、细胞培养、细胞收获、显带等保持常规操作的前提下,制作本研究所用标本玻片,在滴片环节采用同一台染色体分散仪、在同一时间、由同一名实验室人员制片,分别采用10、20、30、40 μL 4种不同的悬液剂量,在相同滴片环境中制作4组染色体玻片,通过比较4组标本玻片中染色体自动扫描分析系统所采集有效细胞图占比、R值、染色体带纹辨析度等指标,发现在相同或者相近的温度、湿度条件下滴片时,细胞悬液滴加剂量不同,染色体制片效果不同:低剂量悬液滴片有效细胞图占比高于高剂量悬液滴片;随着剂量逐渐增加,R值随之增加,染色体带纹辨析度也随之增高,但是剂量增加到一定程度时,因过度分散,易造成扫描系统采集细胞不完整,使有效细胞图数量减少,从而影响分析效率及诊断准确性。
有研究者认为,中期染色体分散质量主要取决于载玻片上固定液的挥发过程,通过温度及湿度的协同作用,以保证最佳的分散效果[14]。本研究中滴片环节是在染色体分散仪中进行,设置了相对稳定的温度及湿度条件,4组不同悬液剂量制片均由一名实验室人员在同一时间内完成,出现分散效果的不同,考虑是由于剂量效应使玻片表面固定液的挥发速度产生差异:滴加剂量小的玻片表面固定液在同等温度及湿度条件下,干燥时间相对较短,分散过程也相应缩短,R值较小,染色体伸展不充分;而滴加剂量大的玻片表面固定液在同等温度及湿度条件下则干燥时间相对较长,染色体分散过程相应延长,展开面积也增大,染色体伸展充分。因此,增加悬液滴加剂量在同等温度及湿度设定条件下可提高染色体的分散程度及带纹辨析度。但是剂量增加到一定程度,细胞过于分散可造成扫描系统采集完整的细胞图数量减少,反而不利于核型分析。本研究中,在染色体分散仪设定温度为27 ℃,相对湿度为55%的条件下,20 μL组、30 μL组制片效果优于10 μL组、40 μL组,能够在保证足量的有效细胞图被采集的前提下,获得适度分散及高质量带纹辨析度的中期染色体,以满足核型分析的需要。
本研究通过评价不同悬液滴加剂量在染色体分散仪制片中的效果,旨在探索染色体制片环节中重复性好、一致性程度高的条件设定,在以后的实验室推广中结合自动化设备的引进[15],不断完善染色体制备标准化流程,获得高质量的中期染色体核型,提高分析效率及核型诊断准确性,为临床诊断及治疗提供更加科学的参考指标,以利于精准医疗的深入开展。
