男性乳腺包裹性乳头状癌合并肉芽肿性乳腺炎1例及文献复习
2023-11-29吴念,傅敏
吴 念,傅 敏
1.重庆市第五人民医院甲状腺乳腺外科,重庆 400062 2.重庆市东南医院产科,重庆 401336
男性乳腺癌(MBC)在临床较少见,占所有乳腺癌的0.5%~1.0%,发病率正逐渐上升[1]。乳腺包裹性乳头状癌(EPC)是一种少见的膨胀性生长的低级别浸润性癌,乳头状病变的周围无肌上皮包绕。肉芽肿性乳腺炎(GM)是一种少见的、局限于乳腺小叶的良性肉芽肿性病变。乳腺癌合并GM病例报道极少,国内外报道不超过10例[2-3],而男性EPC合并GM病例更是极为罕见,目前鲜有报道。本研究将报道1例男性EPC合并GM病例,并进行文献复习,以期对此类疾病的危险因素、临床病理特征和发病机制、诊断、治疗进行深入分析,现报道如下。
1 临床资料
患者,男,62岁,以“发现左乳包块4个月”在重庆市第五人民医院门诊就诊。偶有左侧乳腺触痛或刺痛,无乳头溢液表现,无乳腺红肿及外形改变。既往否认乳腺癌家族史,否认慢性肝病、糖尿病、睾丸炎等疾病。无长期口服药物病史。查体:双侧乳头增大,双乳对称,形态正常,无红肿及皮纹改变,未见“橘皮征、酒窝征”。左乳外上象限距乳头约1.5 cm乳晕区可触及1.0 cm×1.2 cm大小的肿块,质韧,边界不清,活动度差,有触痛,其余双侧乳腺未触及明显包块,双侧腋窝及双侧锁骨上下未触及肿大淋巴结。在局部麻醉下进行左侧肿物切除,术中肿物边界不清,与周围乳腺组织无明显界限,灰白色实性肿瘤,无包膜。病理检查结果:乳腺导管内乳头状瘤伴部分导管上皮不典型增生,不排除导管原位癌形成。免疫组化法检测结果提示:EPC(核低、中级别),CK5/6(-),P63(-),calponin(-),CK8/18(+),ER(80%+++),PR(50%+),Her-2(+),Ki-67(15%+),见图1A。完善胸部CT检查,未见明显异常。肿瘤标志物检测结果提示:糖类抗原(CA)125、CA153、癌胚抗原(CEA)、CA199、甲胎蛋白(AFP)均为阴性。后续进行左乳切除、左侧前哨淋巴结活检术,病理检测结果提示:左乳腺病伴GM,见图1B,间质纤维及胶原纤维组织增生。另送“上切缘、外上切缘、下切缘组织”进行病理检测,未见肿瘤浸润。左侧腋窝蓝染前哨淋巴结3枚,非蓝染淋巴结7枚,均呈淋巴组织反应性增生,免疫组化法检测结果提示:CK-P(上皮+),Ki-67(5%+)。术后恢复良好。术后口服他莫昔芬治疗,20 mg,每日1次。术后1年余患者自行发现“左侧腋窝包块”再次来院,查体双乳区未触及明显包块,左侧腋窝可触及2.0 cm×2.5 cm大小的包块,质韧,边界欠清,活动度较差。可疑左乳腺癌腋窝淋巴结转移。完善胸部CT检查,结果提示:左侧腋窝有两处肿大淋巴结,肺部呈现慢性炎症病灶,见图2。完善乳腺彩超提示左侧腋窝异常淋巴结。肿瘤标志物正常。腹部彩超,头颅MRI检查均未见明显异常。再次进行左侧腋窝肿大淋巴结切除活检。术中冰冻切片病理检测结果提示左腋窝淋巴结反应性增生。术后病理检测结果提示淋巴组织反应性增生。术后继续口服他莫昔芬治疗,目前恢复良好,正常随访中。
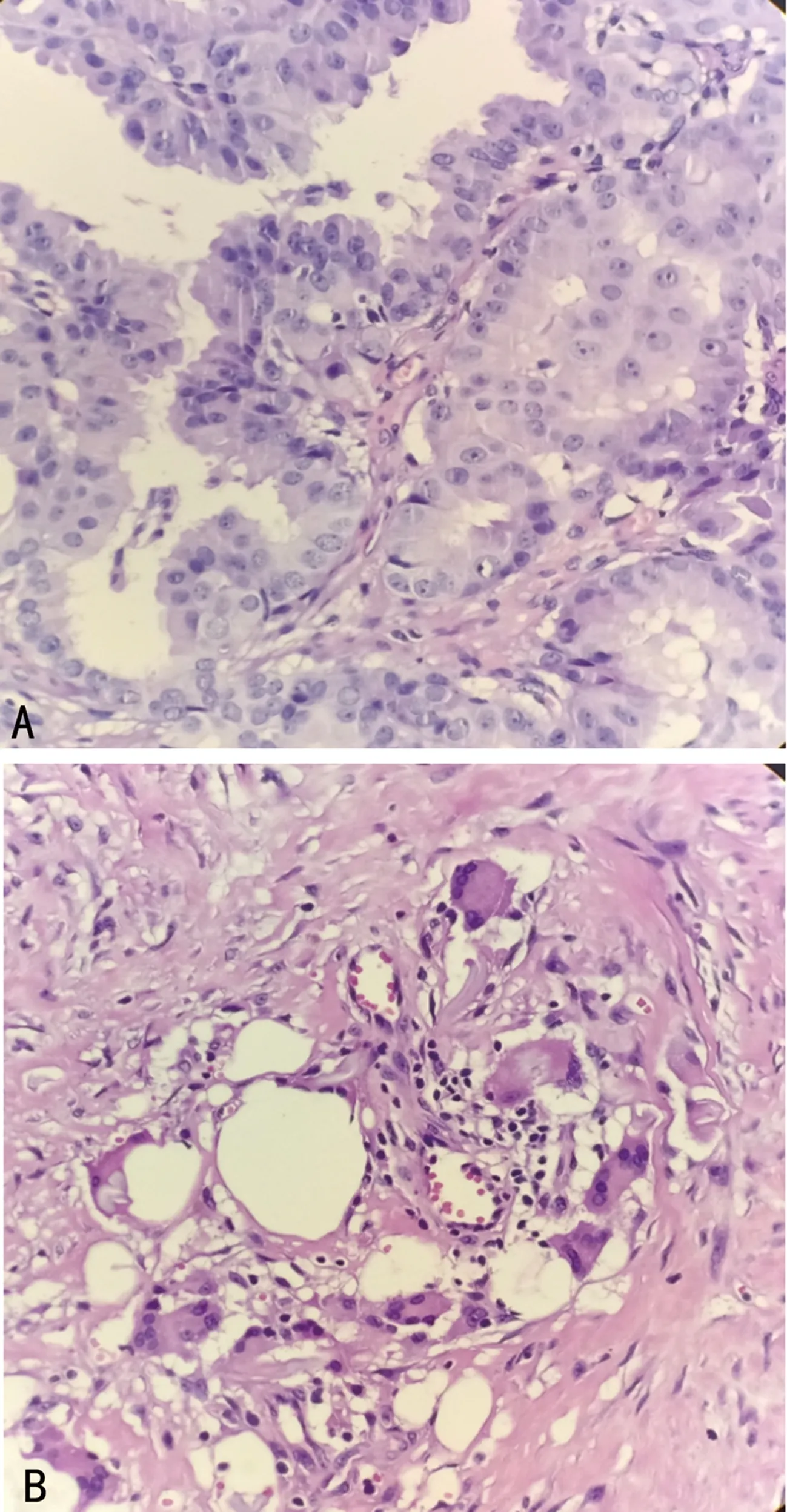
注:A为肿瘤具有膨胀性浸润的组织学特征,与周围组织有明显界限,通过一个宽基底附着于囊壁,乳头数量明显增多,大小形态不同,上皮成分明显超过间质,增生成分仅为肿瘤性上皮细胞;B为以小叶为中心的GM,主要细胞成分是上皮细胞、多核巨细胞、中性粒细胞。
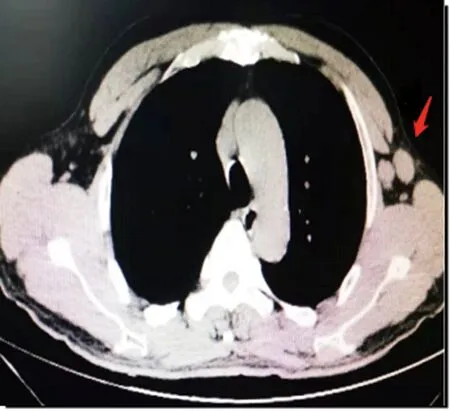
注:左侧腋窝可见两枚肿大淋巴结,表面欠光滑,质地欠均匀,可疑融合,最大约为2.0 cm×1.8 cm。
2 讨 论
2.1病因和危险因素 EPC是一种非常少见的乳腺癌,可能与内分泌因素、遗传因素、营养状态等相关。GM病因不清,可能与自身免疫反应、乳汁超敏反应、棒状杆菌感染、口服避孕药等相关。也有病例报道慢性GM可能是乳腺癌的癌前病变,并且很难区分二者[4]。有乳腺炎病史的女性患乳腺癌的风险略有增加,但也没有发现炎症和乳腺癌发展之间的因果关系[5]。非哺乳期乳腺炎作为非炎症性乳腺癌或导管原位癌(DCIS)的表现是罕见的,这些病例的真实发生率尚不清楚,但有研究证实,高达1.81%的非哺乳期乳腺炎女性最终可在乳腺炎1年后发展为非炎症性乳腺癌,癌灶可能位于炎症病变的远处,非哺乳期乳腺炎可能是乳腺癌的一个危险因素[6]。本病例中,患者为1例62岁老年男性,有乳头增大表现,无慢性疾病病史及免疫性疾病病史,无口服药物病史,所以无典型的病因及危险因素。
2.2临床病理特征与发病机制 男性EPC患者常见的临床表现多为乳晕区无痛性包块,部分患者有乳头溢液、乳头回缩或皮肤溃疡等表现。GM患者常无诱因出现疼痛性包块,病变多为单侧,乳腺外上象限出现包块,位于乳腺实质内,无痛或轻微疼痛,肿块质硬,边界不清,可合并同侧腋窝淋巴结肿大,部分患者合并下肢红斑等风湿免疫性疾病。本研究中病例以乳腺乳晕区肿块为主要表现,偶有刺痛表现。符合男性乳腺癌合并GM的表现,与文献报道相符[2-3]。
男性EPC发病年龄更大,肿瘤分级、分期更高,雌激素受体阳性比例更高,愈后较好。通常ER、PR阳性,Her2阴性,免疫组化法检测肌上皮细胞标志物(calponin、P63、SMMHC)结果提示乳头状病变的周围无肌上皮包绕。GM的病理特点多表现为以小叶为单位的慢性炎症反应,以淋巴细胞为主,可见少量浆细胞,提示出现肉芽肿反应。本研究中病例病理特征为乳腺导管内乳头状瘤伴部分导管上皮不典型增生,不能排除导管原位癌形成。免疫组化法检测结果提示:EPC(核低、中级别),CK5/6(-)、P63(-)、 calponin(-)、CK8/18(+)、 ER(80%+++)、PR(50%+)、Her-2(+)、Ki-67(15%+)。术后病理检查结果显示:合并左乳腺病伴GM,间质纤维及胶原纤维组织增生。本病例具有典型的EPC合并GM的典型病理特征。
GM和乳腺癌的并发引起了关于乳腺炎、感染和乳腺癌之间关系的经典和广泛的讨论。 有人提出了炎症和慢性感染可能与乳腺癌有关的理论。尽管有乳腺炎病史的女性患乳腺癌的总体风险似乎略高,但炎症和肿瘤病变发展之间的因果关系尚未得到很好的证实[2,7]。国内外报道大约15%的微生物感染与癌症有关。小鼠乳腺癌病毒可引起跨物种感染,且可引发乳腺癌[8]。可能是宿主的防御机制在应对有害微生物的感染时产生自由基,自由基通过氧化应激和DNA碱基的置换作用导致DNA损伤,引起细胞发育不良,并发展为癌症。高级别DCIS与围绕导管管腔的肌上皮细胞层和基底膜的损伤有关[9]。DCIS的非典型表现为乳腺炎可能与DCIS内坏死区域的反复感染有关[10]。
2.3诊断和鉴别诊断
2.3.1男性乳腺癌合并GM的诊断和鉴别 MBC的诊断主要依据临床表现、乳腺X线钼靶或乳腺彩超及空心针穿刺组织病理学检查。最终确诊需要组织病理学检查,同时进行免疫组化法检测(ER、PR、HER-2等),根据患者情况选择其他辅助检查,排除其他疾病,确定肿瘤临床分期。GM超声图像表现为弥漫性低回声区域、混合性包块或均质结节型包块。GM的X线检查影像表现缺乏特异性,可为边界不清或不对称的致密影,或表现为毛刺样浸润,腺体结构扭曲。动态增强磁共振成像在临床非炎症肉芽肿性小叶乳腺炎和非钙化导管原位癌鉴别中有一定的优势[11]。患者血清白细胞介素(IL)-22和IL-23水平在特发性GM中显示出异常,提示IL-22和IL-23可能是特发性肉芽肿性乳腺炎(IGM)自身免疫性病因学的新发现,有利于鉴别乳腺癌[12]。术前C反应蛋白、清蛋白、纤维蛋白原(Fib)、Fib/Alb、白细胞计数、中性粒细胞、血小板淋巴细胞比值、单核细胞和2 h红细胞沉降率有相当大的潜力成为炎症引起的IGM的早期和敏感的生物标志物。这些参数对疾病的复发也有明显影响,提示它们可能作为鉴别诊断乳腺癌和IGM的实用指标[13]。剪切波弹性成像(SWE)在鉴别IGM与乳腺癌时具有较高的灵敏度和特异度,且IGM的SWE评分和剪切波速(Vs)值较低。在临床实践中采用这种方法可以减少不必要的活检[14]。本例患者血清学指标及肿瘤标志物均未见特殊异常,影像学检查缺乏特异性表现,诊断主要依靠病理组织学检查和免疫组化法检查结果。
2.3.2其他乳腺肿块的鉴别诊断 (1)男性乳腺发育症是由于各种原因引起的男性体内雌激素和雄激素比例失调,乳腺导管组织、间质或脂肪增多而导致男性乳房体积增大的疾病,表现为双侧或单侧的乳腺乳房结节状或盘状增生、肥大,大部分患者可自行消退,大多数患者表现为特发性男性乳房畸形,预后良好。(2)导管周围乳腺炎(PDM)是一组发生在非哺乳期病原学依据不明的非特异性炎症或病原学明确的特异性炎症,指乳腺导管扩张,且扩张后期大量浆细胞浸润的慢性乳腺非细菌性炎症。临床特征表现为伴有或不伴有相关肿块的乳晕周围炎症、乳晕周围脓肿和乳腺导管瘘管,确诊需手术活检[15]。(3)导管内乳头状瘤是由于卵巢内分泌失调、雌激素分泌过多引起的发生在乳腺导管上皮的良性肿瘤,具有恶变潜能,导管上皮细胞可发生不同程度的增生,细胞无异型性。导管乳头状瘤可发生在各级导管,主要表现为乳头溢液、乳腺肿块,被认为是癌前病变,恶变率为5%~12%,彩超结合病理可确诊。(4)导管内乳头状癌指乳腺导管内乳头状瘤合并早期原位癌,病变局限于乳腺导管或腺泡内,未突破基底膜,临床以乳头溢液为主要表现,病变累及管腔周围肌上皮细胞,EPC的管腔周围无肌上皮细胞。肌上皮细胞标记物(p63、平滑肌肌球蛋白重链、CD10、calponin等)可用于鉴别[16]。(5)浸润性乳头状癌是一种罕见的恶性乳头状乳腺肿瘤,当浸润性病灶出现在纤维包膜时,可以确诊为浸润性癌,P63蛋白和肌球蛋白重链等肌上皮细胞标记物阴性,Ki-67指数、腋窝转移、PR和HER2表达及病理特征等有特异性[17]。
2.4治疗
2.4.1手术治疗 手术治疗是MBC的主要手段。随着乳腺癌综合治疗研究的不断深入,诊疗技术的不断提高,外科治疗模式发生了很大的变化。乳房切除联合前哨淋巴结活检是MBC的标准治疗模式,国外亦有较多男性乳腺癌保乳的案例[18]。如有高危风险的患者,也可进行改良根治术,肿瘤与胸壁粘连,也可进行根治或扩大根治术,配合放化疗、内分泌治疗。肿块型GM的手术没有固定的手术方案,以彻底切除病灶为原则,病变广泛者术前可以使用类固醇激素治疗以缩小病变,手术切除病灶,减少复发。部分脓肿或窦道型炎症较为顽固,需用抗结核棒状杆菌治疗或氨甲蝶呤治疗,亦有报道顽固复发的GM采用阿达莫单抗靶向治疗有效[19]。本研究中这一罕见病例采用左侧乳腺切除、左侧前哨淋巴活检术,术后辅助他莫西芬治疗,术后未复发转移。
2.4.2辅助化疗 随着乳腺癌是全身性疾病的观念逐渐被接受,临床逐渐达成共识,即规范的辅助化疗有助于降低乳腺癌复发转移风险。由于MBC发病率低,大样本的随机对照研究可能性较小,目前治疗原则仍借鉴女性乳腺癌的治疗指南。蒽环类药物联合他莫昔芬辅助治疗能有效提高无病生存期(DFS)和总生存期(OS),辅助化疗对于有内脏危象、肿瘤快速生长、淋巴结阳性和分化差的患者可能更能获益[20-21]。
2.4.3辅助放疗 放疗是降低乳腺癌局部复发的重要手段。参照女性乳腺癌治疗原则,当腋窝淋巴结阳性,肿瘤最大径大于5 cm,切缘阳性时推荐进行放疗。MBC分子分型以Luminal A型及Luminal B型为主,根据分子分型选择对腋窝淋巴结转移患者进行放射治疗,以提高疗效,避免或减少无效治疗和过度治疗。辅助低分割放疗和激素治疗能明显改善MBC患者的DFS和OS[22]。
2.4.4内分泌治疗 MBC治疗中内分泌治疗尤为重要,目前推荐单独采用内分泌治疗或联合其他治疗手段。对于大部分ER阳性的MBC,他莫西芬是研究最多、疗效最确切的一种非类固醇类抗雌激素药物,适用于任何年龄的患者,可明显提高DFS和OS。对于局部复发或远处转移的MBC患者,他莫昔芬已作为首选的内分泌治疗药物[23]。目前对芳香化酶抑制剂研究有限,联合药物去势或睾丸切除可能会获得更好的效果。本研究中病例术后口服他莫西芬近两年,耐受性良好,目前愈后良好。
尽管男性EPC病理特征各异,男性EPC患者预后较好[24],合并GM,仍需定期复查,术后出现腋窝淋巴结肿大,临床特征与乳腺癌术后腋窝淋巴结转移相似,不一定是癌转移,仍可能是炎症。术后腋窝淋巴结肿大空心针穿刺和切除活检是明确病变性质的主要手段。本研究中病例是目前国内第一例报告男性EPC合并GM的病例。对于有IGM背景的乳腺癌患者,必须谨慎鉴别和诊断。由于IGM的慢性进展或同时合并乳腺癌,必须同时进行临床、放射和病理检查。在未来几年,期待多基因检测技术的改进,可以更精确地预测复发的风险,这可能会导致治疗的选择和时间发生重大变化[25]。
