不同厂家盐酸坦索罗辛缓释胶囊释放曲线对比研究
2023-11-28彭潇波侯代松王小丽黄仲义
彭潇波 侯代松 王小丽 黄仲义
(1. 深圳万和制药有限公司 广东深圳 518107;2. 上海市静安区中心医院 上海 200040)
盐酸坦索罗辛缓释胶囊是一种肾上腺素α1受体阻滞剂,可松弛前列腺和膀胱颈部的平滑肌,促进膀胱排空,改善良性前列腺增生症所致的排尿困难等症状[1-2]。在40岁以上的男性中,前列腺增生的发生率为15%~60%;从40 岁到79 岁,其患病率每10 年增加10%[3-4]。临床上,盐酸坦索罗辛缓释胶囊还可以治疗原发性早泄[5-6]、泌尿系统结石[7]以及预防术后尿潴留[8]。
我们采用已通过或视同通过一致性评价的盐酸坦索罗辛缓释胶囊进行了释放曲线测定和对比。考察了6 个厂家(1 个原研厂家,5 个仿制药厂家)共8 批样品在4种不同释放介质(pH 1.2 盐酸溶液、pH 4.0 磷酸盐缓冲溶液、pH 6.8 磷酸盐缓冲溶液和水)中的释放曲线,以评价不同厂家产品体外释放行为的差异,为其质量控制及进一步的疗效评价提供参考。
1 材料和方法
1.1 仪器
Sotax AT 7 Smart 离线全自动溶出仪(瑞士Sotax公司);BSA224S 型电子天平(德国赛多利斯公司);MS105 型电子天平(梅特勒托利多有限公司);e2695 型高效液相色谱仪(美国沃特斯公司)。
1.2 试药
盐酸坦索罗辛对照品(批号100688-201102,中国食品药品检定研究院)、参比制剂[批号W4001,安斯泰来制药(中国)有限公司]、市售产品1 ~4(分别为A、B、C、D 企业产品)、自研产品(批号190801、190802、190901,深圳万和制药有限公司);乙腈为色谱纯,其余试剂均为市售分析纯。
1.3 分析方法
1.3.1 色谱条件
采用Diamonsil C18色谱柱(4.6 mm×150 mm,5 µm);流动相为乙腈-高氯酸盐溶液(取高氯酸8.7 mL 和氢氧化钠3 g,加水1 900 mL 溶解,用1 mol/L 的氢氧化钠溶液调节pH 至2.0,加水至2 000 mL)(34 ∶66);流速1 mL/min;柱温40 ℃;检测波长225 nm;进样量100 µL。
1.3.2 溶液的配制
1)pH 1.2 盐酸溶液 称取氯化钠2.0 g,量取盐酸7 mL,加水至1 000 mL,并调pH 至1.2。
2)pH 4.0 磷酸盐缓冲液 称取十二水合磷酸氢二钠6.715 g,一水合柠檬酸3.282 5 g,加水1 L 溶解,混匀,用0.025 mol/L 柠檬酸溶液调pH 至4.0。
3)pH 6.8 磷酸盐缓冲液 称取磷酸二氢钾6.8 g,加水882 mL 溶解,加入0.2 mol/L 氢氧化钠118 mL 溶液,混匀即得。
4)对照品溶液 精密称量盐酸坦索罗辛对照品(于105 ℃干燥2 h)25 mg,置50 mL 容量瓶中,加水-乙腈(7 ∶3)溶液溶解并稀释成0.5 mg/mL 的溶液,摇匀,量取适量加pH 1.2 盐酸溶液稀释成0.4 µg/mL 的对照品溶液。
1.3.3 线性范围
1)pH 1.2 盐酸线性溶液 精密量取对照品溶液0.2、0.4、0.8、1.2、1.6、2.0 mL,分别用pH 1.2 的盐酸溶液稀释至25 mL,摇匀,进样分析。以浓度(x)为横坐标,以峰面积(y)为纵坐标作线性回归处理,线性方程为y=228 544.28x-781.67,r=1.000(n=6)。
2)其他3 种释放介质线性溶液 精密移取对照品溶液1.0、2.0、2.0、3.0、2.0 mL,分别置于250、100、50、50、25 mL 容量瓶中,分别用pH 6.8 磷酸盐缓冲液、pH 4.0 磷酸盐缓冲液以及水3 种释放介质稀释定容至刻度,进样分析。以浓度(x)为横坐标,以峰面积(y)为纵坐标,作线性回归,得回归方程。在pH 6.8 磷酸盐缓冲液中y=207.81x+0.216 3,r=0.999 9(n=5);在pH 4.0 磷酸盐缓冲液中y=214.933 3 x+0.231 8,r=1.000 0(n=5);在水中y=200.733 9 x+0.528 5,r=0.999 1(n=5)。
1.3.4 累计释放量测定方法
根据《普通口服固体制剂溶出曲线测定与比较指导原则》[9]及前期在各介质中的释放量检测结果,确定了样品在各介质中的溶出结束时间点。pH 1.2 盐酸溶液中为2 h,pH 6.8 磷酸盐缓冲液中为6 h,pH 4.0 磷酸盐缓冲液和水中为24 h。
取样品12 粒,按中国药典2020 年版(四部)通则0931 第二法(桨法)操作,转速50 r/ min,温度37 ℃,溶出介质体积900 mL,自动取样,取样体积为10 mL,同时,补充37 ℃的相应释放介质10 mL。进样测定,记录色谱图。按外标法以峰面积计算每粒的释放量。
1.3.5 不同释放介质中相似因子比较
根据国家药品审评中心发布的《普通口服固体制剂溶出曲线测定与比较指导原则》[9],溶出曲线相似性的比较,多采用非模型依赖法中的相似因子(f2)法。计算公式如下:
Rt为t 时间参比样品平均溶出量;Tt为t 时间受试样品平均溶出量;n为取样时间点的个数。
采用f2法比较释放曲线相似性时,一般情况下,当两条释放曲线f2数值≥50 时,可认为释放曲线相似;f2越趋于100,释放曲线相似性越好。
2 结果
2.1 已上市仿制药在不同介质中的释放量
对目前已通过一致性评价或视同通过一致性评价的4 个厂家产品进行了4 种介质中的释放量测定,结果显示,各企业产品在pH 6.8 磷酸盐缓冲液介质中的释放曲线和参比制剂相似,在其他3 种介质中,A 企业产品的释放曲线和参比制剂相似,而B、C、D 企业产品在某一种或者2 种介质中的释放曲线和参比制剂存在差异(图1)。
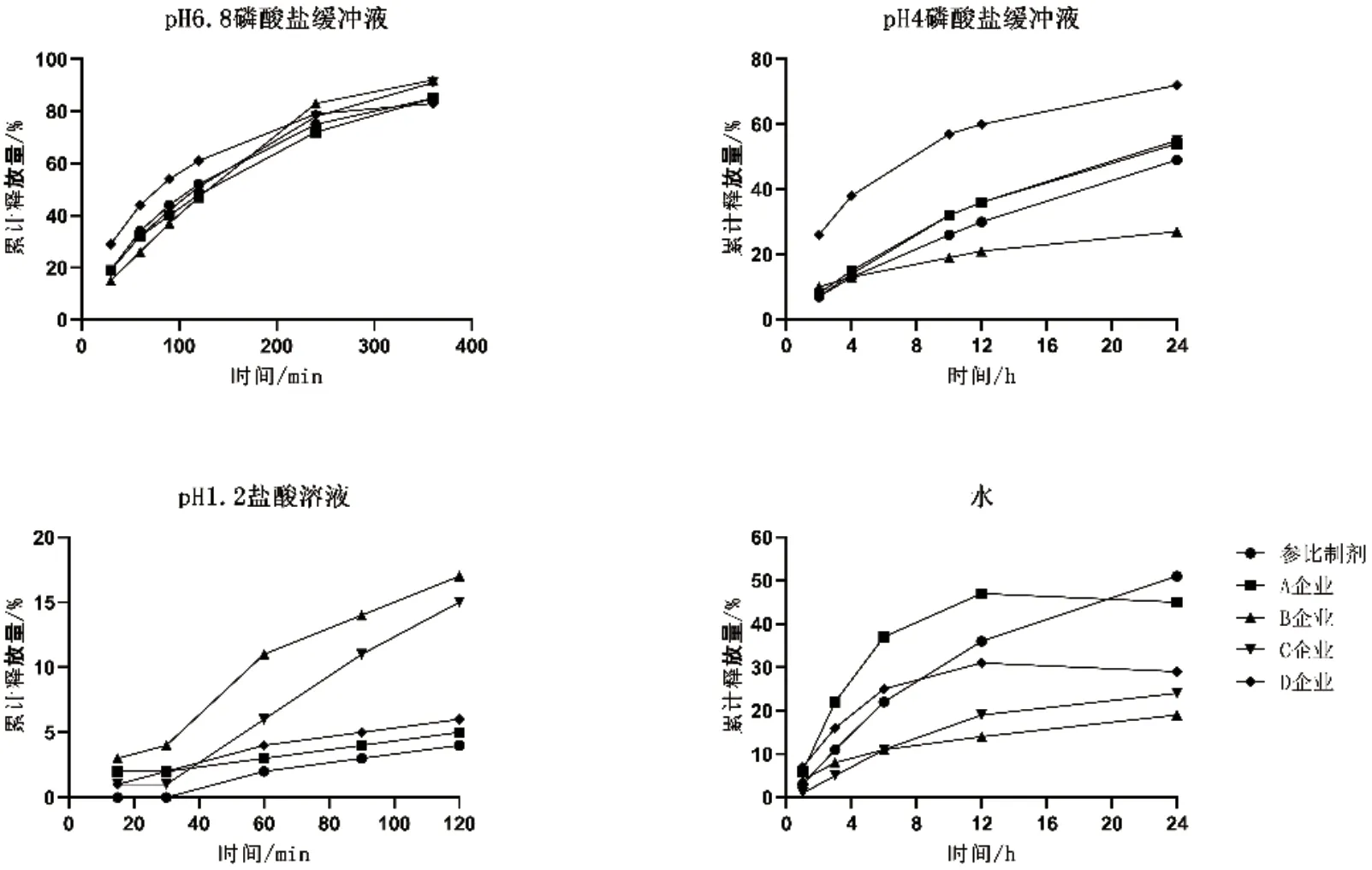
图1 4企业产品与参比制剂在不同介质中的释放量
2.2 自研产品在不同介质中的释放量
选取了已通过生物等效实验(BE)的自研商业规模的3 批产品(批号分别为190801、190802、190901)进行释放量测定,结果显示,他们在4 种介质中的释放曲线与参比制剂相似(图2)。
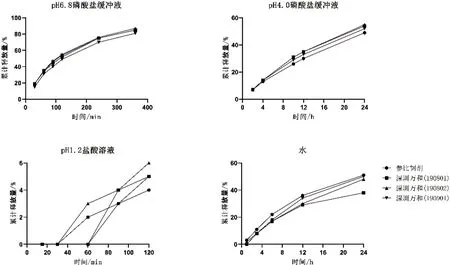
图2 自研产品与参比制剂在不同介质中的释放量
2.3 不同生产厂家与参比制剂在不同释放介质中相似因子
采用f2法比较释放曲线相似性,结果显示,A 企业生产的产品在4 种介质中均与参比制剂相似(f2≥50),在水中的f2刚好50。C 企业生产的产品在除水以外的3种介质中的f2与参比制剂相似。B 和D 企业产品仅在2种介质(pH 6.8 磷酸盐缓冲液和pH 1.2 盐酸溶液)中的f2与参比制剂相似。此外,B 和C 企业产品虽然在pH 1.2 盐酸溶液中的f2显示相似,但其2 h 累计释放量明显高于参比制剂(图2)。深圳万和制药有限公司连续生产的3 批产品,在4 种介质中的释放曲线与参比制剂相似,且f2较高。不同生产厂家产品与参比制剂在不同释放介质中f2结果见表1。

表1 不同厂家产品和参比制剂在不同释放介质中的f2比较
3 讨论
日本医药品医疗器械管理局(PMDA)在日本的一致性评价过程中提出了在4 种不同溶出介质中根据溶出行为绘制溶出曲线,并计算溶出度f2,以此来评价普通口服固体制剂仿制药与原研药是否具有相似的生物利用度[10]。国内有学者也认为溶出度试验是评价口服固体制剂内在质量的一种科学手段和方法[11-13]。可用于判断药品体内生物利用度的高低、是否生物等效,也可以揭示各制剂工艺的差别。缓控释制剂的释放曲线在一定程度上能体现制剂在患者体内的释放情况以及血药浓度,体外的释放曲线可能和体内的血药浓度呈一定的相关性。有一项临床研究报道,盐酸坦索罗辛的治疗效果可能与谷浓度而不是峰浓度或总暴露量更相关[14]。因此,盐酸坦索罗辛缓释胶囊释放曲线的差异与临床疗效的相关性有待进一步探索。
深圳万和制药有限公司连续生产的3 批产品,在4种介质中的释放曲线均与参比制剂相似,且f2较高,说明其释药机制与参比制剂相同。A、B、C 与D 企业生产的产品为市售的产品,A 企业生产的产品在4 种介质中的释放曲线均与参比制剂相似,说明其释药机制与参比制剂相同;B、C 与D 企业生产的产品在某些介质中释放曲线与参比制剂存在差异。这些差异可能是其释药机制与参比制剂存在不相同所致。
通过以上对比实验发现,不同厂家盐酸坦索罗辛缓释胶囊的释放行为有很大差异,继续探索释放曲线与临床疗效的相关性极为必要。
