Drebrin蛋白抑制剂BTP-2对猪伪狂犬病病毒增殖的影响
2023-11-27王世平王金圆李昕蔓杨国宇潘佳佳
王世平,王金圆,李昕蔓,唐 婷,杨国宇,潘佳佳
(河南农业大学 农业农村部动物生化与营养重点实验室 河南省动物生长发育调控重点实验室,河南 郑州450002)
猪伪狂犬病是由猪伪狂犬病病毒(pseudorabies virus,PRV)引起的一种急性传染病,多种家畜和野生动物均可感染,以猪感染最为普遍。该病在我国也广泛存在,给养猪业造成了巨大的经济损失[1]。PRV属于疱疹病毒科、猪疱疹病毒属,为有囊膜的线性双链DNA病毒,经常被用于疱疹病毒的分子生物学特征以及疱疹病毒性疾病的研究[2]。PRV能在多种组织培养细胞内增殖,其中以猪肾和兔肾细胞最为敏感,可以引起明显的细胞病变。PRV编码11种糖蛋白,分别是gE、gI、gD、gG、gL、gM、gH、gC、gB、gN和gK,其中gB糖蛋白是病毒囊膜的主要成分之一,在PRV感染宿主的过程中有着重要的作用[2-3]。gB蛋白对PRV复制至关重要,它不仅参与病毒吸附和进入宿主细胞,也是PRV重要的中和抗原,能够刺激机体产生病毒特异性体液免疫和细胞免疫反应;此外,gB基因与病毒的毒力有关,gB基因缺失的PRV由于丧失穿透能力而失去感染性[4]。因此,gB基因和蛋白的表达量变化能够反映PRV的增殖情况。
真核细胞的细胞骨架主要包括微丝、微管和中间丝。微丝是由肌动蛋白单体(G-actin)形成的多聚体,也称为纤维性肌动蛋白(F-actin)。除参与调控生物学过程外,肌动蛋白及其结合蛋白在病毒吸附、进入、组装、释放等生命活动中也发挥重要作用[5-6]。在病毒与宿主细胞相互作用的研究中发现,多种病毒如疱疹病毒、腺病毒、黄热病毒、痘病毒、流感病毒及狂犬病毒等利用微丝及其结合蛋白入侵宿主细胞并完成其增殖过程[7-12]。发育调节脑蛋白(developmentally regulated brain protein,Drebrin)是一种微丝结合蛋白[13-14]。Drebrin 蛋白包含5个结构域,分别是N 端肌动蛋白解聚因子同源结构域、卷曲螺旋域(coiled-coil,CC)、螺旋域(helical domain,Hel)、脯氨酸富集区域和C末端[15]。Drebrin蛋白通过2个螺旋域协同结合F-actin[13,15-16]。研究发现,Drebrin蛋白可通过与病毒蛋白相互作用、重排微丝细胞骨架,从而调控病毒的感染过程。轮状病毒的VP4蛋白可与Drebrin结合,抑制轮状病毒进入宿主细胞。利用化学抑制剂、siRNA 沉默、CRISPR 敲除技术阻断Drebrin蛋白的功能,增强轮状病毒感染,而且Drebrin是通过调控发动蛋白依赖的内吞过程从而参与轮状病毒的入胞过程[17]。另外,在HIV病毒感染宿主细胞时,Drebrin蛋白被募集到病毒囊膜糖蛋白中,并通过调节细胞骨架微丝的动态重组和其结合蛋白Profilin的表达从而调控病毒的感染[18]。宿主细胞骨架微丝存在于PRV病毒粒子中,推测微丝可能参与PRV的生活周期[19],但是微丝结合蛋白Drebrin是否参与PRV的感染过程及其分子机制并不清楚,本研究主要采用Drebrin抑制剂BTP-2阻断其功能,检测猪肾上皮细胞PK-15内PRV感染量变化情况,以初步判定Drebrin蛋白是否参与PRV增殖,为进一步研究PRV 感染的分子机制奠定基础。
1 材料与方法
1.1 细胞与病毒毒株猪肾上皮细胞PK-15、PRV-HN1201、PRV-GFP由本实验室保存。
1.2 主要试剂DMEM高糖细胞培养基(10566-016)、胎牛血清 FBS(10099-141C)、双抗PS(15140122)购自 Gibco 公司; BTP-2 (HY-100831)购自 MCE公司;PRV病毒猪源gB单克隆抗体由本实验室制备;Drebrin抗体(67589-1-Ig)、GAPDH抗体(60004-1-Ig)购自Proteintech公司;CCK-8(40203ES60)购自YEASEN公司;荧光定量试剂SYBR Green(7E503H1)购自Vazyme公司;RNAiso Plus购自宝日生物技术(北京)有限公司。
1.3 药物配制及细胞活力检测BTP-2用DMSO溶解为 10 mmol/L,-80℃冻存。将PK-15细胞以104/孔铺至96孔板中,37℃细胞培养箱培养12 h 后,将药物用10%FBS的DMEM培养基稀释后以0,20,60,200,600 nmol/L 的浓度梯度加入细胞,37℃孵育培养 24 h,加入 10 μL的CCK-8,37℃条件下培养 4 h,450 nm波长测吸光度值。数据采用以下公式计算:
细胞活力=(D加药-D空白)/(D0加药-D空白) ×100%;
D加药:具有细胞、CCK-8溶液和药物溶液的孔的吸光度值;
D空白:具有培养基和CCK-8溶液而没有细胞的孔的吸光度值;
D0加药:具有细胞、CCK-8溶液而没有药物溶液的孔的吸光度值;
细胞活力:细胞增殖活力或细胞毒性活力。
1.4 荧光观察及流式细胞术24孔板中以2.5×105/孔接种PK-15细胞,待细胞汇合度达40%左右时,将药物用10%FBS的DMEM培养基稀释后以0,20,60,200,600 nmol/L的浓度梯度加入细胞,37℃孵育培养 4 h。弃去原培养基,PBS清洗2遍,以感染复数MOI=0.01感染PRV-GFP株,37℃孵育1 h,弃去原培养基,PBS清洗2遍,加入维持培养基稀释后的药物继续培养24 h,用荧光倒置显微镜观察细胞形态以及荧光情况并拍照。与此同时,收集细胞并进行流式检测。
1.5 实时荧光定量PCR6孔板中以1×106/孔接种PK-15细胞,待细胞汇合度达50%左右时,将药物用10%FBS的DMEM培养基稀释后以0,20,60,200,600 nmol/L的浓度梯度加入细胞,37℃孵育培养 4 h。弃去原培养基,PBS清洗2遍,以感染复数MOI=0.01接种PRV-HN1201株,37℃孵育1 h,弃上清,PBS清洗2遍,加入维持培养基稀释的药物继续培养24/36 h,收集细胞,利用TRIzol提取总RNA,并反转录合成cDNA,利用荧光定量PCR引物进行扩增。试验所使用PRV-gB、Drebrin以及内参基因 GAPDH 上、下游引物如下:PRV-gB-F:5′-GGCATCGCCAACTTCTTCC-3′,PRV-gB-R:5′-CCTCGTCCACGTCGTCCTC-3′。Drebrin-F:5′-TTGCCCAGCGACCTGATAAC-3′,Drebrin-R:5′-TATGAAAGGGCAGTACGGACG-3′。GAPDH-F:5′-GAAGGTCGGAGTGAACGGAT-3′,GAPDH-R:5′-CATGGGTAGAATCA-TACTGGAACA-3′。PCR 反应体系(10 μL):SYBR Green Mix 5 μL,上、下游引物各0.4 μL(终浓度0.8 μmol /L),模板 cDNA 1.5 μL,ddH2O 2.7 μL。反应条件:95℃预变性2 min;95℃变性15 s;60℃退火20 s;72℃延伸20 s,40个循环。将得到的Ct 值采用 2-ΔΔCt进行计算分析。
1.6 Western blot将PK-15细胞以1×106/孔铺至6孔板中,37℃细胞培养箱培养12 h后,将BTP-2用10%FBS的DMEM培养基稀释后以0,20,60,200,600 nmol/L的浓度梯度处理细胞,37℃孵育4 h,接毒 MOI=0.1的PRV-HN1201,置37℃吸附1 h,用PBS溶液清洗3次,加入维持培养基稀释的药物继续培养24 h,RIPA 裂解液裂解,收集细胞总蛋白,制样进行SDS-聚丙烯酰胺凝胶电泳,转膜后用5%脱脂奶粉封闭1 h,一抗Anti-PRV-gB 4℃过夜,二抗室温孵育1 h,然后进行ECL,以GAPDH作为内参。
1.7 病毒PFU检测将PK-15细胞以 1.5×105/孔铺至 12 孔板中,37℃细胞培养箱培养12 h后,将BTP-2用10%FBS的DMEM培养基稀释后以0,20,60,200,600 nmol/L的浓度梯度处理细胞,37℃下孵育4 h,接毒 MOI=0.1的PRV- HN1201,置37℃吸附1 h,用PBS溶液清洗3次,加入维持培养基稀释的药物继续培养24 h,反复冻融3次收集病毒悬液并做10倍倍比系列稀释,共稀释4次,然后接种于24孔板的单层PK-15细胞上(每孔细胞数量为3×105个),37℃吸附1 h,弃病毒液加入500 μL 1%FBS DMEM继续培养4 d。后弃上清,加入4%PFA室温固定细胞30 min,利用1%结晶紫染色30 min,流水浸洗30 min后可观察到噬斑及未脱落的细胞,倒扣晾干后显微镜下数噬斑数并统计。
1.8 统计学分析所有试验均重复3次,利用GraphPad Prism 8.0.2软件作图和统计学分析,免疫印迹信号强度采用Image J软件进行灰度分析,数据均用¯x±s表示,利用t检验进行显著性分析,**表示P<0.01。
2 结果
2.1 BTP-2处理对PK-15细胞活力的影响小分子药物BTP-2通过抑制Drebrin和F-actin结合,从而阻断Drebrin蛋白功能[17,20-21]。为了研究Drebrin蛋白对PRV增殖的影响,利用BTP-2处理猪肾上皮细胞PK-15,利用CCK-8法检测BTP-2对PK-15细胞活力的影响。结果如图1所示,处理组药物浓度在20~600 nmol/L之间时,吸光度与对照组无显著差异(P>0.05)。故本研究选择20~600 nmol/L作为BTP-2最适药物作用浓度范围。

图1 BTP-2对PK-15细胞活力的影响
2.2 流式细胞术检测PRV-GFP的感染率不同浓度梯度的BTP-2处理PK-15细胞并接种MOI=0.01的PRV-GFP,通过荧光倒置显微镜(40×)观察各组细胞的GFP荧光情况并拍照。结果如图2A所示,与对照相比,GFP阳性细胞明显减少,随着浓度的升高,荧光强度逐次降低。与此同时,收集细胞并利用流式细胞仪检测GFP阳性细胞数量,结果如图2A,B所示,BTP-2药物处理后PRV-GFP病毒感染率显著降低(P<0.01),并随着药物浓度的升高而降低,呈药物浓度依赖性变化。

A.荧光显微镜(40×)和流式细胞术检测PRV—GFP增殖情况;B.A图的流式统计结果;**表示差异极显著(P<0.01)。下同
2.3 实时荧光定量PCR检测基因水平PRV感染量在细胞培养板中铺适宜浓度的PK-15细胞,37℃过夜培养后弃掉上清液,加入不同浓度梯度的BTP-2,37℃处理4 h,接毒MOI=0.01的PRV-HN1201 37℃吸附1 h,弃掉上清,加入含有相应药物的维持培养基继续培养24 h,收集细胞并提取总RNA,以实时荧光定量PCR方法检测PRV-gB和Drebrin基因表达量,结果如图3所示,相比对照组,BTP-2处理细胞后PRV-gB和Drebrin基因表达量显著降低(P<0.01),并呈剂量依赖性。

1.PRV-gB基因的表达情况;B.Drebrin基因的表达情况
2.4 Western blot检测蛋白水平PRV感染量在细胞培养板中铺适宜细胞数量PK-15细胞,37℃过夜培养后弃掉上清液,加入不同浓度梯度的BTP-2 37℃处理4 h,接毒MOI=0.1的PRV-HN1201 37℃吸附1 h,弃掉上清,加入含有相应药物的维持培养基继续培养24 h,收集细胞总蛋白,以Western blot方法检测PRV-gB和Drebrin蛋白表达情况,结果如图4所示,与对照组相比,BTP-2处理细胞后PRV-gB和Drebrin蛋白表达量显著降低(P<0.01),检测结果与基因水平一致,结果表明BTP-2处理抑制了PRV增殖。
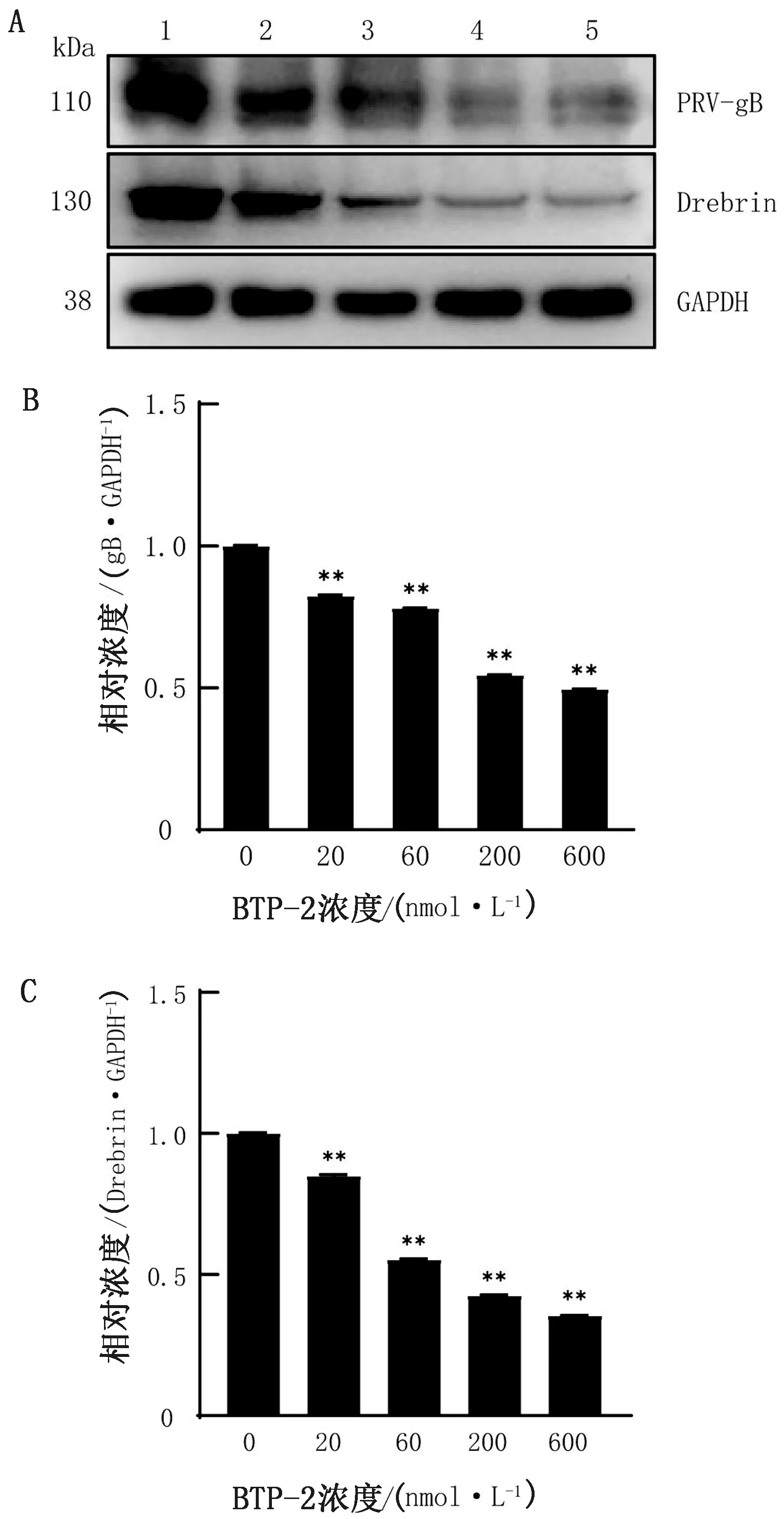
A.Western blot检测PRV-gB、Drebrin和GAPDH蛋白的表达; B,C.为Image J软件对图A进行灰度值分析;1~5.BTP-2浓度梯度
2.5 PFU法检测子代病毒滴度PK-15细胞加入不同浓度梯度的BTP-2 37℃处理4 h,接毒MOI=0.1的PRV- HN1201 37℃吸附1 h,弃掉上清,加入含有相应药物的维持培养基继续培养24 h,反复冻融收集子代病毒,利用噬斑法进行病毒滴度测定。结果表明,BTP-2处理细胞后PRV子代病毒滴度显著降低(P<0.01),表明BTP-2抑制子代病毒的产生(图5)。

图5 PFU法检测PRV- HN1201子代病毒滴度
3 讨论
猪伪狂犬病是由PRV引起神经系统障碍的一种传染病,目前研究主要集中在其致病性及检测方法,但PRV增殖过程的分子机制研究仍不够充分。因此,研究PRV与宿主细胞相互作用的分子机制,有助于了解PRV的感染过程,进而为PRV感染的防控提供理论依据。本研究通过化学药物处理PK-15细胞,研究宿主细胞骨架微丝结合蛋白Drebrin的抑制剂BTP2对PRV增殖的影响。
细胞骨架是真核细胞中的蛋白纤维网状体系,主要包括微丝、微管、中间丝。病毒是专性细胞内病原体,其生活周期主要包括病毒识别并吸附宿主细胞、病毒穿入与脱衣壳、基因组复制和核衣壳装配、囊膜形成、病毒颗粒成熟及释放等,这一过程涉及到的细胞信号转导、胞吞作用、免疫逃逸、胞内运输等过程直接或间接依赖于细胞骨架[5-6,22-23]。肌动蛋白是真核细胞中最丰富的细胞骨架蛋白,在细胞中肌动蛋白的聚合和解聚以及形成功能更高的网络组织都受到大量微丝结合蛋白的调节[24]。作为肌动蛋白结合蛋白之一,早期研究发现Drebrin蛋白主要在脑组织表达,通过调控微丝重组从而参与神经细胞的分化、发育和功能[25-27]。越来越多的研究发现,Drebrin蛋白在其他组织表达并参与免疫调节、精子生成、肿瘤生成等多种生物学功能[28-33]。近10年的研究证明,Drebrin蛋白可通过与病毒蛋白相互作用诱导宿主细胞骨架重排从而调控病毒的感染过程[17-18]。在 HIV 病毒感染期间,Drebrin蛋白被招募到病毒包膜糖蛋白中,通过调控细胞骨架微丝重排和微丝结合蛋白Profilin的积累从而参与HIV感染[18]。另外,Drebrin抑制dynamin介导的胞吞作用从而限制轮状病毒进入宿主细胞[17]。本研究利用Drebrin抑制剂BTP2处理细胞后,PRV子代病毒滴度降低;通过细胞形态学观察和流式细胞术检测,发现PRV感染的细胞数量明显减少;PRV-gB基因和蛋白表达量也明显降低,并呈剂量依赖性,说明BTP-2处理抑制PRV增殖。以上结果表明,Drebrin蛋白参与PRV的感染过程,但是病毒增殖包括吸附、进入、复制及释放等过程,Drebrin在PRV感染的哪个阶段发挥功能及其参与PRV感染的分子机制仍需进一步探究,以期为PRV疫苗研发和抗病毒药物研制提供理论支持。
综上,本研究利用化学药物处理,通过荧光显微镜、流式细胞术、实时荧光定量PCR、Western blot等方法分别从细胞水平、基因水平和蛋白水平,确证BTP-2处理抑制了PRV增殖,表明微丝结合蛋白Drebrin 参与PRV增殖。
