光催化辅酶再生体系与甲醛脱氢酶耦合制备甲醇的可行性研究
2023-11-25董文锦宋晓明陈夫山
董文锦,邓 理,宋晓明,陈夫山*
(1.青岛科技大学 化工学院,山东 青岛 266042;2.中国科学院 兰州化学物理研究所,中国 兰州 730000)
甲醇用作氢 (H2) 能量载体的研究引起了广泛关注,同时甲醇作为生产其他有价值化合物的基础原材料具有广泛的用途[1-2]。在2021年中国十大科技进展中,CO2到淀粉的合成上榜:马延和团队[3]首次报道了在体外无细胞系统中由CO2到淀粉的从头合成,其中,由大连化学物理研究所负责利用化学催化剂光电催化CO2加氢生成C1中间体——甲醇,然后由天津工业生物所建立基于甲醇的10个酶促反应,成功将甲醇生物转化为直链和支链淀粉。然而,传统的二氧化碳加氢生产甲醇需要高温高压的高能耗条件,成本较高。因此,开发在温和条件下生产甲醇的体系是亟需解决的难题,其中将CO2酶催化还原制备甲醇的多酶级联反应是一种很有前景的策略[4]。
在CO2多酶级联反应制备甲醇的过程中,首先是由甲酸脱氢酶 (FDH) 将CO2或碳酸氢根还原为甲酸,然后通过甲醛脱氢酶 (Fald DH) 将甲酸还原为甲醛,最后经醇脱氢酶 (ADH) 将甲醛还原为甲醇。其中,每一步由酶参与的反应都需要消耗化学计量的烟酰胺辅酶NAD(P)H 才能实现催化转化,因此,受到了NAD(P)H 高成本和再生效率低的限制,使得将CO2多酶催化转化为甲醇的效率比较低,成本却非常高[5]。另一方面,甲醛脱氢酶是一种限速酶,它催化逆反应(甲醛氧化制备甲酸)的效率比催化正反应(甲酸还原制备甲醛)效率高得多,在多酶级联反应过程中的催化活性非常低[6]。因此,为了提高CO2多酶级联反应转化中的催化效率,辅酶的原位再生和活性更高的甲醛脱氢酶研究是其中的关键[7]。
在之前的研究中,本课题组借鉴传统氢转移催化反应,构建了新的光催化辅酶再生体系:以甲酸盐作为电子给体,钌络合物Ru(tpy)(biq)Cl2作为光催化剂,成功实现了辅酶NADH 的高效再生,量子产率达7.9×10-3,将这种光催化剂与谷氨酸脱氢酶耦合,实现了模型反应α-酮戊二酸到L-谷氨酸的光控高效转化[8]。
本研究在光催化辅酶再生的基础上,将甲醛脱氢酶引入再生体系,希望能够解决甲酸还原这一具有挑战的反应,从而以甲酸歧化的方式实现高价碳(+2价)向低价碳(-2价)的转化,进而建立C1分子转化的高效催化体系,为二氧化碳利用提供有力工具,也为有挑战的羧基还原反应提供了新思路。不过需要指出的是,将光催化辅酶再生体系与甲醛脱氢酶耦合,未能检出甲醛或甲醇产物。本研究对成功表达并分离纯化得到的甲醛脱氢酶进行了一系列的酶活反应实验,依据实验结果进行了深入的探讨。
1 实验部分
1.1 材料、试剂与仪器
1.1.1 菌株、质粒与酶
本实验所用的菌株、质粒与酶见表1。

表1 菌株、质粒与酶Table 1 Strains,plasmids andenzymes
1.1.2 试剂与仪器
Trans 2K Plus 2 DNA Marker,北京全式金生物技术股份有限公司;PageRuler Unstained Protein Ladder(10~250 k Da),赛默飞世尔科技公司;质粒提取试剂盒Mini Plasmid Kit,美国奥美嘉生物技术公司;Ta KaRa BCA Protein Assay Kit,宝日医生物技术有限公司;蛋白胨,英国Oxoid 公司;酵母粉,英国 Oxoid 公司;异丙基硫代半乳糖苷(IPTG),北京索莱宝科技有限公司;卡那霉素,上海生工生物工程股份有限公司;NADH/NAD+,上海阿拉丁生化科技股份有限公司;PBS磷酸盐缓冲液干粉,北京索莱宝科技有限公司。
蒸汽灭菌器,LDZM-80KCS 型,上海申安医疗器械厂;单人单面净化工作台,SW-CJ-1FD 型,苏州安泰空气技术有限公司;双层恒温摇床,ZHWY-1102C型,上海智城分析仪器制造有限公司;隔水式培养箱,GSP-9080MBE 型,上海博讯实业有限公司;台式冷冻离心机,Allegra X-22 型,美 国Beckman公司;高压破碎仪,40KPSI型,广州艾贝太制药公司;电热恒温水槽,DK-8D 型,上海精宏实验设备有限公司;Spark 多功能酶标仪,瑞士Tecan 公司;气相色谱仪,Agilent8890型,安捷伦科技有限公司;蛋白纯化仪,Bio-Rad NGCTM Chromatography System 型,美国伯乐(Bio-Rad)公司;涡旋振荡器,Vortex Genie 2型,美国Scientific Industries公司;台式离心机,1-14型,德国Sigma公司;水相聚醚砜针式滤器,SCAA-102 型,上海安谱科学仪器有限公司。
1.1.3 溶液及培养基
1)卡那霉素 (Kan,0.05 g·mL-1):称取2 g卡那霉素加入50 mL无菌大离心管中,在超净台加入40 mL dd H2O,混匀,用滤膜过滤2次,分装,标记Kan-日期,-20℃保存,备用。添加到培养基的终浓度一般为50μg·mL-1。
2)异丙基硫代半乳糖苷(IPTG,w/V,20%):称取8 g IPTG 于50 mL 无菌大离心管中,在超净台加入40 mL 纯水,混匀,镊子取出几个2 mL离心管,用水相滤膜将IPTG 溶液滤入,标记IPTG-日期,-20℃保存,备用。
3)LB 液体培养基:胰蛋白胨10 g·L-1,氯化钠10 g·L-1,酵母粉5 g·L-1,水,121℃高温灭菌20 min。
4)LB 固体培养基:LB 液体培养基,琼脂粉20 g·L-1,121℃灭菌20 min。
5)酶的分离纯化缓冲液体系。Bingding Buffer:50 mmol·L-1NaH2PO4,300 mmol·L-1NaCl,20 mmol·L-1咪唑,pH=7.0;Washing Buffer:50 mmol·L-1NaH2PO4,300 mmol·L-1NaCl,50 mmol·L-1咪唑,pH=7.0;Elution Buffer:50 mmol·L-1NaH2PO4,300 mmol·L-1NaCl,500 mmol·L-1咪唑,pH=7.0。将溶液过滤膜,4℃保存备用。
1.2 酶的表达、分离纯化
1.2.1 酶的表达
1)重提质粒:取出培养好的菌液按质粒提取试剂盒步骤提取质粒,使用超微量分光光度计测定质粒浓度分别为120 ng·μL-1(fdh A),106.54 ng·μL-1(fdh A-PA5421),酶切验证后使用。
2)转化:将重组质粒用热击法转化至大肠杆菌感受态细胞,构建重组菌株;
3)表达:使用0.5 mmol·L-1IPTG,16℃诱导20 h;
4)收菌:收集菌体沉淀,Binding Buffer悬浮3次,弃上清,保留菌体沉淀。
1.2.2 酶的分离纯化
将菌体悬浮在Binding Buffer中,用高压细胞破碎仪破碎收集上清,然后用纯化蛋白仪进行蛋白纯化。纯化后的蛋白液用SDS-PAGE、考马斯蓝R-250染色,以确定该蛋白的纯化程度。蛋白液用10 KDa的超滤管浓缩,保存在4℃备用。
1.2.3 酶浓度的测定
利用Ta KaRa BCA Protein Assay Kit进行酶浓度的测定,其中,使用牛血清白蛋白 (BSA) 标准品溶液制备标准曲线,通过标准曲线计算酶浓度。蛋白的特征吸收波长为λ=562 nm,标准曲线为y=1.098 12x+0.112 4,R2=0.997,根据甲醛脱氢酶在562 nm 处的吸光由标准曲线计算得出甲醛脱氢酶的浓度分别为:Fald DH-fdh A,3.52 mg·mL-1;Fald DH-PA5421,0.35 mg·mL-1。需要注意的是,不同批次表达纯化的酶需要标定不同的标准曲线。
1.3 标准曲线的绘制
利用酶标仪在特定波长下测定化合物的吸光度Aλ,计算溶液中该化合物的浓度。其中,NADH 的特征吸收波长为λ=340 nm,由A340对NADH 浓度作图得标准曲线:y=0.003 42x+0.015 77,R2=0.998,浓度区间为0~400μmol·L-1。
甲醛的测定方法为显色法,具体过程:体积比为1∶1的甲醛溶液与Nash试剂,40℃孵育1 h后取200μL,用酶标仪测定溶液在412 nm 处的吸光度(A412),由A412对甲醛浓度作图得标准曲线:y=0.003 79x+0.064 44,R2=0.998,浓度区间为10~100μmol·L-1。
甲醇用气相色谱仪定量,出峰时间为2.89 min,由峰面积对甲醇浓度作图得标准曲线:y=207.661 88x+20.866 55,R2=0.998,浓度区间为0.1~20 mmol·L-1。(仪器:安捷伦8890,氢火焰检测器FID,色谱柱:HP-PLOT Q)。
1.4 光催化辅酶再生体系与酶催化反应的耦合
1.4.1 与谷氨酸脱氢酶耦合
为验证构建的NADH 再生体系可以与酶催化反应相容,选择相对成熟的谷氨酸脱氢酶催化α-酮戊二酸合成L-谷氨酸的反应与构建的NADH 再生体系进行耦合。反应条件:将含有1 mmol·L-1NAD+、50μmol·L-1光催化剂Ru(tpy)(biq)Cl2、2 U 谷氨酸脱氢酶 (GDH)、0.5 mol·L-1HCOONa、0.05 mol·L-1(NH4)2SO4和10 mmol·L-1α-酮戊二酸的4 mL 0.1 mol·L-1磷酸盐缓冲液 (pH=7.4) 溶液,添加到配有橡胶塞采样注射器和磁子的Schelenk管中,然后用氩气吹扫管,将其置于绿色光源 (100 W,525 nm) 前照射。通过风扇降温让反应温度低于40℃。照射1.5 h 后,再加入10 mmol·L-1α-酮戊二酸,再照射1 h。期间进行黑暗/光照交替实验。
照射一定时间后,对反应混合物进行采样,并按照以下步骤测定L-谷氨酸:向每个稀释的样品(200μL) 中各加入100μL 质量分数2.5%的异硫氰酸苯酯的乙腈溶液和100μL 1 mol·L-1的三乙胺的乙腈溶液。将混合物在室温下孵育1 h,然后用600μL正己烷萃取未反应的异硫氰酸苯酯。收集底层的200μL乙腈溶液,加入800μL 水中,过滤膜进行高效液相色谱(HPLC)分析。在配有C18色谱柱和UV-Vis检测器的岛津Prominence 20高效液相色谱仪上对衍生的L-谷氨酸样品进行分析,用标准曲线进行定量:y=2 562.32x+8 299.82,R2=0.999 97。
1.4.2 与甲醛脱氢酶耦合
1)与甲醛脱氢酶 (Fald DH-fdh A) 耦合。
用自制核磁管适配器,在氩气条件下,将含有0.1 mg· mL-1FaldDH-fdh A、2 mmol· L-1NAD+、50μmol·L-1Ru(tpy)(biq)Cl2、0.5 mol·L-1HCOONa、100 mmol·L-1PBS的0.5 mL重水溶液加入核磁管中,密封,测核磁氢谱,记为0 h,然后将核磁管放置在绿色光源 (50 W,525 nm) 前照射,用风扇冷却将反应温度保持在低于40℃。通过核磁氢谱的特征峰变化来验证是否有NADH 生成,反应结束后用Nash试剂显色法检测甲醛。
2)与甲醛脱氢酶 (Fald DH-PA5421) 耦合。
用自制核磁管适配器,在氩气条件下,将含有0.1 mg·mL-1Fald DH-PA5421、2 mmol·L-1NAD+、50μmol·L-1Ru(tpy)(biq)Cl2、0.5 mol·L-1HCOONa、100 mmol·L-1PBS的0.5 mL重水溶液加入核磁管中,密封,然后将核磁管放置在绿色光源 (50 W,525 nm) 前照射,用风扇冷却将反应温度保持在低于40℃。通过核磁氢谱的特征峰变化来验证是否有NADH 生成,反应结束后用Nash试剂显色法检测甲醛。
3)与甲醛脱氢酶 (Fald DH-sale) 耦合。
Schelenk管中,加入含有2 U·mL-1FaldDHsale、2 mmol·L-1NAD+、50μmol·L-1Ru·(tpy)(biq)Cl2、0.5 mol·L-1HCOONa、100 mmol·L-1PBS的2 mL重水溶液,密封,然后将核磁管放置在绿色光源(50 W,525 nm)前照射,反应0、3、6、17 h后,各取115μL 溶液加入115μL Nash试剂,37℃孵育1 h,取200μL 溶液检测在412 nm 处的吸光度验证是否有甲醛生成。
4)与甲醛脱氢酶 (Fald DH-sale)、乙醇脱氢酶(ADH) 耦合。
Schelenk管中,加入含有2 U·mL-1FaldDHsale、30 U·mL-1ADH、2 mmol·L-1NAD+、50 μmol·L-1Ru(tpy)(biq)Cl2、0.5 mol·L-1HCOONa、100 mmol·L-1PBS 的2 mL重水溶液,密封,然后将核磁管放置在绿色光源 (50 W,525 nm) 前照射,反应结束后用乙腈萃取,用气相检测甲醇。
5)选取其它成熟的光催化辅酶再生体系与甲醛脱氢酶耦合。
25μmol·L-1Eosin Y(光催化剂),0.1 mmol·L-1M([RhCp*(bpy)H]+,电子介体),5 mmol·L-1HCOONa,5 mmol·L-1NADH,1 U·mL-1Fald DH-sale,100 mmol·L-1TEOA(电子给体),0.5 mL PBS(pH=7.4),绿色光源(525 nm,50 W)照射。反应0、3、6、17 h后,各取115μL加入115μL Nash 试剂,40℃孵育1 h,检测溶液在412 nm 处的吸光度。
1.5 甲醛脱氢酶催化甲酸还原
1.5.1 酶活反应
反应条件:32℃下,3种甲醛脱氢酶 (Fald DH,1μmol·L-1),NADH 或NAD+(0.2 mmol·L-1)和甲酸钠或甲醛 (5 mmol·L-1) 在磷酸盐缓冲液 (100 mmol·L-1;pH=7.4) 中,通过酶标仪检测NADH 在340 nm 处吸光度的变化来确定酶活性。
1.5.2 酶FaldDH-fdh A 的反应验证
1)Fald DH 在不同pH 缓冲液下的催化反应。反应条件:32℃下,将Fald DH-fdh A、0.2 mmol·L-1NADH 和5 mmol·L-1HCOONa加入不同pH 的PBS缓冲液 (100 mmol·L-1) 中,进行酶活测试。
2)无氧条件下酶活测试。反应条件:32℃下,在Schelenk 管中,Ar 氛围下,Fald DH-fdh A、0.5 mmol·L-1NADH 和5 mmol·L-1HCOONa在PBS缓冲液 (100 mmol·L-1;pH 7.4) 中,进行酶活测试。对照组不加HCOONa。
1.5.3 酶Fald DH-sale催化的平衡反应
1号实验组:将含有2 U·mL-1Fald DH-sale、1 mmol·L-1NADH、0.1 mmol·L-1NAD+、5 mmol· L-1HCOONa 和0.5 mmol· L-1HCHO 的PBS(100 mmol·L-1;pH 7.4) 缓冲液,在32℃摇床中进行反应。2号对照组:不含酶,将含有1 mmol·L-1NADH、0.1 mmol·L-1NAD+、5 mmol·L-1HCOONa 和0.5 mmol·L-1HCHO 的PBS(100 mmol·L-1;pH 7.4) 缓冲液,在32℃摇床中进行反应。
2 结果与讨论
2.1 酶的表达、分离与纯化
图1分别是两种酶表达的SDS-PAGE 图。结果表明:通过全蛋白的上清、沉淀泳道,可以看出蛋白表达量较好,并且蛋白可溶,纯化后 (Lane 3/Lane 6~8) 目的蛋白杂蛋白较少,说明纯化效果较好。
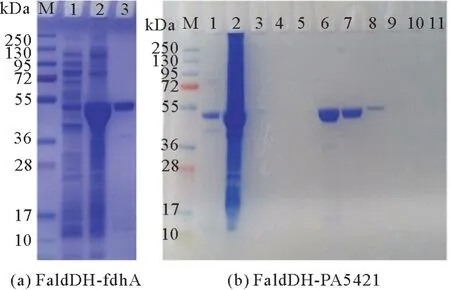
图1 甲醛脱氢酶的SDS-PAGE图Fig.1 SDS-PAGE analysis of Fald DH
2.2 光催化辅酶再生体系与酶催化反应的耦合
2.2.1 谷氨酸脱氢酶催化α-酮戊二酸合成L-谷氨酸
谷氨酸脱氢酶催化α-酮戊二酸合成L-谷氨酸的反应与构建的NADH 再生体系进行耦合结果见图2。从图可以看出,L-谷氨酸的合成是光控的,在黑暗条件下生成几乎可以忽略的L-谷氨酸,在0.5 h照射后,得到约4.03 mmol·L-1L-谷氨酸,TOF值为161 h-1,在照射1.5 h后,加入的10 mmol·L-1α-酮戊二酸被完全转化为L-谷氨酸。随后再加入10 mmol·L-1α-酮戊二酸,在1 h内完成完全转化。基于光催化剂和NAD+的TON 分别为380和19。结果表明在谷氨酸脱氢酶 (GDH) 的存在下,光催化剂没有发生明显的失活,进一步表明构建的NADH 再生体系与酶催化反应的相容性。
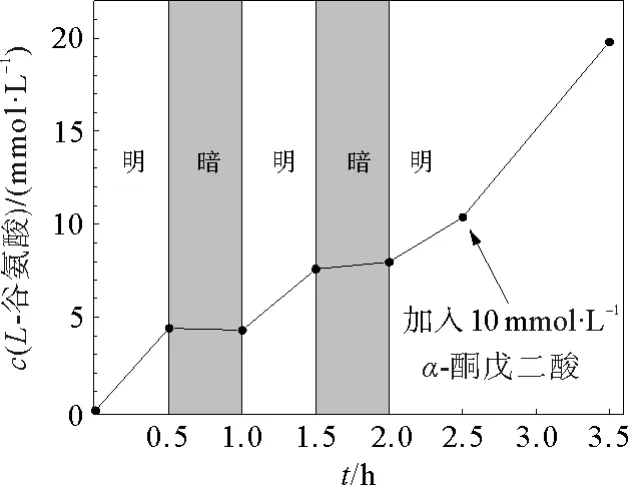
图2 L-谷氨酸的合成Fig.2 The synthesis of L-glutamate
2.2.2 光催化辅酶再生体系与甲醛脱氢酶的耦合
1)与甲醛脱氢酶 (Fald DH-fdh A) 耦合。
光催化NADH 再生体系与FaldDH-fdh A 耦合反应4.5 h后核磁氢谱见图3。从图3可以看出,1号与3号(有甲醛脱氢酶存在或没有甲醛脱氢酶时)均未有NADH 生成,2号光催化NADH 再生体系中NAD+基本完全转化为NADH。另外,未检测到甲醛生成。实验结果表明,光催化NADH 再生体系可行,与酶Fald DH-fdh A 耦合后未生成NADH或生成的NADH 被消耗。
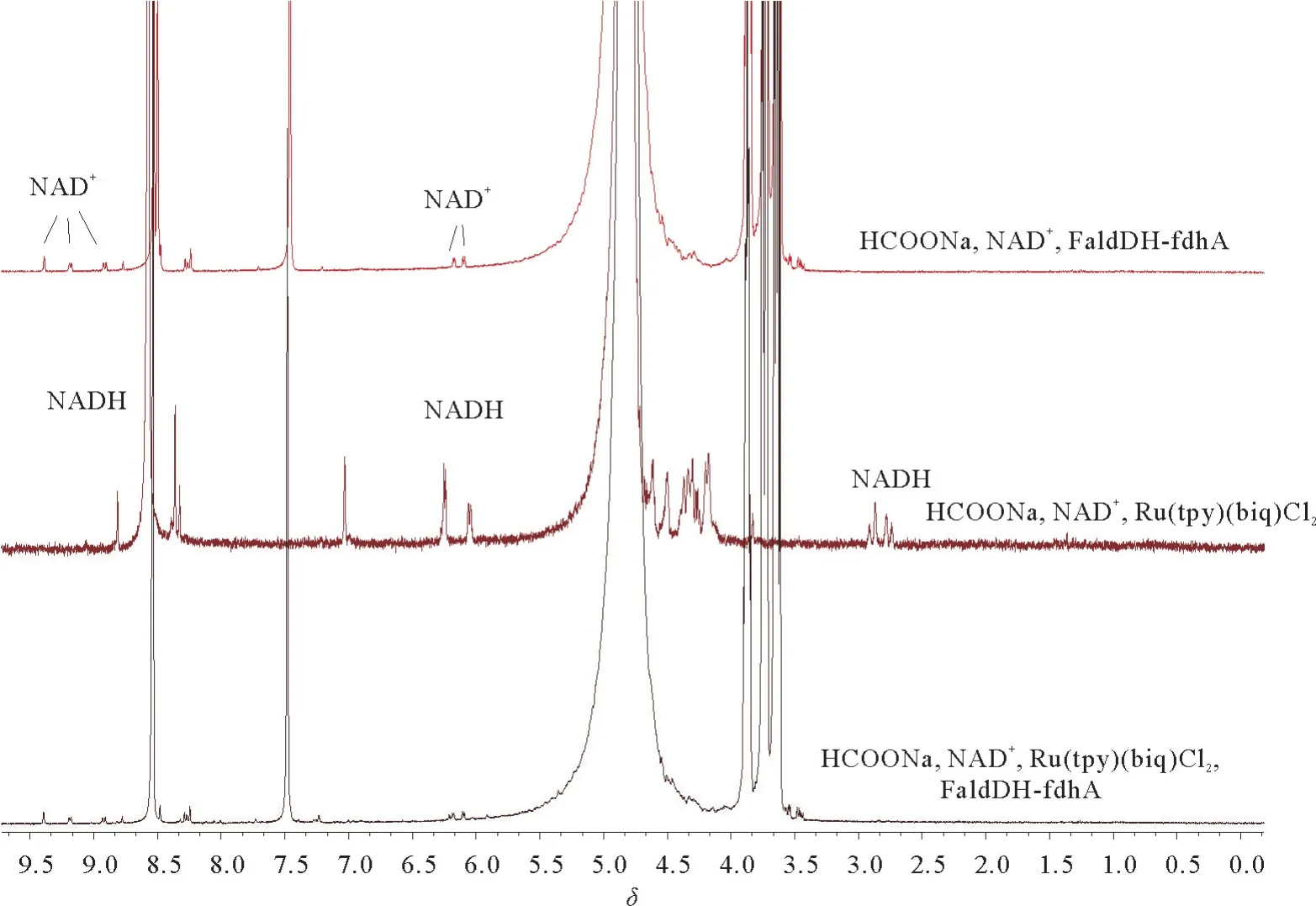
图3 光催化NADH 再生体系与FaldDH-fdh A耦合的核磁氢谱Fig.3 1H NMR spectrum of NADH regeneration coupling system with FaldDH-fdh A
2)与甲醛脱氢酶 (Fald DH-PA5421) 耦合。
光催化NADH 再生体系与Fald DH-PA5421耦合7 h 后核磁氢谱见图4,图4(a)为①号样品(HCOONa,NAD+,Ru(tpy)(biq)Cl2,FaldDHPA5421),图4(b)为②号样品 (HCOONa,NAD+,Ru(tpy)(biq)Cl2)。从图中可以看出,①号样品反应后有NADH 生成,但是未检测到甲醛;②号样品在2 h后NAD+基本完全转化为NADH。实验结果表明:光催化NADH 再生体系效率高,但与酶Fald DH-PA5421耦合后未检测到甲醛。
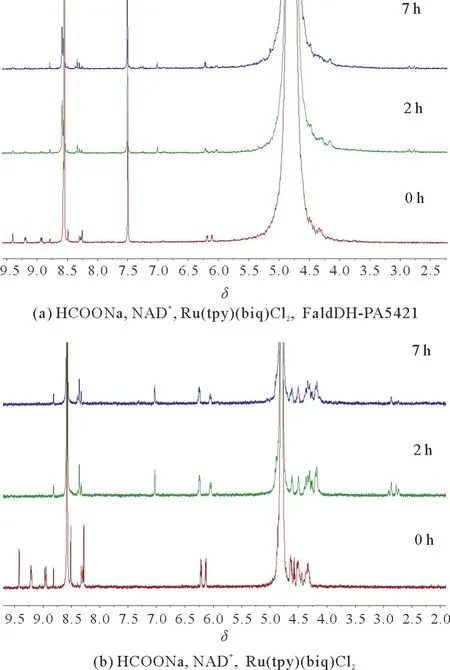
图4 光催化NADH 再生体系与FaldDH-PA5421耦合的核磁氢谱Fig.4 1H NMR spectra of NADH regeneration system coupling with FaldDH-PA5421
3)与甲醛脱氢酶 (Fald DH-sale) 耦合。
1 U·mL-1Fald DH-sale、2 mmol· L-1NAD+、50μmol·L-1Ru(tpy)(biq)Cl2、0.5 mol·L-1HCOONa在100 mmol·L-1PBS中反应0、3、6、17 h后取样,均未检测到甲醛。
4)与甲醛脱氢酶 (Fald DH-sale)、乙醇脱氢酶(ADH) 耦合。
2 U·mL-1Fald DH-sale、30 U·mL-1ADH、2 mmol·L-1NAD+、50μmol·L-1Ru(tpy)(biq)·Cl2、0.5 mol·L-1HCOONa 在100 mmol·L-1PBS中反应后,未检测到甲醇。可能原因:①在反应过程中没有甲醛生成,因此未生成甲醇;②反应过程中生成甲醛的速率过慢且生成的甲醛量较少,导致生成的甲醇浓度低于检测限。
5)其它成熟的光催化辅酶再生体系与甲醛脱氢酶耦合。
25μmol·L-1Eosin Y、0.1 mmol·L-1M、5 mmol·L-1HCOONa、5 mmol·L-1NADH、1 U·mL-1FaldDH-sale、100 mmol·L-1TEOA在PBS中反应0、3、6、17 h后,均未检测到甲醛。
以上实验结果表明在光催化辅酶再生体系与甲醛脱氢酶耦合后,未检测到甲醛的生成,但是单独的光催化NADH 再生体系是能够生成NADH的,且谷氨酸脱氢酶与NADH 再生体系耦合成功催化α-酮戊二酸合成L-谷氨酸的实验证明了构建的NADH 再生体系与模型酶催化反应的相容。另外,由ADH 催化甲醛制备甲醇的反应是可行且迅速的。因此,选择对甲醛脱氢酶催化的甲酸还原制备甲醛进行酶活反应测试,探索实验影响因素。
2.3 甲醛脱氢酶在甲酸还原反应中的测试
2.3.1 酶活反应
3种甲醛脱氢酶催化甲酸盐还原或甲醛氧化的反应结果如图5所示,其中,图5(a)、(b)、(c)、(d)为多批次的酶FaldDH-fdh A,图5(e)为酶FaldDHPA5421,图5(f)为酶Fald DH-sale。
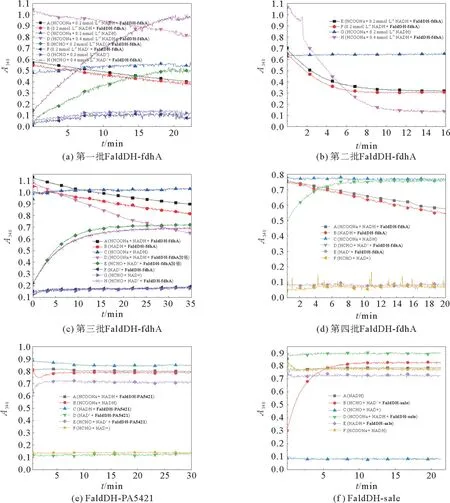
图5 Fald DH 催化的甲酸盐还原反应Fig.5 Reduction of formate catalyzed by F ald DH
从图中可以看出,3种酶均可以催化甲醛制备甲酸的逆向反应,NADH 的A340很快达到饱和,说明反应速率很快;而当催化甲酸制备甲醛的正向反应时,3种酶具有不同的实验现象:对于酶Fald DHfdh A (图5(a)~(d)),在 没有底物HCOONa 时A340也是下降的,且与存在HCOONa时下降趋势一致,即无HCOONa时NADH 也在消耗,但未检测到甲醛生成。对于酶Fald DH-PA5421(图5(e))和酶FaldDH-sale (图5(f)),有HCOONa 和 无HCOONa时,A340都不变,且未检测到甲醛生成。
2.3.2 不同浓度酶Fald DH-fdh A 与NADH 消耗速率关系
根据酶活反应测试的实验结果,假设NADH充做反应底物,设计实验研究甲醛脱氢酶Fald DHfdh A 的浓度与NADH 下降速率的关系,得到了如图6所示的关系曲线。选取第3 min到30 min之间的ΔA,以ΔA对FaldDH-fdh A 浓度作图,如图7所示:ΔA 与Fald DH-fdh A 浓度线性相关,也就是说,NADH 的消耗速率与酶FaldDH-fdh A 的浓度成正比。这进一步表明,NADH 与酶Fald DH-fdh A进行了反应,NADH 充作了反应底物。
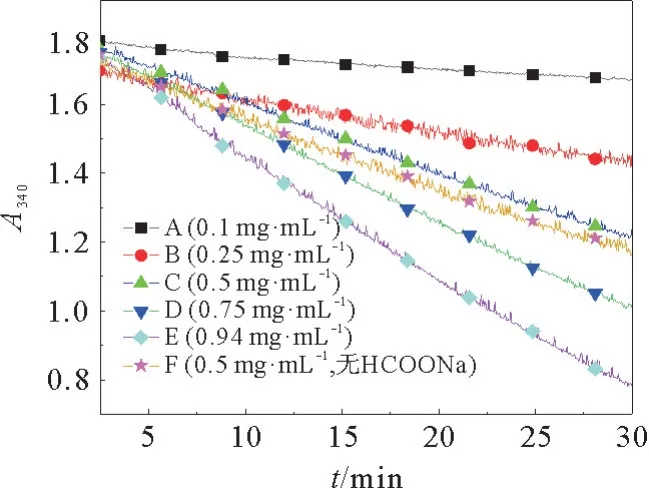
图6 不同浓度FaldDH-fdh A与A340 的关系曲线Fig.6 Elationship curve between different concentrations of Fald DH-fdh A and A340
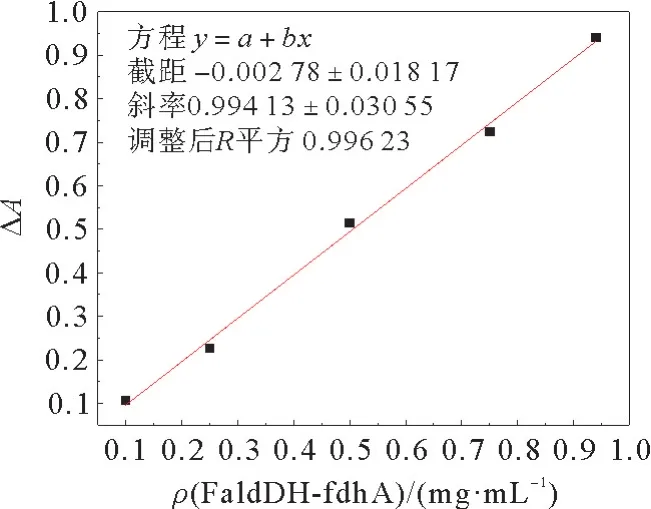
图7 NADH 吸光度A340 的变化与酶FaldDH-fdhA浓度的关系Fig.7 Relationship between the change of NADH absorbance (A340)and the concentration of FaldDH-fdh A
针对这一实验结果,可能有两种原因:1)溶液pH 对反应产生影响;2)氧气与NADH 进行反应。为了验证以上两种可能,又进行了反应验证。分别在不同pH 的PBS缓冲液 (pH=7.0,8.0,8.5,9.0,9.5,10.0) 或在氩气保护条件下对酶Fald-DH-fdh A 进行酶活测试,部分实验结果见图8。从图8可以看出,反应结果与先前一致:加入甲酸钠和不加甲酸钠时的A340的变化趋势相同,即NADH作为反应底物与酶反应,且未检测到甲醛。实验结果表明:在酶Fald DH-fdh A 催化甲酸还原反应过程中,酶Fald DH-fdh A 中可能存在某些物质会消耗NADH,与HCOONa竞争,使HCOONa不参与反应。该机制还需进一步研究验证。
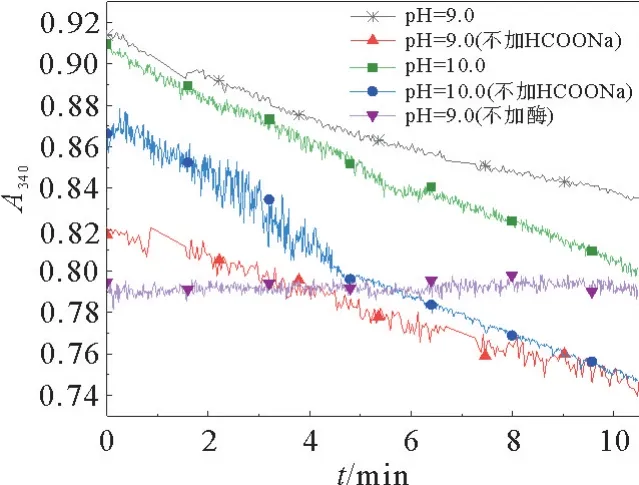
图8 不同pH 缓冲液下Fald DH-fdhA催化的甲酸还原反应Fig.8 Reduction of formate catalyzed by Fald DH-fdh A under different pH PBS buffer
2.3.3 利用酶Fald DH-sale催化的可逆估算反应平衡常数
针对酶Fald DH-sale在2.3.1 中的实验现象(催化甲酸制备甲醛时NADH 的吸光度A340不变),有两种可能原因:1)酶Fald DH-sale在NADH存在下,不会催化甲酸还原;2)反应平衡向正向反应的驱动力不足。因此,设计实验利用酶Fald DHsale催化的可逆来估算反应平衡常数。
根据实验组(1号,含酶Fald DH-sale)与对照组(2号,不含酶)在412 nm 处的吸光度,由甲醛标准曲线计算出对应的甲醛浓度 (cHCHO),得到甲醛浓度随时间的变化曲线(见图9)。从图9可以看出,在1号实验组中,甲醛一直在消耗;2号对照组中,甲醛浓度基本不变。实验结果表明:在初始NADH与NAD+比值为10时,Fald DH-sale一直在催化由甲醛到甲酸的逆向反应,即Fald DH-sale催化逆反应的速率远远大于催化正反应,这与文献[6]报道一致。在22 h时酶FaldDH-sale催化反应中甲醛浓度变化趋势仍未趋缓,即反应未达平衡。考虑到酶的活性及反应中NADH 自身降解等因素,未继续延长反应时间。通过22 h时的数据计算方程式两边浓度比例关系,可知反应的平衡常数远远小于1×10-4。那么在酶活反应中,即使Fald DH 能够催化甲酸还原制备甲醛,即使FaldDH 能够催化甲酸还原制备甲醛,5 mmol·L-1HCOONa、0.2 mmol·L-1NADH 最多只能生成0.01 mmol·L-1的甲醛,这低于Nash显色法的检测限,因此,之前的实验未检测到甲醛。该结果为将来的工作提供了思路:可以加大HCOONa的浓度使反应平衡向右移动,即甲醛脱氢酶催化甲酸还原需要一定的甲酸阈值浓度。
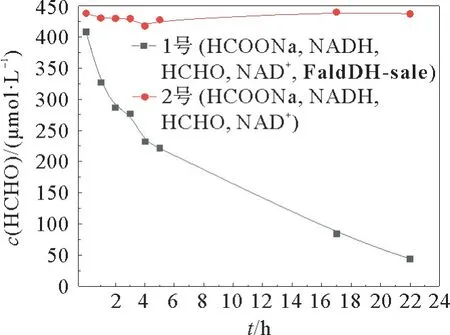
图9 甲醛浓度随时间的变化Fig.9 Formaldehyde concentration as a function of time
2.4 文献分析与讨论
通过多酶级联反应催化CO2还原制备甲醇已有许多报道,部分文献见表2。其中,PARK 等[4]基于BLAST 的序列比较和系统序列分析筛选出来自洋葱假单胞菌甲醛脱氢酶 (Pc Fald DH),并对其进行酶活研究,在NADH 存在下,PcFaldDH 可以将HCOO-还原生成HCHO。IMAE 等[9]在含FDH的薄膜上检测到446 mg·(L·g)-1甲酸,在含FDH-Fald DH 的薄膜上检测到218 mg·(L·g)-1甲醛,在含FDH-FaldDH-ADH 的薄膜上检测到203 mg·(L·g)-1甲醇。LEE 等[7]基于BLAST的序列比较和系统序列分析筛选得到来自多食伯克霍尔德菌的甲醛脱氢酶 (Bm Fald DH)。
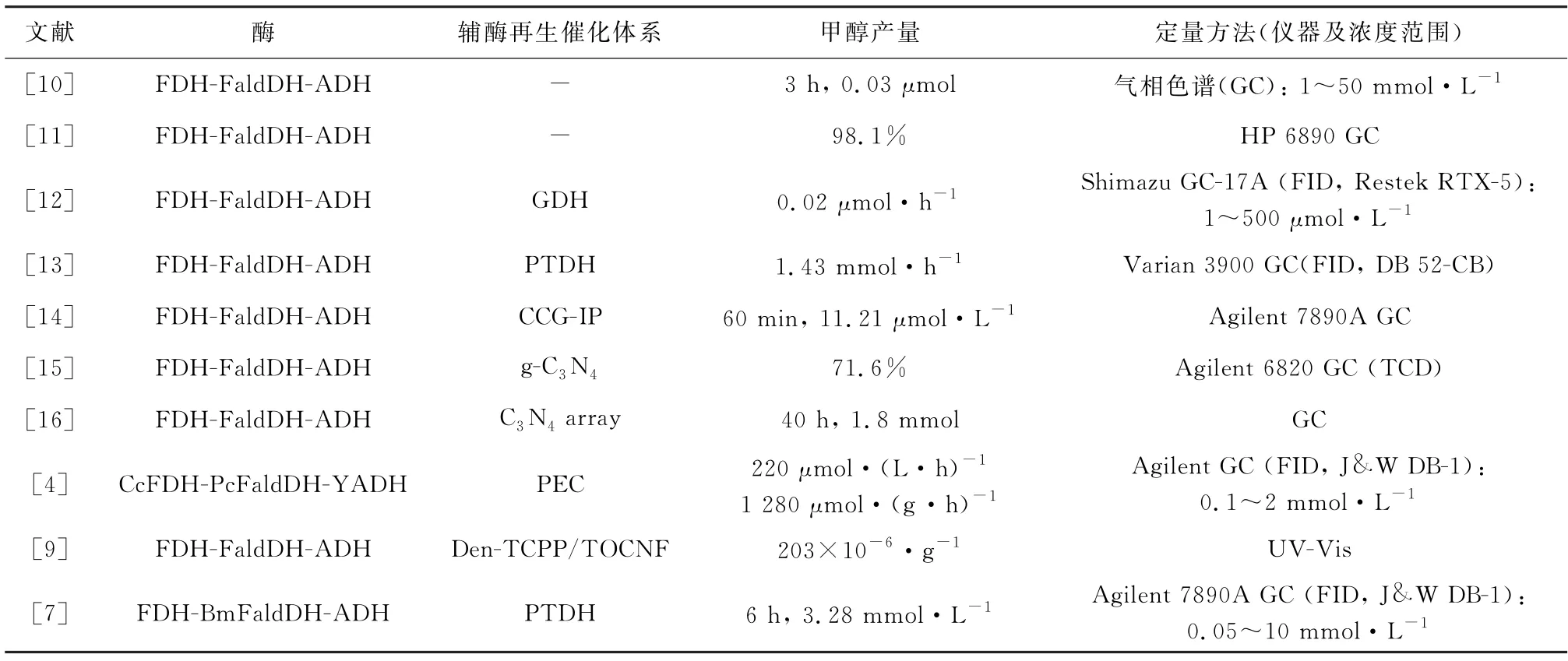
表2 多酶级联反应还原CO2 制备甲醇Table 2 Reduction of CO2 to methanol throughmultienzyme cascade
在以上研究中认为:NADH 作为还原剂,为每个反应步骤提供电子。虽然有些研究报道了分步反应的酶活研究,但是在整个多酶级联反应过程中,未有检测中间体甲酸盐或甲醛的报道。令人惊讶的是,2018年,AMAO 课题组[17]研究有了新发现,如式7所示:在天然辅酶NADH 存在下,Fald DH 不能催化甲酸生成甲醛(这与在2.2.2 中对酶Fald-DH-sale的研究结果一致),但在NAD+存在下,Fald DH 可以催化甲醛生成甲酸;他们还提出,在甲基紫精氧化形式 (MV2+) 存在下,FaldDH 不能催化甲醛生成甲酸,但是在甲基紫精还原形式(MV·) 存在下,Fald DH 可以催化甲酸制备甲醛。该研究进一步表明甲醛脱氢酶极有可能不依赖NAD(P)H 催化甲酸的还原。
综合以上研究发现,在天然辅酶NADH 存在下,Fald DH 是否可以催化甲酸生成甲醛取决于以下几点:1)甲酸浓度,Fald DH 催化甲酸还原需要一定的甲酸阈值浓度;2)FaldDH 活性,来自不同菌属的甲醛脱氢酶对甲酸还原具有不同的活性,可以通过筛选、构建或突变等方法找到活性较好的甲醛脱氢酶用于反应;3)NADH 与NAD+的比值,对于酶催化的可逆氧化还原反应,NADH 与NAD+需要有适当的比值,以推动反应朝正反应方向进行;4)构建合理可靠的甲醛、甲醇定量方法,不能低于定量方法的检测限。
3 结语
1)基于两种甲醛脱氢酶的质粒,成功表达并分离纯化得到高纯度的甲醛脱氢酶 (Fald DH-fdh A,Fald DH-PA5421)。
2)建立了NADH、甲醛和甲醇的定量检测方法,并指出了检测方法的适用条件。
3)将光催化辅酶再生体系与甲醛脱氢酶及醇脱氢酶耦合,虽然未检测到甲醛或甲醇,但对其影响因素进行了对比考察。根据实验发现,即使Fald DH能够催化甲酸还原制备甲醛,推测反应热力学限制可能是生成的甲醛浓度低于检测限的原因。
4)给出了在光催化辅酶再生体系与甲醛脱氢酶耦合反应过程中需要注意的问题,指出甲醛脱氢酶极有可能不依赖NAD(P)H 催化甲酸的还原。
