H4及A172神经胶质瘤细胞系高亲和腺相关病毒载体的研究
2023-11-25赵琳琳汪煜楠初婷婷郑永慧张惊宇
高 腾,赵琳琳,汪煜楠,初婷婷,郑永慧,张惊宇
(哈尔滨医科大学附属第四医院 神经内科,黑龙江 哈尔滨150001)
腺相关病毒(Adeno-associated virus,AAV)属于细小病毒科的依赖病毒属,AAV的线性单链DNA基因组约为4.7 kb,有两个主要编码基因:编码复制相关蛋白(Rep)与衣壳蛋白(Cap)[1-3]。AAV基因组末端长度为145 bp的反向末端重复序列(ITR)是DNA的复制来源,也是包装信号和整合位点所需的唯一基本活性序列。重组AAV基因传递载体包含一个保留ITR的基因组,但野生型AAV编码序列被治疗基因(转基因)取代。这些载体是通过添加编码VP和Rep蛋白的质粒结构来组装的[4-5]。腺相关病毒宿主范围较广,可整合到染色体但无致病性,免疫原性较弱,可长期表达外源基因,是体内基因转移理想的候选载体[6]。目前已经发现13种腺相关病毒血清型,现阶段发现的腺相关病毒血清型尚不能破坏寄主并诱发病害[7]。使用腺相关病毒载体进行体内基因转移的安全性和有效性都受到宿主免疫系统的影响。针对转导细胞的衣壳特异性,T细胞反应在腺相关病毒介导的转基因过程中,对外源基因表达时间的长短有一定影响[8-10]。目前腺相关病毒介导的基因转移在脑肿瘤领域的应用尚处于萌芽阶段,其中一个重要原因就是缺乏高效转导肿瘤细胞的腺相关病毒载体。所以如何提高腺相关病毒转导脑肿瘤细胞的效率是重要的研究方向。因此本研究通过在AAV5的衣壳蛋白Cap的氨基酸N573后插入一段寡肽GIVADNLNL以替换Q574到T578之间的蛋白序列QSSTT,同时引入两个点突变S2A和T711S得到AAVX01,进而研究其产量及转导效率。
1 材料与方法
1.1 主要材料AAV5、AAV8两种腺相关病毒血清型,pAAV-CMV-GFP质粒,pHelper质粒,HEK293细胞,H4细胞系和A172细胞系。
1.2 AAVX01的构建在AAV5的Cap基因N573后随机插入7个氨基酸寡肽片段,同时引入S2A、T711S两个点突变位点,经合理设计并合成形成AAV5随机质粒,将构建的病毒包装质粒与pHelper质粒共转染HEK293细胞形成具有感染性的嵌合AAV5。将嵌合AAV5与Ad5质粒共感染H4细胞系及A172细胞系,感染48 h后收集细胞裂解液用于下一轮的感染,如此反复感染两组细胞系4~5次,提取病毒DNA,并对突变的衣壳蛋白基因进行测序,分析出现频次最高的突变体,此变体在H4细胞系及A172细胞系中转导效率优于其他变体,实验中发现插入寡肽片段为GIVADNLNL的突变体转导效率优异,命名为AAVX01。
1.3 细胞的培养、转染、病毒包装、纯化、感染用含10%FBS、1%双抗(体积分数)的DMEM高糖培养基培养HEK293细胞,用含10% FBS、1%双抗(体积分数)、10%热灭活胎牛血清的DMEM高糖培养基培养H4和A172细胞。将AAV包装质粒、pHelper质粒、pAAV-CMV-GFP质粒在PEI条件下进行三质粒转染。48 h后,收集细胞并通过离心沉淀,将细胞重悬于含150 mmol/L NaCl,50 mmol/LTris-HCl(pH7.5)的PBS溶液中,冷冻与融化交替进行反复若干次,并在37℃下用Benzonase酶(50 U/mL)处理0.5 h,去除细胞裂解物,并将上清液加到碘克沙醇梯度溶液(按体积分数使用PBS配制10%、20%、40%、50%碘克沙醇梯度溶液)中,在4℃下以78 000 r/min的转速离心120 min,从40%碘克沙醇相中收获病毒颗粒。将收获的病毒以感染复数=1×105vg/cell感染H4、A172细胞,观察GFP绿色荧光表达,每组平行进行5次实验。
1.4 嵌合AAV和嵌合质粒的构建AAV Cap基因重组后,用特异性引物进行PCR扩增生成全长Cap嵌合体,克隆到野生型AAV5主链中生成重组质粒。对20个重组质粒进行克隆和DNA测序。建立质粒后,分两步生成AAV衣壳。首先通过将pXR2和AAV质粒共转染,将含有重组Cap基因的部分包装到AAV5衣壳中。然后将得到的AAV感染HEK293细胞和腺病毒Ad5重复感染的H4细胞系及A172细胞系,从而确保产生包装相应嵌合AAV基因组的嵌合AAV衣壳。
辅助质粒pXR和引物序列设计:利用外层引物P1和P2扩增DNA,进行片段反应。从辅助质粒中扩增出包含整个Cap、部分Rep基因和部分质粒主干序列的4.4 k碱基片段。然后将PCR产物以等摩尔量混合在一起,用DNaseI随机破碎。大小在400到1 200个碱基对之间的片段在琼脂糖凝胶中被分解,并在没有引物的情况下通过变性、退火和延伸的循环重新组装。然后在4℃下,用内引物P3和P4扩增组装好的片段,用SfiI和XbaI酶切,并连接到用相同酶酶切的主链上结扎混合物并纯化。将此20个样本克隆进行序列分析。
1.5 提取mRNA和PCR检测实时荧光定量PCR对采集病毒进行检测,以pAAV-CMV-GFP为标准品,在GFP基因上设计上游引物和下游引物。从GenBank中查询得到人AAV5的cDNA。用Prime Primier软件设计引物。引物由纳川生物技术有限公司合成。
上游引物(Forward primer):5’-GGAAGCTTATGTCCATCTTGTTTTATG-3’
下游引物(Reverse primer):5’-ATGCGGCCGCTTCATGTTCTTCCGATT-3’
1.6 银染银染检测出蛋白和核酸的阳性率较高,AAV的外壳由VP1、VP2、VP3 3种蛋白按1∶1∶10比例组成,利用Thermo Scientific的银染试剂盒对收集的病毒颗粒进行纯度分析。
1.7 统计学处理本实验各定量数据的统计描述以标准差的方式来体现。用双尾检验及不成对资料的t检验来比较各组血清型的神经胶质瘤转导效率。P<0.05为差异具有统计学意义。
2 结果
2.1 与H4及A172细胞系高亲和AAV载体
利用肽展示技术通过在AAV5衣壳蛋白Cap的氨基酸N573后插入一段氨基酸GIVADNLNL以替换Q574到T578之间的蛋白序列QSSTT,同时引入两个点突变S2A和T711S得到AAVX01(图1)。本研究该改造是否会对AAV产量造成影响,通过qPCR定量分析从5×107个细胞中产出的病毒量,发现AAVX01的产量不比常用的野生型AAV5,8低(表1);进而计算qPCR和银染测得的病毒滴度比值(即实心率,反映有活性的病毒量),发现AAVX01的实心率不明显低于野生型AAV5,8。上述结果说明对AAV5改造产生的AAVX01产量和实心率不低于野生型AAV5,8。

表1 AAV5、AAV8及AAVX01产量和实心率

图1 与H4及A172细胞系高亲和AAV载体AAVX01
2.2 AAVX01有优异的H4及A172细胞系转导效率
为了研究AAVX01感染肿瘤细胞的效率,本研究选择了H4和A172这两种常用的神经胶质瘤细胞系,将包装了GFP报告基因的AAV以5×104vg/cell的感染复数(MOI)感染细胞,于72 h后观察绿色荧光表达。对于被病毒感染神经胶质母瘤细胞A172的比例,AAVX01是AAV5的2.85倍,是AAV8的9.27倍(图2A,B);对于神经胶质瘤细胞H4的转导效率AAVX01是AAV5的6.85倍,是AAV8的1.67倍(图3A,B)。上述结果说明AAVX01相比于野生型AAV5,8对于H4及A172神经胶质瘤细胞系有更好的转导效率。

图2 AAVX01转导A172细胞系的效率
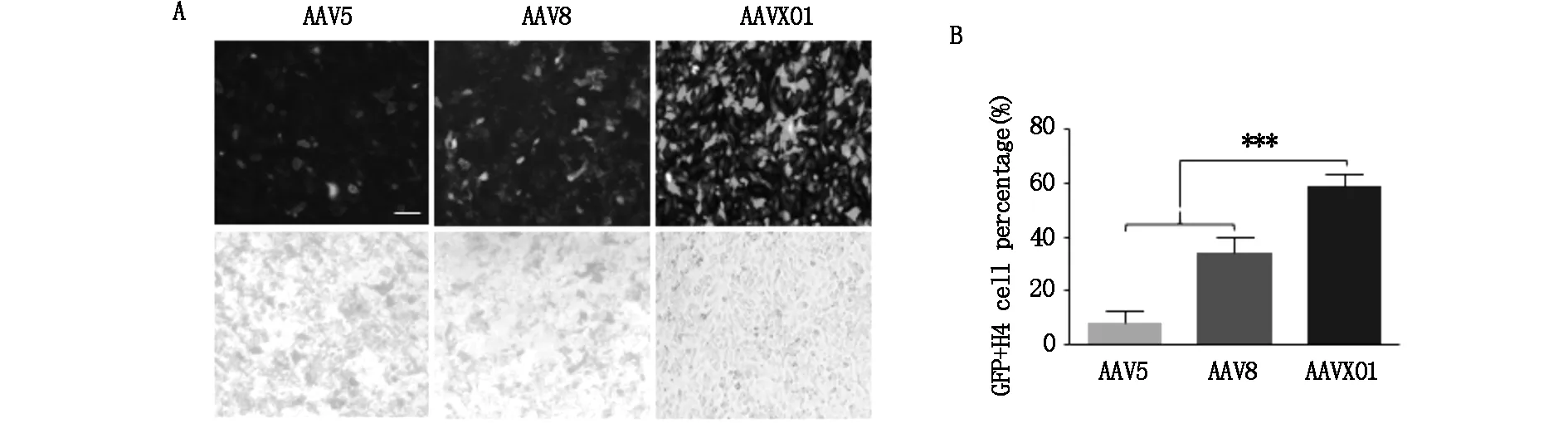
图3 AAVX01转导H4细胞系的效率
AAVX01载体的构建:通过在AAV5衣壳蛋白Cap的氨基酸N573后插入一段氨基酸GIVADNLNL以替换Q574到T578之间的蛋白序列QSSTT,同时引入两个点突变S2A和T711S得到AAVX01。
通过qPCR定量分析从5×107个细胞中产出的病毒量;进而计算qPCR和银染测得的病毒滴度比值,数据以平均值的形式体现,n=3,数据统计采取非配对t检验。
3 讨论
AAV已成为人类基因治疗最常用的传递方式之一。事实上,目前欧洲和美国食品和药物管理局已经批准了3种rAAV药物[11-12]。总体来讲,rAAV药物临床应用取得了积极的治疗效果且AAV基因治疗具有较强的安全性。然而,关于AAV载体的研发仍面临诸多问题:衣壳和转基因产品的免疫原性、靶器官体内如何高效转导。通过对AAV载体衣壳蛋白的修饰能够减低体内抗体的中和作用,从而降低免疫原性。本研究获得具有高效神经胶质瘤亲和性和神经胶质瘤细胞感染性新型AAV血清型,且中和抗体分布较低。此新型血清型对胶质瘤的治疗有重要意义。
目前已有相关研究表明AAV5在眼睛、肺和神经系统的转导效率优于其他血清型[13-15],AAV8则表现出突出的肝脏转导优势,有研究团队由此开发出用于改善胰岛素基因治疗糖尿病的肝脏特异性Tet-off AAV8载体[16]。AAV8的肌肉亲和性也表现出良好的应用前景[17]。现有研究表明,AAV9在全身组织和器官中都有广泛的表达。由于AAV9具有可以穿越血脑屏障的特性[18-19],所以在神经系统的相关研究中AAV9是较受欢迎的病毒载体之一。目前在野生的AAV中尚缺乏理想的血清型能够对多种肿瘤细胞有较高的基因递送效率,这是AAV在肿瘤治疗方面应用受到限制的一个重要原因。然而本研究中新型的AAVX01对于至少两种神经胶质瘤细胞有相对优异的转导效率,使其具有成为抗肿瘤药物载体的潜力,因此可递送多种例如抗肿瘤单抗,双特异性抗体,自杀基因,RNAi等药物并维持它们在体内的稳定表达,为肿瘤的治疗提供更多的选择。
有团队也对AAV5在神经系统的转导效率进行了研究,在雌性Wistar大鼠采用背根神经元直接注射的方式,比较了不同血清型腺相关病毒(AAV1、AAV2、AAV3、AAV4、AAV5、AAV6 和 AAV8) 载体对初级感觉神经元的转染效果,发现 AAV5 的转染效果最佳[20]。已有研究表明,AAV2优先转导神经元而AAV5同时转导神经元和神经胶质细胞[21]。早在2003年,有学者就已经在研究AAV8介导的可溶性VEGF受体向中枢神经系统的基因传递治疗胶质母细胞瘤,在研究过程中发现,由于rAAV载体的表达在中枢神经系统内是稳定和长期的[22],因此抗VEGF治疗存在反馈机制。这表明对神经胶质瘤高亲和性的新型AAVX01血清型介导的基因转移,有希望在中枢神经系统持续表达一种有效的肿瘤抑制,但其疗效可能会同时受限于机体的反馈机制,如何将对神经胶质瘤高亲和性的新型AAVX01载体所携带的抗神经胶质瘤基因的作用进行优化,将成为动物实验和临床实验的重点。随着对rAAV研究的深入,会有更多、更安全的rAAV载体出现,具有广阔的临床应用前景。
