7-羟基香豆素酰化改性壳聚糖的水溶性与抗菌性
2023-11-25吴长炜刘佳宇吕文文井锐涵张大伟
吴长炜, 刘佳宇, 邱 晓, 吕文文, 井锐涵, 张大伟
(东北林业大学 材料科学与工程学院,黑龙江 哈尔滨 150040)
壳聚糖(CS)是一种带有氨基的亲水性高分子有机物,通常由甲壳素经碱水解或酶解脱乙酰基制得,因其具有优异生物降解性、生物相容性、生物黏附性和抗菌活性等特点而被用于各种活性化合物(如药物、蛋白质、维生素和基因)的受控递送[1]。由于壳聚糖主链上氨基的强烈氢键作用,需要用酸性溶液将氨基转变成铵离子,才能提高其水溶性与抑菌性,但作为伤口敷料、组织工程支架材料时的使用环境为中性环境,以及溶解在酸性溶液中CS的β-1,4-糖苷键容易发生降解,使其对金黄色葡萄球菌、尖孢镰刀菌、大肠杆菌等的抑菌性能降低,限制其在生物医学、农业等领域的应用[2-3]。虽然可通过CS改性来增强其在中性水中的溶解性和抗菌性能,但反应条件温和、耗时短、性能优、可大规模生产的CS改性技术鲜有报道,如郑宏飞等[4]将壳聚糖溶解在离子溶液中,但是其处理条件较为严苛,不利于大规模生产使用;符思达等[5]使用赖氨酸改性的壳聚糖,虽然可以在水中几乎完全溶解,但所耗的时间相对较长,使其难以得到广泛应用。香豆素是邻羟基桂皮酸内脂类化合物的统称,具有抗氧化、抗突变、抗炎等生物活性,已作为许多药物的重要组分部分[6]。本研究采用酯化改性的方法,先将7-羟基香豆素进行酯化改性得到7-甲酯酰氯香豆素,再利用其对CS进行酰胺化改性,制得香豆素酰化壳聚糖(CS-C),并考察了产物的化学结构、热稳定性、结晶性、溶解性和抑菌性能等,以期获得具有良好抗菌性能和在中性水中能良好溶解的香豆素酰化壳聚糖。
1 实 验
1.1 试剂与仪器
7-羟基香豆素,纯度98%,阿拉丁生化科技有限公司;壳聚糖,粒径30 μm,脱乙酰度91%,黏均相对分子质量2.2×105,浙江金壳药业有限公司;大肠杆菌(Escherichiacoli)和金黄色葡萄球菌(Staphylococcusaureus),广东省微生物菌种保存中心;营养琼脂,北京奥博星生物技术有限责任公司;胰蛋白胨,上海阿拉丁生化科技股份有限公司;酵母提取物,西格玛奥德里奇(上海)贸易有限公司;草酰氯、丙酮、三乙胺、二甲基亚砜、氯化钠、氢氧化钠,均为市售分析纯。
Tensor II傅里叶红外光谱仪,德国布鲁克公司;209 F3热重分析仪,德国耐驰仪器制造有限公司;D/max-2200VPC X射线衍射仪,日本理学公司;IKA©RV10旋转蒸发仪,广州仪科实验室技术有限公司。
1.2 7-甲酯酰氯香豆素酰化改性壳聚糖的制备
1.2.17-甲酯酰氯香豆素的制备 室温条件下,将5 g 7-羟基香豆素加入到95 g丙酮中,充分搅拌使其完全溶解。在0 ℃冰水浴、氮气保护的条件下加入草酰氯(草酰氯与香豆素的质量比为1∶1)进行均相反应,反应3 h后将产物分3次加入6 g干燥的三乙胺中,搅拌5 h,去除过量的草酰氯及产生的氯化氢,过滤去除三乙胺与草酰氯反应产生的副产物,然后减压蒸馏除溶剂,向其中加入1% NaOH溶液过滤,用蒸馏水及少量乙醇洗涤滤饼至pH值为7.4后用丙酮重结晶制得7-甲酯酰氯香豆素,反应式如下:
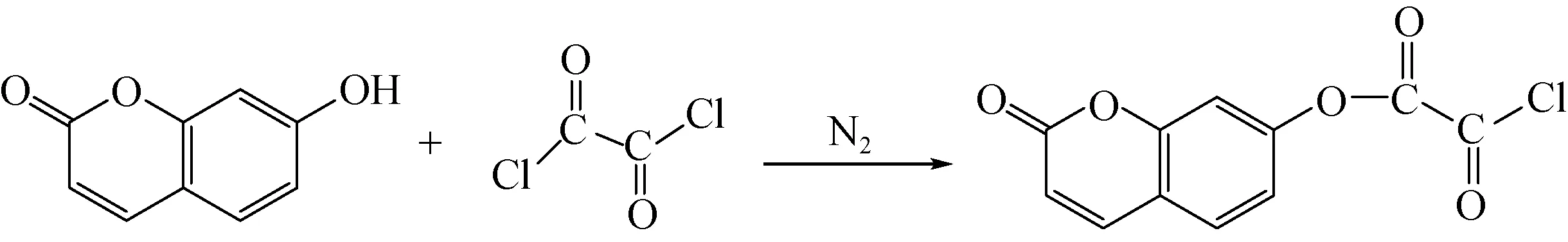
1.2.2酰化改性壳聚糖的制备 取1 g制备得到的7-甲酯酰氯香豆素溶于丙酮中配制质量分数5%丙酮溶液,加入一定量的CS粉末,进行非均相的接枝反应,反应在氮气保护及0 ℃冰水浴的条件下进行。搅拌反应12 h后,50 ℃ 旋转蒸发丙酮溶剂,获得7-羟基香豆素酰化改性壳聚糖(CS-C),反应式如下:
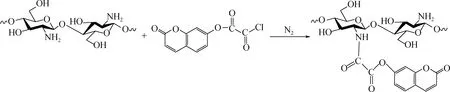
CS与7-甲酯酰氯香豆素的质量比为1∶1、 1∶2、 1∶3、 1∶4和1∶5时,制备的7-羟基香豆素酰化改性壳聚糖分别标记为CS-C-1、CS-C-2、CS-C-3、CS-C-4和CS-C-5。
1.3 结构表征与性能测试
1.3.1FT-IR分析 使用红外光谱(FT-IR)仪对7-羟基香豆素、 7-甲酯酰氯香豆素、CS以及不同比例的CS-C化合物进行分析,扫描范围4 000~500 cm-1,分辨率4 cm-1。
1.3.2—NH2取代度的测定 称取0.2 g干燥样品于锥形瓶中,加入25 mL 0.1 mol/L的NaOH溶液,摇匀后静置2 h。用标记酚酞的HCl标准液(含有1~2滴酚酞)滴定上述溶液,当红色消失且30 s内不重现,结束滴定。—NH2取代度(Ds)的计算,按式(1)进行。
(1)
式中:Ds——NH2取代度,%;C1—标准氢氧化钠溶液的浓度,mol/L;V1—标准氢氧化钠溶液的体积,L;C2—标准盐酸溶液的浓度,mol/L;V3—CS-C消耗标准盐酸的体积,L;V2—CS消耗标准盐酸的体积,L;m0—CS的质量,g;m1—CS-C的质量,g。
1.3.3热重分析 使用热重分析仪测定了CS以及CS-C化合物的热稳定性,测试温度范围为25~600 ℃,升温速率为10 ℃/min。
1.3.4溶解性能的测定 称取0.1 g冻干样品于烧杯中,加入20 mL二甲基亚砜,在30 ℃下一边搅拌一边缓慢加入20 mL蒸馏水,随后高速搅拌20 min,置于离心管中,5 000 r/min下离心15 min;离心后所得固体颗粒经120 ℃ 干燥至质量恒定,记录残余质量。CS-C溶解度由式(2)计算。
S=(m2-m3)/m2×100%
(2)
式中:S—溶解度,%;m2—样品初始质量,g;m3—样品残余质量,%。
1.3.5抑菌性能测试 采用最小抑菌浓度法[7]对CS及CS-C-3的抑菌性能进行测试。分别称取5 g CS与CS-C-3于去离子水中配置5种不同浓度的悬浮液备用。按照如下比例制备液体培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L,用0.1 mol/L NaOH溶液调节培养基pH值7.4,然后将悬浮液与液态培养基按体积比1∶1混匀。混合培养基中分别植入大肠杆菌与金黄色葡萄球菌。测试液质量浓度分别为0.25、 0.5、 1、 2和4 g/L,混合培养基中注入0.1 mL细菌(浓度约为10-5cfu/mL)。所有的培养基混匀后均放在37 ℃ 恒温振荡培育箱中,1 000 r/min振荡培育24 h,用浑度仪检测试管中细胞生长状态,即液态培养基有无浑浊,液态浑浊程度越大说明抑菌性越差,未浑浊的最低浓度为最小抑菌浓度(MIC)。
另外,采用最小杀菌浓度法[8]对CS及CS-C-3的灭菌性也进行了测试,测试的细菌同样为大肠杆菌和金黄色葡萄球菌。具体做法如下:将6.6 g营养琼脂溶解于200 mL蒸馏水中制备营养琼脂培养基,将营养琼脂培养基在121 ℃ 高压灭菌40 min,之后置于培养皿内,在超净工作台上用微量加样器在培养基中分别植入0.1 mL浓度约为10-5cfu/mL的大肠杆菌与金黄色葡萄球菌,均匀涂布后取100 μL上述抑菌测试实验中配置的不同浓度的CS与CS-C-3的悬浮液转移到培养基中,然后在37 ℃培养24 h,通过透明度测定仪观察培养基的透明性从而来判断菌群的生长情况,培养基透明性越好,表明菌群被杀灭的程度越高,培养基透明性最好的悬浮液浓度是材料的最小杀菌浓度(MBC)。
2 结果与讨论
2.1 7-甲酯酰氯香豆素的FT-IR分析
7-羟基香豆素以及7-甲酯酰氯香豆素的FT-IR光谱如图1所示。由图可知,在7-甲酯酰氯香豆素的光谱中,在3 170 cm-1处的7-羟基香豆素的—OH基团的特征吸收峰[9]消失,在1 710 cm-1处出现羰基的特征吸收峰,在1 790 cm-1处出现酰氯基团的特征峰,1 220和1 120 cm-1处的谱带是由C—O—C基团振动产生的,证明7-羟基香豆素与草酰氯发生酰化反应得到7-甲酯酰氯香豆素。
2.2 7-羟基香豆素酰化改性壳聚糖(CS-C)的结构表征

2.2.2XRD分析 用X射线衍射法研究了CS以及CS-C的晶体结构,结果如图2(b)所示。由图可知,CS的X射线衍射图在2θ=11.26°和20.05°处的两个特征峰,分别是由CS结构中分子内与分子间氢键作用以及高脱乙酰度CS链中的结晶引起的。CS经过酰化改性后的CS-C,在X射线衍射图2θ=11.26°处的衍射峰消失,并且2θ=20.05°处衍射峰强度降低,证明CS-C结构中的晶区减少,这是因为改性后其晶体结构被破坏,同时分子内与分子间氢键作用被削弱,降低了CS分子的结晶程度。
2.2.3Ds分析 不同CS与7-甲酯酰氯香豆素质量比制备的CS-C的—NH2取代度如图2(c)所示,根据实验结果可以发现,CS-C的—NH2取代度呈现先增加后降低的趋势,其峰值出现在CS与7-甲酯酰氯香豆素质量比在1∶3处。这可能是因为CS与7-甲酯酰氯香豆素的反应是一个可逆反应,当CS的用量一定时,7-甲酯酰氯香豆素的含量达到一定值继续增加时,不仅反应不向正方向进行,提高CS的—NH2取代度,而且使已经接枝的产物发生水解,使—NH2取代度下降。此外,由图亦可得出CS被成功修饰[10],且在壳聚糖与7-甲酯酰氯香豆素质量比为1∶3时的改性效果最好;与Panda等[11]得到的改性产物的氨基取代度随着天然壳聚糖分子质量的增加而降低,水溶性也随着天然壳聚糖分子质量的增加而降低的结果一致。
2.3 CS-C的性能分析
2.3.1热稳定性能 CS及CS-C在N2气氛中的质量损失如图3(a)所示。从图3(a) 可以看到,CS及CS-C的热解过程可分成2个阶段,分别对应50~100和250~350 ℃ 这两个温度区间,第一个热解阶段主要是壳聚糖分子中的结合水蒸发,第二个热解阶段主要是CS骨架的分解[12]。从第二个热解阶段可以发现,纯壳聚糖的分解温度最高,结合之前的XRD图谱,分析发现这是因为CS具有较高的结晶度,随着CS质量占比的减少,CS-C结晶度呈现先下降而后增加的趋势,因而CS-C热分解温度也呈现先下降而后增加的趋势。其中CS-C-3的结晶度最低,因而其热稳定性也最低。CS-C的DTG曲线及热重数据分别见图3(b)和表1。从DTG曲线可以发现,第二阶段质量损失明显增加,观察到不同比例的改性产物与CS具有类似的曲线变化趋势。但是所有的改性产物都具有比CS较低的分解温度(最大失重速率对应的温度),这可能是由于用7-甲酯酰氯香豆素修饰后结晶度降低所致。同时,随着7-甲酯酰氯香豆素质量占比的增加,CS-C从开始降解的温度到最高降解速率对应的温度期间所耗费的时间减小,表明由于7-甲酯酰氯香豆素的引入,降低了CS分子内强的氢键作用力,导致其热稳定性减弱。
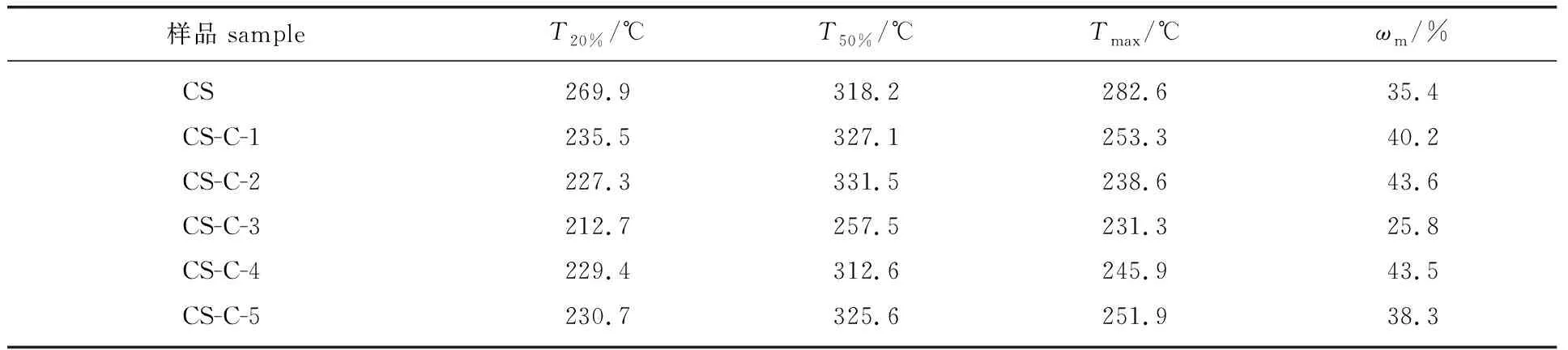
表1 CS以及CS-C的热失重数据1)Table 1 Thermal weight loss data for CS and CS-C
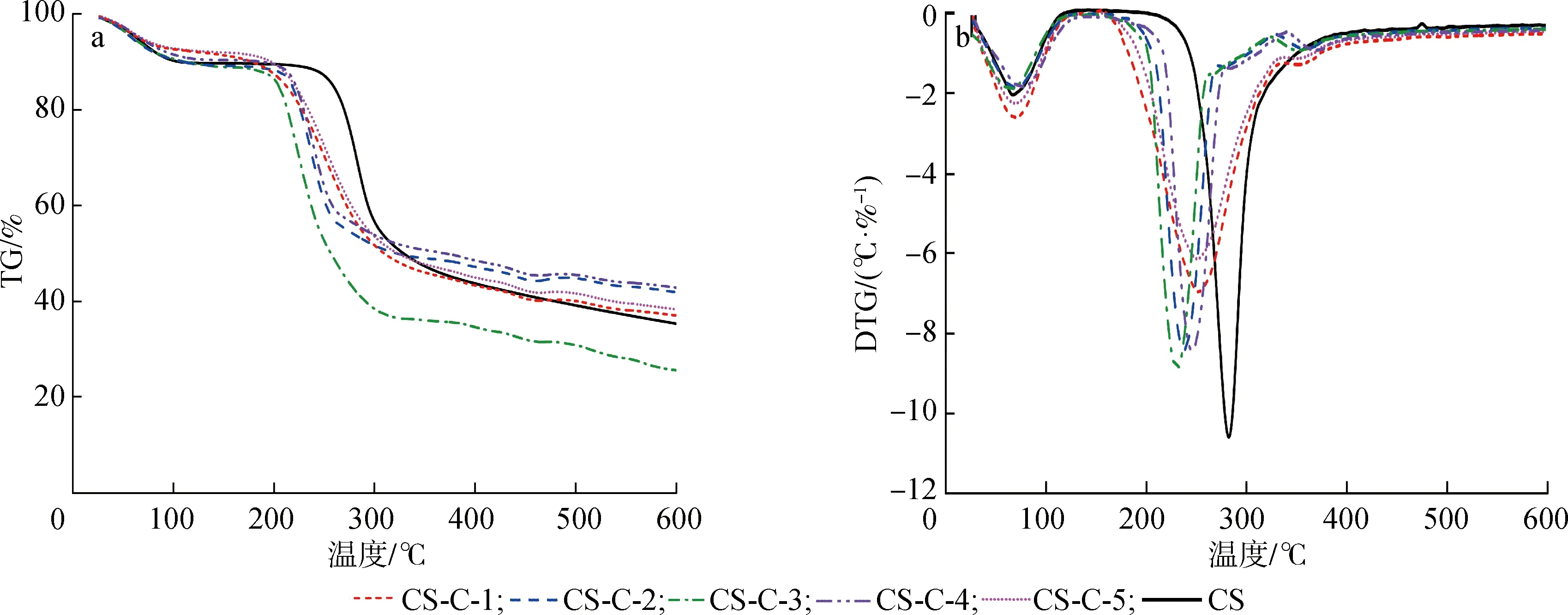
a.TG;b.DTG图3 样品的TG和DTG曲线Fig.3 TG and DTG curves of the samples
2.3.2溶解性能 CS大分子内存在较强的氢键作用力,使得其分子不溶于中性水及有机溶剂;与 7-甲酯酰氯香豆素进行酰胺化反应后,CS分子C2位—NH2逐渐被香豆素分子替代,分子间与分子内的氢键作用逐渐减弱,使得改性壳聚糖分子在水中的溶解度增加。在室温下测试了CS和CS-C在常用有机溶剂中的溶解性,发现CS和CS-C不能溶于甲苯、氯仿、乙醇、二甲基甲酰胺,也不能溶于质量分数1%NaOH溶液。但其在体积分数1%乙酸溶液中表现出良好的溶解性,这可能与其分子链上—NH2质子化形成—NH3+的离子间互斥有关。CS与CS-C在等比例水与二甲基亚砜(DMSO)混合溶液中的溶解情况见图4,对比图中的a和d可以发现:a瓶容器底部可看到明显的沉淀,说明CS在水与DMSO混合溶液中溶解程度较低,而d瓶中溶液较为澄清且容器底部没有沉淀,说明CS-C-3在水与DMSO混合溶液中很好的溶解,这可能是由于CS结晶度降低以及CS的—NH2取代度增大所致。

a.CS;b.CS-C-1;c.CS-C-2;d.CS-C-3;e.CS-C-4;f.CS-C-5图4 样品的溶解性能Fig.4 Dissolution properties of samples
CS与7-甲酯酰氯香豆素质量比为1∶1、 1∶2、 1∶3、 1∶4和1∶5制备的CS-C的溶解度分别为10.4%、 35.1%、 79.7%、 31.8%和9.5%。结合图4,由样品溶解度的数据可知,CS不溶于混合溶液,但其衍生物CS-C是部分溶解于H2O与DMSO混合溶剂的,其溶解能力与—NH2取代程度直接相关,随着DS的增加,CS-C的溶解度从10.4%增加到79.7%,再下降到9.5%,证明了有机溶剂能够溶解CS-C且质量比为1∶3时溶解性能最好。
2.3.3抑菌性能 CS和CS-C-3对大肠杆菌和金黄色葡萄球菌的抑菌能力见图5。由图可知,CS-C-3的试管中的悬浮液均呈现较为澄清的状态,而同浓度的CS试管中的悬浮液却比较浑浊,表明CS-C-3的抗菌活性优于CS,且CS-C-3对于大肠杆菌以及金黄色葡萄球菌的最低抑菌浓度(MIC)分别为0.5和1 g/L。这是因为水溶性壳聚糖的分子具有质子化铵,与细胞膜作用可以吸附和聚沉细胞,同时可以穿过破损的细胞壁进入细胞内部扰乱细胞的正常代谢从而使抑菌效果增强[13]。壳聚糖的氨基与细菌膜表面的脂蛋白结合,导致膜蛋白变性失活,进一步影响了膜对营养物质的运输,细菌膜表面含有丰富的磷壁酸,当壳聚糖与细菌膜结合后,可能会导致细菌膜结构松散,甚至破裂,以此达到抑菌的目的。CS-C-3具有良好的水溶性,能使其分子上的氨基在中性水中更好地电离,进而与细菌细胞膜上更多的负电荷相互作用[14],加快细胞内蛋白酶及其他成分泄露,从而表现出更强的抑菌性。
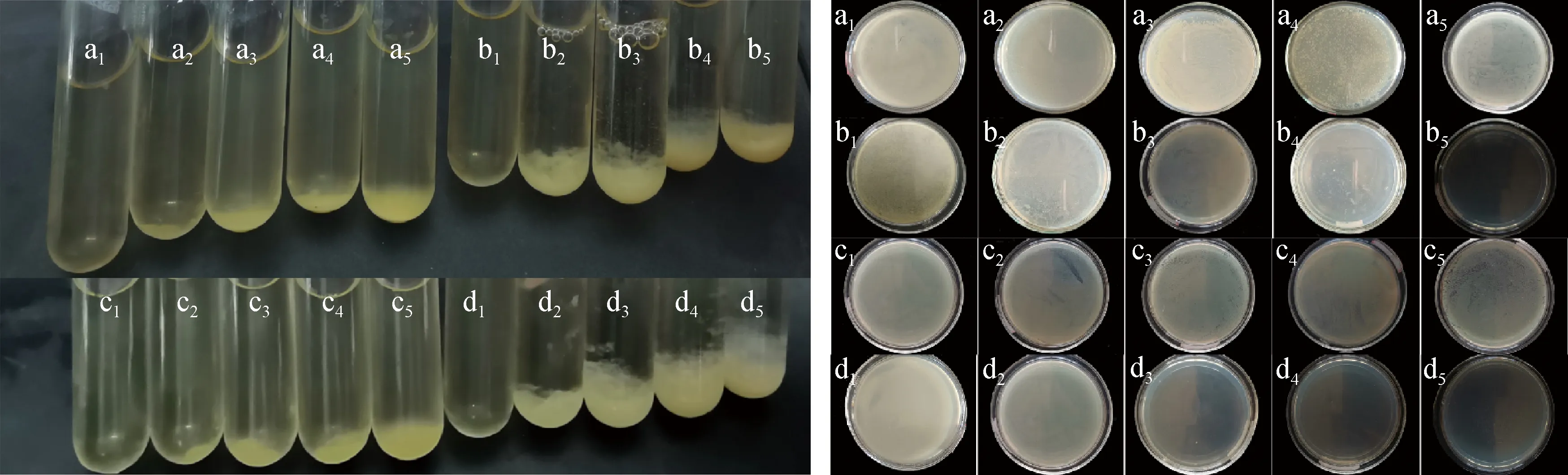
a.CS,E.coli; b.CS-C-3,E.coli; c.CS,S.aureus; d.CS-C-3,S.aureus1.0.25 g/L; 2.0.5 g/L; 3.1 g/L; 4.2 g/L; 5.4 g/L图5 样品的抑菌效果 图6 样品的杀菌效果Fig.5 Bacteriostatic effect of the samples Fig.6 Sterilization effect of samples
CS和CS-C-3对大肠杆菌和金黄色葡萄球菌的杀菌能力见图6。
由图6(a)和(b)可知,含有质量浓度4 g/L CS-C的培养基表面透明,其培养基中几乎没有细菌生长,而同质量浓度的CS培养基表面不清晰,其培养基中有明显的菌落生长现象,表明了CS-C对大肠杆菌的杀菌活性优于CS;同样,在图6(c)和(d)中可以发现,随着CS以及CS-C的浓度提高,培养基表面的透明性逐渐提升,只有含有质量浓度2和4 g/L的CS-C的培养基表面透明,表明此质量浓度对金黄葡萄球菌具有较强的抑菌性。以上研究表明,CS-C-3对大肠杆菌和金黄色葡萄球菌的最小杀菌浓度(MBC)分别为4和2 g/L。这是因为CS-C-3结构中的分子间和分子内的氢键被破坏,降低了其结晶度,提高了CS-C的溶解性,进而增强其抗菌性,同时也说明了在CS中引入酰基可以改善其抗菌性能。
3 结 论
3.1以壳聚糖(CS)、 7-羟基香豆素为主要原料,以草酰氯为桥梁,通过酰化改性和非均相酰胺化反应制备出在中性条件下具有良好溶解性能7-羟基香豆素酰化改性壳聚糖(CS-C)。FT-IR表征表明7-羟基香豆素成功接枝到壳聚糖分子上。
3.2CS-C的XRD、Ds、热稳定性能和溶解性能分析表明:CS中引入7-甲酯酰氯香豆素后其结晶结构被破坏,热稳定性能下降,溶解性能增强,且当CS与7-甲酯酰氯香豆素的质量比为1∶3时CS-C-3的Ds达到峰值,此时CS-C的溶解性能也最好,溶解度可达79.7%;最小抑菌实验结果表明:CS-C的抑菌性比CS强,其中CS-C-3对大肠杆菌与金黄色葡萄球菌的最小抑菌浓度(MIC)分别为0.5和1 g/L;杀菌实验结果表明:CS-C培养基中菌落存活数量明显低于CS培养基中菌落存活数量,CS-C的杀菌性显著大于CS,其中CS-C-3对大肠杆菌和金黄色葡萄球菌的最小杀菌浓度(MBC)分别为4和2 g/L。
