甲状腺癌合并甲状腺功能亢进症患者术后预后调查及相关因素分析
2023-11-24吴永康覃文懿陈伟杰
许 托,吴永康,覃文懿,陈伟杰,张 智
(广东医科大学附属医院血管甲状腺乳腺外科,广东 湛江 524000)
甲状腺癌与放射性损伤、遗传及基因突变等因素相关[1]。近年来随着研究深入,甲状腺癌合并甲状腺功能亢进症(以下简称“甲亢”)备受临床关注,有研究认为甲状腺癌合并甲亢患者的预后较单纯甲状腺癌患者更差[2],手术仍是甲状腺癌合并甲亢的主要治疗方法[3]。但对于手术患者,术后存在甲状腺功能减退或甲状腺癌术后复发等问题,会增加二次手术风险[4]。因此,筛查影响术后预后的危险因素尤为重要。本研究回顾性分析近年于广东医科大学附属医院行手术治疗的82 例甲状腺癌合并甲亢患者的临床资料,调查影响术后预后不良的独立危险因素,以期指导临床优化治疗方案,改善患者预后,现报道如下。
1 资料与方法
1.1 一般资料回顾性分析2017 年6 月至2022 年11 月广东医科大学附属医院收治的82 例甲状腺癌合并甲亢患者的临床资料,患者均接受手术治疗。根据预后不同分为预后良好组(70 例)和预后不良组(12 例)。预后良好组患者中男性42 例,女性28 例;年龄30~65 岁,平均年龄(50.72±12.54)岁;BMI 18.50~26.00 kg/m2,平均BMI(21.65±1.91)kg/m2;甲状腺癌病程1~8 年,平均甲状腺癌病程(3.15±0.93)年;甲亢病程1~8 年,平均甲亢病程(3.23±1.50)年。预后不良组患者中男性8 例,女性4 例;年龄26~68 岁,平均年龄(51.18±13.92)岁;BMI 19.00~25.50 kg/m2,平均BMI(21.78±2.03)kg/m2;甲状腺癌病程1~7 年,平均甲状腺癌病程(3.20±0.96)年;甲亢病程1~7 年,平均甲亢病程(3.27±1.22)年。两组患者一般资料比较,差异无统计学意义(P>0.05),组间具有可比性。本研究经广东医科大学附属医院医学伦理委员会批准。纳入标准:①符合甲状腺癌诊断标准[5],并符合甲亢诊断标准[6]。②患者年龄≥18 岁,均接受手术治疗。③患者临床资料完整。排除标准:①甲状腺癌已发生转移者;②精神意识障碍者或有精神病史者;③妊娠、哺乳期患者。
1.2 研究方法术后进行随访,出院后随访以电话和入院复诊形式进行,在术后半年时记录两组患者手术效果。显效:甲亢症状、体征消失,甲状腺癌无复发,游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)水平正常、促甲状腺激素(TSH)水平正常或降低(服用甲状腺素替代治疗情况下),促甲状腺激素受体抗体(TRAb)水平正常[7]。以术后半年达到显效标准为预后良好,以未达到显效标准为预后不良。
1.3 观察指标①比较两组患者治疗情况。治疗情况包括手术方式及术后并发症。手术方式分为全切术和患侧腺叶加对侧腺叶次全切术(以下简称次全切术),同时行癌灶侧的颈部VI 区淋巴结清扫。术后并发症包括喉返神经损伤、暂时性的甲状旁腺功能低下。②比较两组患者临床特征。临床特征包括肿瘤直径、肿瘤分期[7]及病灶(单发、多发)。③比较两组患者血清指标。采集两组患者入院时和出院后2 周的空腹肘静脉血3 mL,采用离心机(湖南湘仪实验室仪器开发有限公司,型号:L535-1)以2 500 r/min 离心10 min(离心半径10 cm),取血清,采用化学发光免疫分析法检测血清FT3、FT4、TSH、甲状腺球蛋白(Tg)、TRAb 及甲状腺过氧化物酶抗体(TPOAb)水平,试剂盒均由北京源德生物医学工程有限公司提供。④分析甲状腺癌合并甲亢患者术后预后不良的独立危险因素。⑤分析模型对甲状腺癌合并甲亢患者术后预后不良的预测价值。根据Logistic 多因素分析结果建立预测模型,分析模型的预测价值。
1.4 统计学分析采用SPSS 20.0 统计学软件处理数据。计数资料以[例(%)]表示,组间比较采用χ2检验,等级资料比较采用秩和检验;计量资料以()表示,组间比较采用独立样本t检验。多因素分析采用非条件Logistic 逐步回归分析。预测价值采用受试者操作特征(ROC)曲线分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者治疗情况比较两组患者手术方式比较,差异无统计学意义(P>0.05);两组患者术后喉返神经损伤发生率比较,差异无统计学意义(P>0.05);预后良好组患者术后暂时性的甲状旁腺功能低下发生率低于预后不良组,差异有统计学意义(P<0.05),见表1。

表1 两组患者治疗情况比较[例(%)]
2.2 两组患者临床特征指标比较两组患者肿瘤直径和病灶类型比较,差异无统计学意义(P>0.05);预后良好组患者肿瘤分期优于预后不良组,差异有统计学意义(P<0.05),见表2。
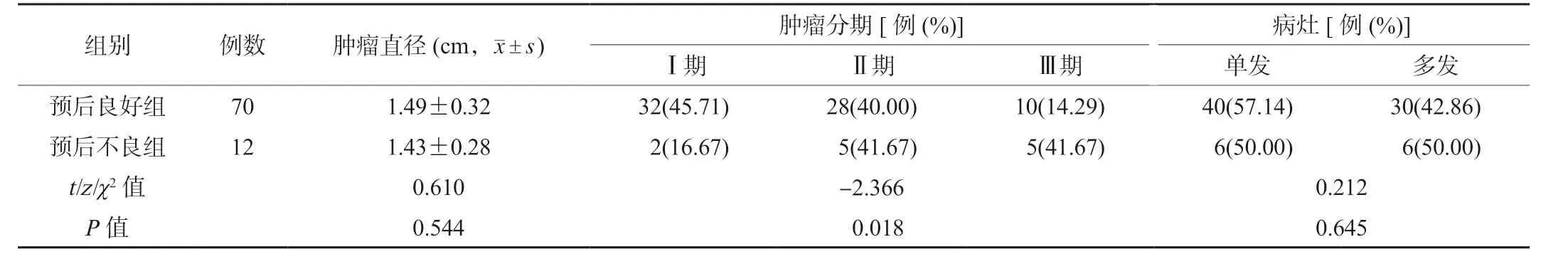
表2 两组患者临床特征指标比较
2.3 两组患者血清指标水平比较两组患者FT3水平比较,差异无统计学意义(P>0.05);预后良好组患者血清FT4、TSH、Tg、TRAb 及TPOAb 水平低于预后不良组,差异有统计学意义(P<0.05),见表3。
表3 两组患者血清指标水平比较()
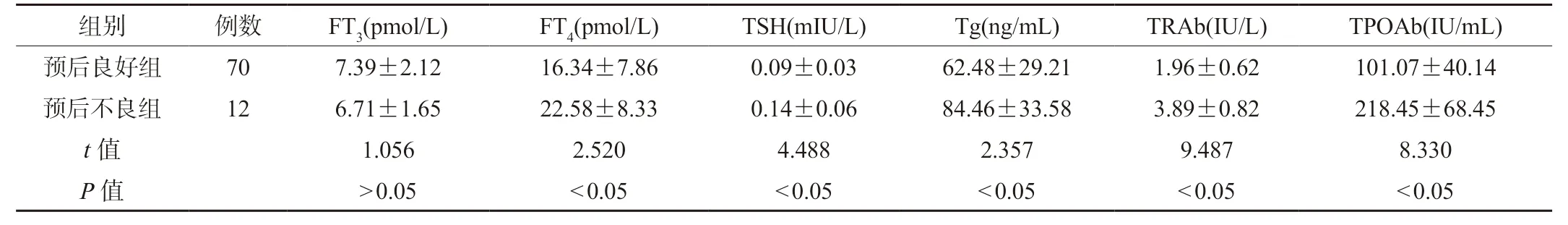
表3 两组患者血清指标水平比较()
注:FT3:游离三碘甲状腺原氨酸;FT4:游离甲状腺素;TSH:促甲状腺激素;Tg:甲状腺球蛋白;TRAb:促甲状腺素受体抗体;TPOAb:甲状腺过氧化物酶抗体。
组别 例数 FT3(pmol/L) FT4(pmol/L) TSH(mIU/L) Tg(ng/mL) TRAb(IU/L) TPOAb(IU/mL)预后良好组 70 7.39±2.12 16.34±7.86 0.09±0.03 62.48±29.21 1.96±0.62 101.07±40.14预后不良组 12 6.71±1.65 22.58±8.33 0.14±0.06 84.46±33.58 3.89±0.82 218.45±68.45 t 值 1.056 2.520 4.488 2.357 9.487 8.330 P 值 >0.05 <0.05 <0.05 <0.05 <0.05 <0.05
2.4 甲状腺癌合并甲亢患者术后预后不良的多因素分析将可能影响甲状腺癌合并甲亢患者术后预后的相关因素赋值,见表4,将赋值后的各因素纳入Logistic 回归模型,分析结果显示,术后出现暂时性的甲状旁腺功能低下、肿瘤分期Ⅲ期、血清Tg 及TRAb 水平升高是甲状腺癌合并甲亢患者术后预后不良的独立危险因素(P<0.05),见表5。

表4 量化赋值表

表5 甲状腺癌合并甲亢患者术后预后不良的多因素Logistic 分析
2.5 预测模型判断甲状腺癌合并甲亢患者术后预后不良的价值分析根据多因素分析结果建立预测模型:Y=0.618×(有无暂时性的甲状旁腺功能低下)+0.841×(肿瘤分期)+0.591×(Tg)+0.771×(TRAb),根据赋值情况计算评分,并以其作为检验变量,以预后情况作为状态变量,绘制ROC曲线,见图1,结果显示该模型判断预后不良的曲线下面积(AUC)为0.821(SE=0.088,95%CI=0.649~0.993,P<0.05),敏感度为0.900,特异度为0.613。

图1 预测模型判断甲状腺癌合并甲亢患者术后预后不良的ROC 曲线
3 讨论
国内调查显示,甲状腺癌患者5 年生存率较高[8]。但随着研究深入发现,甲状腺癌合并甲亢患者预后较单纯甲状腺癌差,且术后可能导致甲状腺功能减退或甲状腺癌复发,影响生活质量和远期生存率[9]。
本研究结果显示,预后良好组患者术后暂时性的甲状旁腺功能低下发生率低于预后不良组,且术后出现暂时性的甲状旁腺功能低下是预后不良的独立危险因素。这可能是因手术对甲状腺局部解剖结构造成破坏,甚至发生不可逆的永久性甲状腺损伤,这成为术后甲状腺功能紊乱和预后不良的诱因。因此,对于次全切手术患者,应注意术后甲状腺功能的保护。本研究结果显示,预后良好组患者肿瘤分期优于预后不良组,且肿瘤分期Ⅲ期是甲状腺癌合并甲亢患者预后不良的独立危险因素。与Ⅰ、Ⅱ期甲状腺癌患者相比,Ⅲ期患者肿瘤已突破被膜,并侵及皮下软组织和喉返神经,更易发生肿瘤增殖和转移,预后更差[10]。本研究结果还显示,预后良好组患者血清FT4、TSH、Tg、TRAb及TPOAb水平低于预后不良组,且Tg和TRAb水平升高是影响预后的独立危险因素。Tg是由甲状腺滤泡分泌的糖蛋白,在甲状腺癌伴甲亢患者中,甲状腺滤泡被破坏,使血清Tg异常升高[11]。TRAb是甲状腺自身抗体,TRAb阳性是甲状腺中央区淋巴结转移的高危因素,陈淑娴等[12]的报道显示,血清TRAb异常升高者术后复发率较高。本研究ROC分析结果也显示,模型对判断不良预后敏感度达0.900,这说明该模型有助于预测甲状腺癌合并甲亢患者不良预后。
综上所述,术后出现暂时性的甲状旁腺功能低下、肿瘤分期为Ⅲ期、血清Tg 及TRAb 水平升高是甲状腺癌合并甲亢患者术后不良预后的独立危险因素,据此建立预测的模型有助于判断预后。
