杭州地区2012~2018年耐甲氧西林金黄色葡萄球菌的分子流行病学特征及其变化趋势
2023-11-24朱云颖王媛肖婷婷嵇金如沈萍肖永红
朱云颖,王媛,肖婷婷,嵇金如,沈萍,肖永红
研究报告
杭州地区2012~2018年耐甲氧西林金黄色葡萄球菌的分子流行病学特征及其变化趋势
朱云颖,王媛,肖婷婷,嵇金如,沈萍,肖永红
浙江大学医学院附属第一医院,传染病重症诊治全国重点实验室,杭州 310003
耐甲氧西林金黄色葡萄球菌(methicillin-resistant,MRSA)是威胁全球的公共卫生问题,给社会和患者造成严重的安全威胁,因此明确MRSA耐药性和时空分布的多态性对于其感染的诊治和防控至关重要。本研究通过收集本院162株MRSA菌株,将所有菌株根据标准区分为社区获得性(community-associated) MRSA (CA-MRSA)和医院获得性(hospital-associated) MRSA (HA-MRSA),利用聚合酶链式反应(polymerase chain reaction,PCR)测定MRSA菌株的多位点序列分型(multilocus sequence typing,MLST),葡萄球菌盒式染色体序列(staphylococcal chromosome cassette mec,SCC)、葡萄球菌A蛋白(staphylococcal protein A,)基因多态性,以及杀白细胞毒素(Panton-Valentine leucocidin,),分析了杭州地区不同年份(2012~2018年) MRSA菌株的分子特征。结果共发现16种ST型和30种型。ST型以ST5型为主(96/162,59.3%),分型以t311型为主(83/162,51.2%)。发现5种SCC分型,以SCCII型最为常见(101/162,61.7%),ST5-II-t311是本地区的第一优势MRSA克隆。2014~2018年,ST5型MRSA的患病率逐渐下降,而ST59型MRSA的患病率上升。同时,本研究检出家畜相关耐甲氧西林金黄色葡萄球菌(livestock-associated methicillin-resistant,LA-MRSA) ST398和ST9。基因阳性MRSA菌株共28株(28/162,17.3%),最常见的阳性克隆是ST59-IVa-t437。CA-MRSA与HA-MRSA相比,ST型为ST5的比例较低(9.1%67.1%,=0.000),ST59的比例较高(63.6%11.4%,=0.000),且CA-MRSA携带阳性基因的可能性更高(36.4%14.3%,=0.028)。上述结果表明,MRSA的分子类型越来越多样化,ST5-II-t311是本地区MRSA的优势克隆,但在2014~ 2018年呈下降趋势,而社区相关性克隆菌株ST59型MRSA在2014~2018年呈逐年上升趋势。
耐甲氧西林金黄色葡萄球菌;社区获得性;医院获得性;分子流行病学;药物敏感性
金黄色葡萄球菌是社区和医院最常见的病原体之一,它能够引起广泛的感染,包括肺炎、败血症、感染性心内膜炎、中毒性休克综合症和坏死性筋膜炎等[1],根据中国细菌耐药监测网(China antimicrobial surveillance network,CHINET)监测报告,金黄色葡萄球菌检出率位于革兰阳性球菌的首位[2],是临床上最严重的致病菌之一。近年来,随着甲氧西林等抗生素的广泛使用,金黄色葡萄球菌耐药性逐渐增加,耐甲氧西林金黄色葡萄球菌逐渐在全球范围内流行。研究表明,耐甲氧西林金黄色葡萄球菌(methicillin-resistant,MRSA)相较于甲氧西林敏感金黄色葡萄球菌具有更高的患病率、致死率、产生更高的医疗费用,给世界公共卫生安全造成巨大威胁[3,4,5]。据报道,在许多亚洲国家,医院中MRSA的流行率高达70%~80%[6,7],而在中国,尽管近年来发现MRSA患病率较前呈下降趋势,但根据监测报告,MRSA每年仍有高达30%以上的流行率[8]。MRSA感染占所有耐药性细菌归因病死率的第2位,且是金黄色葡萄球菌血流感染病死率的独立危险因素[5,9]。不仅如此,由于菌株的不断进化、演变,抗生素的迭代、更新以及不同区域人员之间的迁徙频率增加,MRSA感染变得更加复杂和多样化,给MRSA感染的管理带来了新的挑战。
不同来源、不同区域和不同时间的MRSA菌株具有极大差异。社区获得性MRSA (community- associated methicillin-resistant,CA-MRSA)和医院获得性MRSA(healthcare-associated methicillin-resistant,HA- MRSA)不论是在临床特征或是微生物学方面,都具有很大不同。在过去的10年中,CA-MRSA的患病率呈上升趋势,而HA-MRSA的患病率则呈现下降趋势[10]。在分子流行病学方面,与HA-MRSA不同的是,大多数的CA-MRSA分离株的葡萄球菌染色体基因盒(staphylococcal chromosome cassette mec,SCC)分型为SCCIV或SCCV[11,12]。不仅如此,CA-MRSA被认为具有更强的毒性,因为它们往往具有特定的毒力因子,其中包括有杀白细胞素(Panton-Valentine leucocidin,)以及其他毒力基因[12]。此外,MRSA的分子特征在不同的地区也具有显著的差异性,并且随着时间而变化。例如,在美国,ST8(USA300)是最流行的优势克隆[13],而在许多亚洲国家,ST5和ST239则是最常见的克隆型[14,15]。自2000年以来,亚洲地区主导的ST239 HA-MRSA克隆在医院环境中持续存在并且适应发展了数十年[16],然而,上海的一家综合医院进行的研究表明,主要的HA-MRSA ST239-t030和ST239-t037在2017年被持续增长的ST5-t2460克隆所替代[17]。因此,了解不同地区、不同年份的优势克隆和其耐药性变化具有重要的临床指导意义。
本研究收集了2012~2018年中国杭州浙江大学医学院附属第一医院无菌体液来源(含血液、腹腔积液、胸腔积液、脑脊液及其他无菌部位引流液)的耐甲氧西林金黄色葡萄球菌,通过测定药物敏感性以及分子特征从而深入探讨该地区MRSA分子流行病学特征及变化趋势,为今后临床MRSA感染的防控提供依据。
1 材料与方法
1.1 菌株收集
本研究共收集162株浙江大学医学院附属第一医院自2012年1月~2018年12月期间分离的MRSA。所有菌株均来源于无菌体液,并通过MALDI-TOF MS质谱仪鉴定其为金黄色葡萄球菌,利用头孢西丁纸片法与聚合酶链式反应(polymerase chain reaction,PCR)技术分别确认甲氧西林耐药以及存在基因,进而鉴定为MRSA菌株。如果同一患者相同部位有多次(2次及2次以上)分离到MRSA菌株,本研究只选取首次培养结果。
从浙江大学医学院附属第一医院电子病历系统中收集菌株的基本信息,包括性别、年龄、住院时间、菌株培养时间、住院科室、基础疾病、医疗机构接触史、相关性侵入性操作(包括机械通气、经皮置管、留置胃管、留置导尿、深静脉穿刺等)、血液透析以及是否安装起搏器等。本研究由浙江大学医学院附属第一医院临床研究伦理委员会批准。
1.2 CA-MRSA和HA-MRSA的判定标准
根据美国疾病和预防控制中心(centers for disease control and prevention,CDC)标准,将所有菌株区分为CA-MRSA和HA-MRSA[18,19]。HA-MRSA感染定义为入院48 h后培养到细菌,或既往曾有医疗保健接触史。CA-MRSA感染的定义为:(1)门诊或住院48 h内培养到细菌;(2)既往无MRSA感染或定植史;(3)感染前一年内无医疗相关机构接触史;(4)无透析、手术、留置导管或人工医疗装置。
1.3 药物敏感性测定
使用微量肉汤法和琼脂稀释法测定12种抗生素对162株MRSA菌株的最小抑菌浓度(minimal inhibitory concentration,MIC),从而确定其药物敏感性。抗生素包括:克林霉素(clindamycin,CLI)、红霉素(erythromycin,ERY)、庆大霉素(gentamicin,GEN)、环丙沙星(ciprofloxacin,CIP)、左氧氟沙星(levofloxacin,LVX)、莫西沙星(moxifloxacin,MXF)、利福平(rifampin,RIF)、四环素(tetracycline,TCY)、复方新诺明(trimethoprim/sulfamethoxazole,SXT)、利奈唑胺(linezolid,LZD)、替加环素(tigecycline,TGC)以及万古霉素(vancomycin,VAN)。
1.4 MLST、spa分型及SCCmec分型的鉴定
对7个持家基因(、、、、、、)进行扩增和测序[20,21],测序结果与MLST网站(http://saureus.mlst.net)上的现有序列进行比对并获得相应的序列号,确定每个菌株的ST型。
通过多重PCR方法确定SCC类型[22],根据盒式染色体重组酶(cassette chromosome recombinases,)和类的组合来划分SCC的类型,所有不能被确认为I~V型的MRSA定义为SCCNT。
根据文献对蛋白A基因多态性X区进行扩增和测序[23],测序结果统一于网站http://spa.ridom.de 确定分型。
1.5 PVL基因鉴定
根据文献报道[24],采用PCR方法扩增毒力基因并将产物通过凝胶电泳跑出条带后进行测序确定为基因产物。
1.6 统计分析
使用SPSS 23.0进行统计分析。分类变量用百分比表示,并使用卡方检验进行比较。所有统计检验均为双侧,统计学意义为<0.05。
2 结果与分析
2.1 菌株来源分布
2012年1月~2018年12月期间共得到非重复无菌体液来源MRSA162株,基因检测均为阳性,其中CA-MRSA22株(13.6%),HA-MRSA140株(86.4%)。血流感染、腹腔积液、胸腔积液、脑脊液以及其他无菌穿刺液来源的标本分别占比68.52%、11.73%、6.79%、3.09%以及9.88%。
2.2 分子分型结果
162株MRSA分离株共存在16个ST型。其中占比由高到低的ST型依次是ST5 (96/162,59.3%)、ST59 (30/162,18.5%)和ST398 (8/162,4.9%)。中国原优势克隆(中国原主要的流行克隆之一)ST239仅为3株(表1)。随着时间的推移,ST分型多样性逐渐丰富,2012和2018年ST类型分别为4种和10种(图1)。主要ST型的占比在2014~2018年有明显改变,ST5的感染率从2014年(72.2%)逐渐下降至2018年(32.1%),而ST59的感染率从2014年(5.6%)明显上升至2018年(28.6%)。ST398型在2015年开始出现,而ST9则在2013年开始出现。
共发现5种SCC类型,最常见的类型为II型(100/162,61.7%),其次为IVa型(32/162,19.6%)。有21株菌株未能被归类,定义SCCNT型别(21/162,13.0%)(表1)。
162株细菌中共发现30个型别,其中t311(83/162,51.2%)是主要型别,其次是t437(22/162,13.6%)和t034(8/162,4.9%)(表1)。
结合ST型和SCC分型发现,ST5 MRSA最常存在SCCII型(92/96,95.8%),ST59 MRSA最常存在SCCIVa型(25/30,83.3%)。分析ST-SCC-分型结果,共发现41种ST- SCC-型别组合MRSA,最常见的基因型是ST5-II-t311 (81/162,50.0%),其次是ST59-IVa-t437 (18/162,11.1%),第三是ST398-NT-t034 (7/162,4.3%)。ST5-II-t311 MRSA比例从2014年(66.7%)逐年下降至2018年(21.4%)。
2.3 PVL毒力基因检测结果
PCR检测发现28株MRSA基因阳性(28/162,17.3%),最常见标本类型为血液(20/28,71.4%)。28株阳性菌株中以ST59-IVa-t437型MRSA (8/28,28.6%)最为普遍,其次是ST5-II-t311 (4/28,14.3%)和ST59-NT-t437 (2/28,7.1%) (表2)。
2.4 药物敏感性检测结果
对162株MRSA进行药物敏感性测试,结果显示,所有分离株对万古霉素、替加环素、利奈唑胺敏感,对红霉素(85.2%)、喹诺酮类(环丙沙星(66.0%)、左氧氟沙星(64.2%)、莫西沙星(63.0%))、四环素(42.6%)、克林霉素(30.9%)耐药率较高,对庆大霉素(5.6%)、利福平(3.1%)、复方新诺明(3.1%)耐药率较低(表3)。162株MRSA菌株中有118株(72.8%)对3种及以上抗生素耐药,74株(45.7%)对5种以上的抗生素耐药,11株(6.8%)对7种及以上的抗生素耐药。

表1 162株MRSA的ST-SCCmec-spa分型结果
结合菌株的分子分型信息,ST5 MRSA对于红霉素、喹诺酮类(环丙沙星、左氧氟沙星、莫西沙星)耐药率较高(耐药率>70%),而对于复方新诺明100%敏感。ST59 MRSA对于克林霉素、红霉素耐药率较高(耐药率>70%),对于庆大霉素、利福平、复方新诺明100%敏感。ST239 MRSA对于红霉素100%耐药,对于克林霉素、庆大霉素、环丙沙星、左氧氟沙星、莫西沙星、利福平、四环素耐药率均为66.7%,对于复方新诺明耐药率为33.3%。ST6 MRSA和ST22 MRSA对所有检测的抗生素均敏感。此外,ST5 MRSA有67.7%(65/96)耐多药,即对3类以上抗生素耐药,ST59菌株中仅8株(8/30,26.7%)为耐多药菌株(表4)。
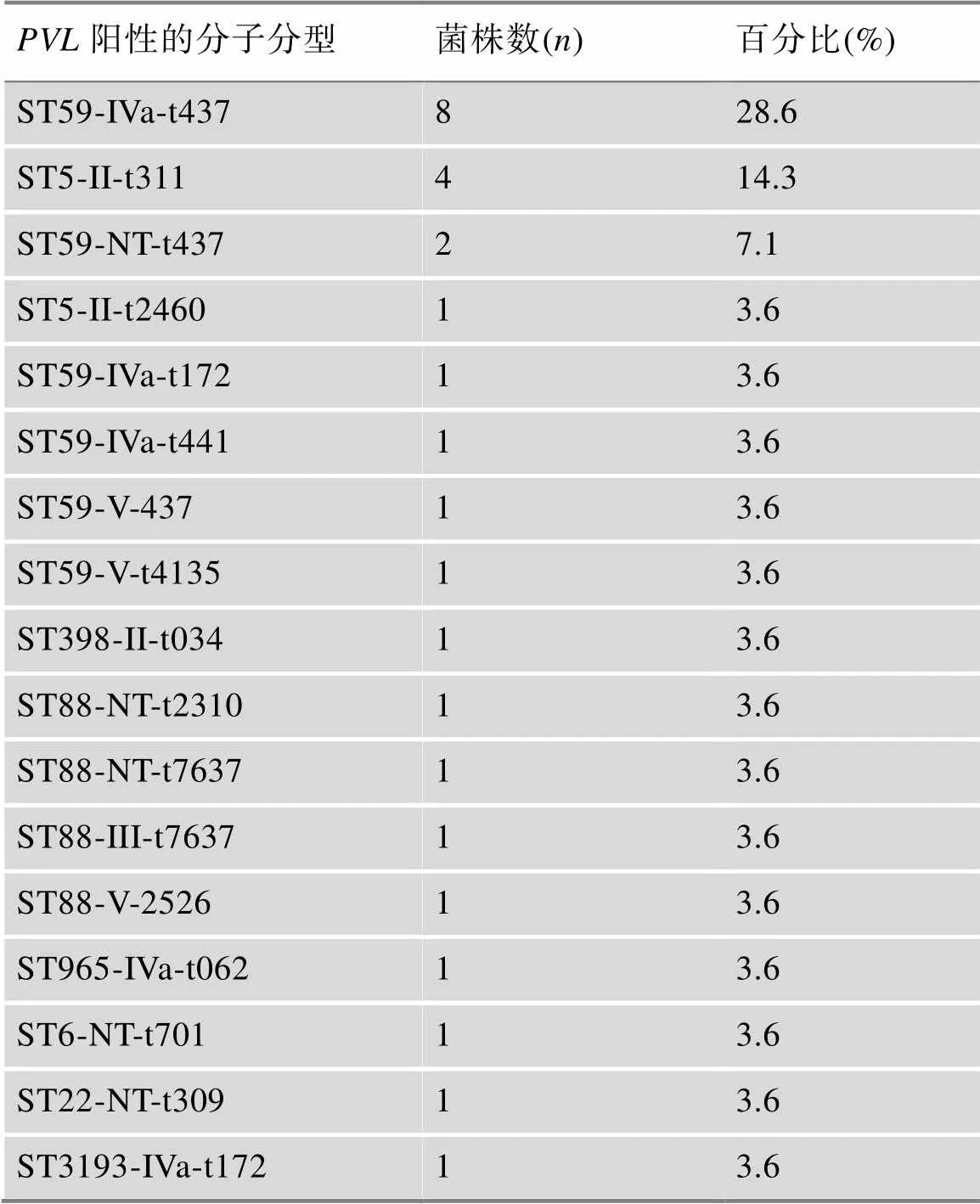
表2 28株PVL阳性MRSA细菌的分子分型

表3 162株对12种抗菌药物的药物敏感性结果
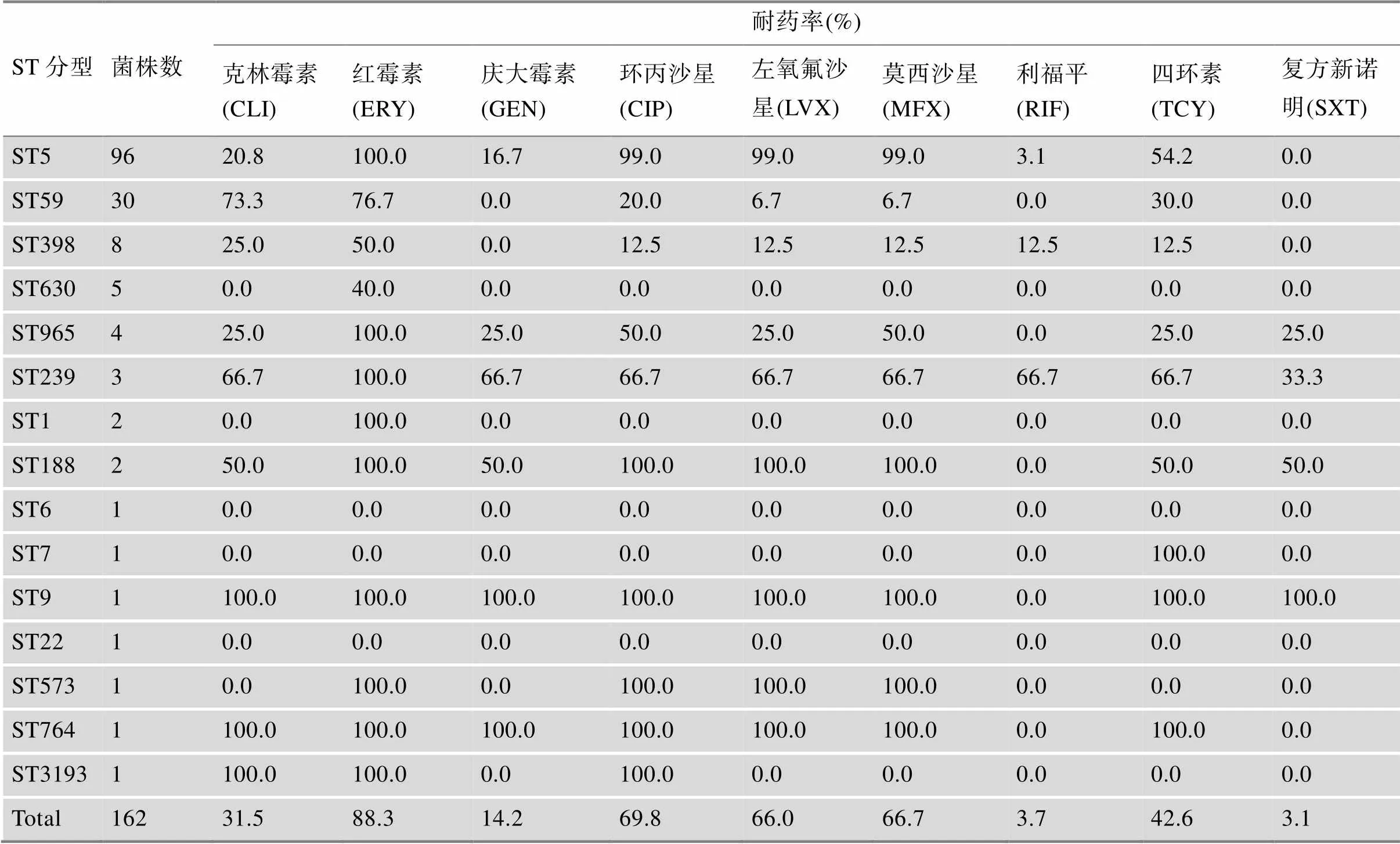
表4 不同ST型MRSA对9种抗生素的耐药率
2.5 CA-MRSA与HA-MRSA的比较
CA-MRSA和HA-MRSA在本研究中表现出不同的分子流行病学和耐药性分布。耐药性方面,研究发现,54.3% (76/140) HA-MRSA菌株被鉴定为MDR,而只有27.3% (6/22) CA-MRSA菌株被鉴定为MDR。CA-MRSA对克林霉素、复方新诺明的耐药性高于HA-MRSA,HA-MRSA对于红霉素、庆大霉素、环丙沙星、左氧氟沙星、莫西沙星、利福平、四环素的耐药性高于CA-MRSA(表5)。
在分子分型方面,本研究中HA-MRSA以SCCII型(98/140,70%)居多,而CA-MRSA以SCCIVa型(14/22,63.6%)居多。与HA-MRSA菌株相比,CA-MRSA携带ST5的概率较低(9.1%67.1%,=0.000),携带ST59的概率较高(63.6%11.4%,=0.000)。CA-MRSA患者携带基因的概率明显高于HA-MRSA患者(36.4%14.3%,=0.028) (表6)。
3 讨论
MRSA是一种重要的病原体,会导致许多危及生命的感染,如败血症、呼吸机相关性肺炎和感染性休克等,是严重的公共卫生问题。既往研究曾表明MRSA感染主要是由几种特殊的克隆型别引起的,这些克隆导致了MRSA在医院的爆发[25],目前,几种特定的医院获得性MRSA和社区获得性MRSA克隆在国际上传播且相互适应,导致了医院和社区环境中的高发病率[26]。此外,MRSA克隆的分布是动态的,随时间变化的,且具有区域性特征[17,27]。我国2011年的一项多中心的研究发现,ST239-III-t030、ST239-III-t037和ST5-II-t002是我国HA-MRSA的优势克隆,但这些主要克隆在不同行政区域的患病率存在显著差异[28]。因此,了解特定区域内MRSA的分子流行病学及其随时间的变化趋势,对于明确该区域优势克隆以及对MRSA的控制和治疗具有重要意义。
本研究对MRSA菌株的分子分型进行了探索。研究发现MRSA菌株的分型在杭州地区2012~2018年间发生了变化,首先体现在分子分型多样性的变化,2012年共有4种ST型被发现,而2018年有10种ST型被发现,这表明了随着时间的推进,分子分型逐渐变得更加丰富。其次,本研究还发现,6年中最常见的MRSA克隆是ST5-II-t311 (81/162,50.0%),其次是ST59-IVa-t437 (18/162,11.1%),第三是ST398- NT-t034 (7/162,4.3%)。ST5 MRSA的占比正在下降,而ST59作为第二优势的ST型比例正在增加。
本研究进一步发现ST5 MRSA是目前本地区最常见的ST型别,既往报道发现ST5-II MRSA克隆是许多国家最主要的基因型之一[29,30]。在我国,也已有研究表明[31],ST5是2012~2013年中国浙江省HA-MRSA的优势克隆。然而,一些研究者对于ST5 MRSA最主要存在的类型发现了不同的结果。有部分学者认为ST5 MRSA中,t002是主要的型别[32],而另一部分学者发现了不同的研究结果[33]。一项2012 ~2013年的研究表明ST5-II-t311已成为浙江省杭州市HA-MRSA的主要克隆,即t311为该时间段内ST MRSA最主要的型别[33]。而在本研究中,ST5-t311 MRSA相较于ST5-t002 MRSA更加流行,ST5 MRSA菌株中t311是第一优势型,t002是第二优势型。此外,在变化趋势方面,本研究中ST5-II-t311的占比由2014年的66.7%(12/18)下降至2018年的21.4%(6/28),而ST5-II-t2460的占比则略有上升。既往文献[34]甚至发现ST5-t2460是引起血液感染金黄色葡萄球菌中最常见的克隆,这在中国以前从未被报道过。因此,ST5-II-t2460是否被赋予了更多的竞争优势值得进一步的探索。

表5 CA-MRSA和HA-MRSA对于抗生素的药物敏感性分布

表6 CA-MRSA和HA-MRSA的分子流行病学分布
本研究结果发现,ST59是除ST5外最常见的ST型,同时证实CA-MRSA可能逐渐向医院传播。既往的研究表明ST59是亚洲地区主要的CA-MRSA型别[4],且ST59 MRSA可能从社区传播到医院[31,35]。同样,在本研究中,ST59克隆表现出逐渐增加甚至取代ST5成为最主要ST型别的趋势,较高的SCCIV/V和阳性率高则证实了这一观点[28]。种种现象均提示,需要更多地注意ST59在医院的传播。值得注意的是,之前的研究表明ST239-III-t030和ST239-III-t037是中国最普遍的MRSA克隆[28]。然而本研究只发现了3株ST239 MRSA,这说明ST239在中国的发病率可能正在逐渐降低,也有学者在既往文献中发现了类似现象[33]。进一步探究ST239 MRSA发生率较前减少的原因,有可能是因为ST239-t030 MRSA较ST59-t437 MRSA具有较低的生长速度和竞争优势,即便ST239 MRSA常被认为是高耐药性菌株[36]。
ST398 MRSA常被定义为家畜相关耐甲氧西林金黄色葡萄球菌(livestock-associated methicillin- resistant,LA-MRSA),多在欧洲[37]和北美洲[38]的猪、农民及相关环境[39]中被发现。有趣的是,本研究中发现了8株ST398 MRSA(4.9%),在所有ST型MRSA中排名第三。除ST398外,ST9也是LA-MRSA常见的ST型别之一,ST9 MRSA在猪中报道较多而在人类中很少报道。然而,本研究通过分子分型鉴定出了一株ST9 MRSA,这值得引起人们后续对于ST9的关注。
不仅如此,CA-MRSA和HA-MRSA在本研究中表现出不同的分子流行病学和耐药性分布。本研究中HA-MRSA以SCCII型(98/140,70%)居多而CA-MRSA以SCCIVa型(14/22,63.6%)居多。有文献认为SCCIV和SCCV常与CA-MRSA相关,SCCIV和SCCV型只携带对β-内酰胺类抗生素耐药的基因而缺乏对非β-内酰胺类抗生素的耐药基因[40]。本研究中HA-MRSA相较于CA-MRSA,耐多药的比例更高,54.3% (76/140) HA- MRSA菌株被鉴定为MDR而只有27.3% (6/22) CA- MRSA菌株被鉴定为MDR,也验证了这一观点。
是由基因和基因相关的一种毒素,被认为与CA-MRSA存在相关性,在许多疾病,尤其是坏死性肺炎中发挥作用。本研究中发现,CA-MRSA患者携带基因的概率明显高于HA-MRSA患者(36.4%14.3%,=0.028)。然而目前对于CA-MRSA起源和毒力的作用还存在争议,有观点认为既不是CA-MRSA克隆出现的关键因素,也不是CA-MRSA菌株毒力的主要决定因素,因此,是否影响CA-MRSA的临床表现,疾病严重程度和预后还需要进一步探索。
综上所述,2012~2018年间,MRSA分子型别更加多样化。ST5-II-t311是杭州地区MRSA分离株的优势克隆,但在2014~2018年间呈下降趋势。社区相关ST59 MRSA呈上升趋势,LA-MRSA也已经有较高占比。不同类型MRSA细菌耐药性存在较大差异。应定期监测MRSA的流行情况及耐药情况,采取有效措施预防和控制医院感染的发生。
[1] Mehraj J, Witte W, Akmatov MK, Layer F, Werner G, Krause G. Epidemiology of Staphylococcus aureus nasal carriage patterns in the community., 2016, 398: 55–87.
[2] Hu FP, Guo Y, Zhu DM, Wang F, Jiang XF, Xu YC, Zhang XJ, Zhang ZX, Ji P, Xie Y, Kang M, Wang CQ, Wang AM, Xu YH, Shen JL, Sun ZY, Chen ZJ, Ni YX, Sun JY, Chu YZ, Tian SF, Hu ZD, Li J, Yu YS, Lin J, Shan B, Du Y, Guo SF, Wei LH, Zou FM, Zhang H, Wang C, Hu YJ, Ai XM, Zhuo C, Su DH, Wang RZ, Fang H, Yu BX, Zhao Y, Gong P, Guo DW, Zhao JY, Liu WE, Li YM, Jin Y, Shao CH, Wen KZ, Zhang YR, Xu XS, Yan C, Yu H, Huang XN, Wang SM, Chu YF, Zhang LX, Ma J, Zhou SP, Zhou Y, Zhu L, Meng JH, Dong F, Zheng HY, Shen H, Zhou WQ, Jia W, Li G, Wu JS, Lu YM, Li JH, Liu JS, Liao LF, Gu HQ, Jiang L, He W, Xue SH, Feng J, Dou R, Yue CL. CHINET surveillance of bacterial resistance in China: 2018 report., 2020, 20(1): 1–10. 胡付品, 郭燕, 朱德妹, 汪复, 蒋晓飞, 徐英春, 张小江, 张朝霞, 季萍, 谢轶, 康梅, 王传清, 王爱敏, 徐元宏, 沈继录, 孙自镛, 陈中举, 倪语星, 孙景勇, 褚云卓, 田素飞, 胡志东, 李金, 俞云松, 林洁, 单斌, 杜艳, 郭素芳, 魏莲花, 邹凤梅, 张泓, 王春, 胡云建, 艾效曼, 卓超, 苏丹虹, 汪瑞忠, 房华, 俞碧霞, 赵勇, 龚萍, 郭大文, 赵金英, 刘文恩, 李艳明, 金炎, 邵春红, 温开镇, 张贻荣, 徐雪松, 鄢超, 喻华, 黄湘宁, 王山梅, 楚亚菲, 张利侠, 马娟, 周树平, 周艳, 朱镭, 孟晋华, 董芳, 郑红艳, 沈瀚, 周万青, 贾伟, 李刚, 吴劲松, 卢月梅, 李继红, 刘江山, 廖龙凤, 顾洪芹, 姜琳, 贺雯, 薛顺虹, 冯佼, 窦睿, 岳春雷. 2018年CHINET中国细菌耐药性监测. 中国感染与化疗杂志, 2020, 20(1): 1–10.
[3] Wang D, Xie KP, Zou D, Meng MZ, Xie MJ. Inhibitory effects of silybin on the efflux pump of methicillin- resistant Staphylococcus aureus., 2018, 18(1): 827–833.
[4] Lakhundi S, Zhang KY. Methicillin-resistant Staphylococcus aureus: molecular characterization, evolution, and epidemiology., 2018, 31(4): e00020– 18.
[5] Cassini A, Högberg LD, Plachouras D, Quattrocchi A, Hoxha A, Simonsen GS, Colomb-Cotinat M, Kretzschmar ME, Devleesschauwer B, Cecchini M, Ouakrim DA, Oliveira TC, Struelens MJ, Suetens C, Monnet DL. Burden of AMR Collaborative Group. Attributable deaths and disability-adjusted life-years caused by infections with antibiotic-resistant bacteria in the EU and the European Economic Area in 2015: a population-level modelling analysis., 2019, 19(1): 56–66.
[6] Boyce JM, Cookson B, Christiansen K, Hori S, Vuopio-Varkila J, Kocagöz S, Oztop AY, Vandenbroucke- Grauls CMJE, Harbarth S, Pittet D. Meticillin-resistant Staphylococcus aureus., 2005, 5(10): 653–663.
[7] Song JH, Hsueh PR, Chung DR, Ko KS, Kang CI, Peck KR, Yeom JS, Kim SW, Chang HH, Kim YS, Jung SI , Son JS, So TM, Lalitha MK, Yang YH, Huang SG, Wang H, Lu Q, Carlos CC, Perera JA, Chiu CH, Liu JW, Chongthaleong A, Thamlikitkul V, Van PH; ANSORP Study Group. Spread of methicillin-resistant Staphylococcus aureus between the community and the hospitals in Asian countries: an ANSORP study., 2011, 66(5): 1061–1069.
[8] Hu FP, Guo Y, Zhu DM, Wang F, Jiang XF, Xu YC, Zhang XJ, Zhang CX, Ji P, Xie Y, Kang M, Wang CQ, Wang AM, Xu YH, Shen JL, Sun ZY, Chen ZJ, Ni YX, Sun JY, Chu YZ, Tian SF, Hu ZD, Li J, Yu YS, Lin J, Shan B, Du Y, Han Y, Guo S, Wei LH, Wu L, Zhang H, Kong J, Hu YJ, Ai XM, Zhuo C, Su DH, Yang Q, Jia B, Huang W. Resistance trends among clinical isolates in China reported from CHINET surveillance of bacterial resistance, 2005-2014., 2016, 22(Suppl 1): S9–S14.
[9] Holland TL, Arnold C, Fowler VG Jr. Clinical management of Staphylococcus aureus bacteremia: a review., 2014, 312(13): 1330–1341.
[10] David MZ, Daum RS, Bayer AS, Chambers HF, Fowler VG Jr, Miller LG, Ostrowsky B, Baesa A, Boyle-Vavra S, Eells SJ, Garcia-Houchins S, Gialanella P, Macias-Gil R, Rude TH, Ruffin F, Sieth JJ, Volinski J, Spellberg B. Staphylococcus aureus bacteremia at 5 US academic medical centers, 2008-2011: significant geographic variation in community-onset infections., 2014, 59(6): 798–807.
[11] Matouskova I, Janout V. Current knowledge of methicillin- resistant Staphylococcus aureus and community- associated methicillin-resistant Staphylococcus aureus., 2008, 152(2): 191–202.
[12] Wang X, Liu Q, Zhang H, Li X, Huang WC, Fu QH, Li M. Molecular characteristics of community-associated Staphylococcus aureus isolates from pediatric patients with bloodstream infections between 2012 and 2017 in Shanghai, China., 2018, 9: 1211.
[13] Molton JS, Tambyah PA, Ang BSP, Ling ML, Fisher DA. The global spread of healthcare-associated multidrug- resistant bacteria: a perspective from Asia., 2013, 56(9): 1310–1318.
[14] Liu YD, Wang H, Du N, Shen E, Chen HB, Niu JQ, Ye HF, Chen MJ. Molecular evidence for spread of two major methicillin-resistant Staphylococcus aureus clones with a unique geographic distribution in Chinese hospitals., 2009, 53(2): 512–518.
[15] Ko KS, Lee JY, Suh JY, Oh WS, Peck KR, Lee NY, Song JH. Distribution of major genotypes among methicillin- resistant Staphylococcus aureus clones in Asian countries., 2005, 43(1): 421–426.
[16] Baines SL, Holt KE, Schultz MB, Seemann T, Howden BO, Jensen SO, van Hal SJ, Coombs GW, Firth N, Powell DR, Stinear TP, Howden BP. Convergent adaptation in the dominant global hospital clone ST239 of methicillin- resistant Staphylococcus aureus., 2015, 6(2): e00080.
[17] Dai YX, Liu JL, Guo W, Meng HW, Huang Q, He L, Gao QQ, Lv HY, Liu Y, Wang YN, Wang H, Liu Q, Li M. Decreasing methicillin-resistant Staphylococcus aureus (MRSA) infections is attributable to the disappearance of predominant MRSA ST239 clones, Shanghai, 2008–2017., 2019, 8(1): 471–478.
[18] Kale P, Dhawan B. The changing face of community- acquired methicillin-resistant Staphylococcus aureus., 2016, 34(3): 275–285.
[19] Kallen AJ, Mu Y, Bulens S, Reingold A, Petit S, Gershman K, Ray SM, Harrison LH, Lynfield R, Dumyati G, Townes JM, Schaffner W, Patel PR, Fridkin SK, Active Bacterial Core surveillance (ABCs) MRSA Investigators of the Emerging Infections Program. Health care-associated invasive MRSA infections, 2005-2008., 2010, 304(6): 641–648.
[20] Aanensen DM, Spratt BG. The multilocus sequence typing network: mlst. net., 2005, 33(Web Server issue): W728–W733.
[21] Maiden MC, Bygraves JA, Feil E, Morelli G, Russell JE, Urwin R, Zhang Q, Zhou J, Zurth K, Caugant DA, Feavers IM, Achtman M, Spratt BG. Multilocus sequence typing: a portable approach to the identification of clones within populations of pathogenic microorganisms., 1998, 95(6): 3140–3145.
[22] Kondo Y, Ito T, Ma XX, Watanabe S, Kreiswirth BN, Etienne J, Hiramatsu K. Combination of multiplex PCRs for staphylococcal cassette chromosome mec type assignment: rapid identification system for mec, ccr, and major differences in junkyard regions., 2007, 51(1): 264–274.
[23] Koreen L, Ramaswamy SV, Graviss EA, Naidich S, Musser JM, Kreiswirth BN. spa typing method for discriminating among Staphylococcus aureus isolates: implications for use of a single marker to detect genetic micro- and macrovariation., 2004, 42(2): 792–799.
[24] Larsen AR, Stegger M, Sørum M. spa typing directly from a mecA, spa and pvl multiplex PCR assay-a cost-effective improvement for methicillin-resistant Staphylococcus aureus surveillance., 2008, 14(6): 611–614.
[25] Enright MC, Robinson DA, Randle G, Feil EJ, Grundmann H, Spratt BG. The evolutionary history of methicillin- resistant Staphylococcus aureus (MRSA)., 2002, 99(11): 7687–7692.
[26] Li M, Du X, Villaruz AE, Diep BA, Wang DC, Song Y, Tian YR, Hu JH, Yu FY, Lu Y, Otto M. MRSA epidemic linked to a quickly spreading colonization and virulence determinant., 2012, 18(5): 816–819.
[27] David MZ, Daum RS. Community-associated methicillin- resistant Staphylococcus aureus: epidemiology and clinical consequences of an emerging epidemic., 2010, 23(3): 616–687.
[28] Xiao M, Wang H, Zhao Y, Mao LL, Brown M, Yu YS, O'Sullivan MVN, Kong FR, Xu YC. National surveillance of methicillin-resistant Staphylococcus aureus in China highlights a still-evolving epidemiology with 15 novel emerging multilocus sequence types., 2013, 51(11): 3638–3644.
[29] Aires de Sousa M, de Lencastre H, Santos Sanches I, Kikuchi K, Totsuka K, Tomasz A. Similarity of antibiotic resistance patterns and molecular typing properties of methicillin-resistant Staphylococcus aureus isolates widely spread in hospitals in New York City and in a hospital in Tokyo, Japan., 2000, 6(3): 253–258.
[30] Chung M, Dickinson G, De Lencastre H, Tomasz A. International clones of methicillin-resistant Staphylococcus aureus in two hospitals in Miami, Florida., 2004, 42(2): 542–547.
[31] Wu DD, Wang ZG, Wang HP, Sun L, Chen Y, Ji SJ, Shi KR, Yu YS. Predominance of ST5-II-t311 clone among healthcare-associated methicillin-resistant Staphylococcus aureus isolates recovered from Zhejiang, China., 2018, 71: 107–112.
[32] Chen CJ, Huang YC, Su LH, Wu TL, Huang SH, Chien CC, Chen PY, Lu MC, Ko WC. Molecular epidemiology and antimicrobial resistance of methicillin-resistant Staphylococcus aureus bloodstream isolates in Taiwan, 2010., 2014, 9(6): e101184.
[33] Kong HS, Yu F, Zhang WL, Li XF, Wang HX. Molecular epidemiology and antibiotic resistance profiles of methicillin-resistant Staphylococcus aureus strains in a tertiary hospital in China., 2017, 8: 838.
[34] Li XH, Fang F, Zhao J, Lou N, Li CL, Huang T, Li YR. Molecular characteristics and virulence gene profiles of Staphylococcus aureus causing bloodstream infection., 2018, 22(6): 487–494.
[35] Chen X, Sun KD, Luo QQ, Duan YT, Chen FX. Emergence and spread of pvl-positive genotypic CA-MRSA ST59 with increased adhesion capacity from wounds in hospitals., 2019, 79(6): 612–625.
[36] Li SG, Sun SJ, Yang CT, Chen HB, Yin YY, Li HN, Zhao CJ, Wang H. The changing pattern of population structure of Staphylococcus aureus from bacteremia in China from 2013 to 2016: ST239-030-MRSA replaced by ST59-t437., 2018, 9: 332.
[37] Molla B, Byrne M, Abley M, Mathews J, Jackson CR, Fedorka-Cray P, Sreevatsan S, Wang P, Gebreyes WA. Epidemiology and genotypic characteristics of methicillin- resistant Staphylococcus aureus strains of porcine origin., 2012, 50(11): 3687–3693.
[38] Khanna T, Friendship R, Dewey C, Weese JS. Methicillin resistant Staphylococcus aureus colonization in pigs and pig farmers., 2008, 128(3–4): 298–303.
[39] Verhegghe M, Pletinckx LJ, Crombé F, Vandersmissen T, Haesebrouck F, Butaye P, Heyndrickx M, Rasschaert G. Methicillin-resistant Staphylococcus aureus (MRSA) ST398 in pig farms and multispecies farms., 2013, 60(5): 366–374.
[40] Ma XX, Ito T, Tiensasitorn C, Jamklang M, Chongtrakool P, Boyle-Vavra S, Daum RS, Hiramatsu K. Novel type of staphylococcal cassette chromosome mec identified in community-acquired methicillin-resistant Staphylococcus aureus strains., 2002, 46(4): 1147–1152.
Molecular epidemiology and change trend of methicillin-resistantfrom invasive infections of a hospital in Hangzhou from 2012 to 2018
Yunying Zhu, Yuan Wang, Tingting Xiao, Jinru Ji, Ping Shen, Yonghong Xiao
The disease caused by methicillin-resistant(MRSA) is a global public health challenge that threatens society and patients seriously. Therefore, the molecular epidemiology and change trend of MRSA is essential for the control and treatment of diseases caused by the pathogen in their regions. To explore molecular epidemiology of MRSA in Hangzhou, we collected 162 MRSA isolates from 2012 to 2018, conducted the antimicrobial susceptibility and used polymerase chain reaction(PCR) to test the molecular typing including multilocus sequence typing (MLST), staphylococcal chromosome cassette mec (SCC), staphylococcal protein A (A) and Panton-Valentine leucocidin (). All the strains was divided into community-associated MRSA (CA-MRSA) or hospital-associated MRSA (HA-MRSA). 162 MRSA isolates were divided into 16 STs and 30types. The major ST type was ST5 (96/162, 59.3%) and the predominanttype was t311 (83/162, 51.2%). Five SCCtypes were found and the most common SCCtype was type II (101/162, 61.7%). ST5-II-t311 was the predominant MRSA clone. And the prevalence of ST5 MRSA gradually declined from 2014 to 2018 but the prevalence of ST59 MRSA significantly increased. At the same time, livestock-associated methicillin-resistant(LA-MRSA) ST398 and ST9 were detected. Twenty-eight isolates weregene positive (28/162, 17.3%). The most prevalent-positive clone was ST59-IVa-t437. Comparing with HA-MRSA, CA-MRSA had a lower probability of ST5 (9.1%67.1%,=0.000) but a higher probability of ST59 (63.6%11.4%,=0.000), not only that, it was more likely to carrying-positive gene (36.4%14.3%,=0.028). In summary, the molecular types of MRSA were getting complex over time. ST5-II-t311 was the predominant clone of MRSA isolate with a downward incidence from 2014 to 2018. ST59 MRSA strains, which is thought community related strain are spreading into hospitals and has an upward incidence from 2014 to 2018.
methicillin-resistant; molecular characterization; community-associated; hospital-associated; antimicrobial susceptibility
2023-06-19;
2023-09-09;
2023-09-20
国家自然科学基金项目(编号:81971984),浙江省重点研发计划(编号:2021C03068)和济南微生态生物医学山东省实验室研究项目(编号:JNL-2022006B)资助[Supported by the National Natural Science Foundation of China (No. 81971984), the the Key Research and Development program of Zhejiang province (No. 2021C03068), and the Research Project of Jinan Microecological Biomedicine Shandong Laboratory (No. JNL-2022006B).]
朱云颖,硕士,医师,研究方向:传染病学。E-mail: 21818043@zju.edu.cn
肖永红,博士,教授,研究方向:传染病学。E-mail: xiao-yonghong@163.com
10.16288/j.yczz.23-166
(责任编委: 谢建平)