两起发热伴血小板减少综合征聚集性疫情流行病学及病原学分析
2023-11-24杨鑫武永祥冷昱李佳宸王超杰袁义美王震张兰黎浩刘玮
杨鑫,武永祥,冷昱,李佳宸,王超杰,袁义美,王震,张兰,黎浩,刘玮
研究报告
两起发热伴血小板减少综合征聚集性疫情流行病学及病原学分析
杨鑫1,武永祥1,冷昱1,李佳宸2,王超杰1,袁义美3,王震3,张兰3,黎浩1,刘玮1
1. 军事医学研究院微生物流行病研究所,病原微生物生物安全全国重点实验室,媒介生物危害和自然疫源性疾病北京市重点实验室,北京 100071 2. 北部战区疾病预防控制中心,沈阳 110034 3. 信阳一五四医院,信阳 464000
发热伴血小板减少综合征(severe fever with thrombocytopenia syndrome, SFTS)是一种新发传染病,主要通过蜱虫叮咬传播,其病原体为发热伴血小板减少综合征病毒(severe fever with thrombocytopenia syndrome virus, SFTSV)。人际传播引发的SFTS聚集性疫情在国内外均有报道,人们重点关注了人际传播的感染途径,然而SFTS聚集性疫情和病毒基因型之间的相关性研究却未见报道。本文主要报道了2022~2023年河南省信阳市发生的两起SFTS聚集性疫情,探讨了SFTSV出现人际传播感染的可能途径,并对SFTS聚集性疫情与病毒基因型进行了关联分析。通过4例确诊患者的病毒序列分析,发现两起聚集性疫情中的2组SFTSV分别聚集在隶属于不同基因型的两个分支。将本研究病毒序列与GenBank中获得的SFTS聚集性疫情报道过的病毒序列进行系统发育分析,进一步发现人际传播病例报道的SFTSV涉及3种基因型,提示SFTS聚集性疫情的发生可能和病毒基因型无明显关联。本研究表明血液接触感染可能是SFTS聚集性疫情发生的主要传播途径,为揭示SFTS聚集性疫情的人际传播链提供了遗传学证据,为SFTS的人际传播防控提供了科学数据支撑。
发热伴血小板减少综合征;蜱传疾病;人际传播;遗传分析
发热伴血小板减少综合征(severe fever with thrombocytopenia syndrome, SFTS)是一种以发热、血小板和白细胞减少为主要临床特征的新发病毒性传染病,2009年首次在我国河南省被报道,主要通过蜱虫叮咬传播,病死率高达30%[1]。SFTS的病原体为发热伴血小板减少综合征病毒(severe fever with thrombocytopenia syndrome virus,SFTSV),属于布尼亚病毒目(Bunyavirales)白纤病毒科(Phenuiviridae)班达病毒属(),是一种分节段的负链RNA病毒,具有多种基因型,其基因组包含L、M、S三个节段,分别编码RNA聚合酶、糖蛋白、核蛋白及非结构蛋白。近年来,SFTS发病率逐渐上升,SFTSV通过人际传播引发的SFTS聚集性疫情在国内外均有报道[2~14]。已有研究表明,接触SFTS患者血液是引发SFTSV感染的高危因素[15],暴露于其他途径(如尿液、呼吸道分泌物、粪便等)也存在传播可能[16~18]。迄今为止,人们对SFTS聚集性疫情的报道主要关注其流行病学特征,对聚集性疫情的发生与SFTSV基因型的相关性研究则未见报道。2022~2023年,河南省信阳市发生两起SFTS聚集性疫情,本研究基于哨点医院监测,结合流行病学调查方法、病毒分子检测与序列分析,探讨了两起疫情的流行过程及病原溯源结果,评估了SFTSV经血液接触传播的感染风险,为论证SFTSV引发人际传播提供了遗传学证据。此外,本研究首次将获得的SFTSV序列与此前报道的SFTS聚集性疫情中涉及的病毒序列一起构建进化树,描述了SFTS聚集性疫情和SFTSV基因型之间的遗传相关性。
1 对象与方法
1.1 研究对象
2022年5月~2023年5月,河南省信阳市发生两起SFTS聚集性疫情,均就诊于河南省信阳一五四医院。研究对象来自两次聚集性疫情涉及的SFTSV感染者和密切接触者(密接),共计10人。本研究已通过河南省信阳一五四医院伦理委员会批准,征得患者或家属同意并签署了知情同意书。
1.2 疾病定义
病例定义:(1)确诊病例:SFTS临床诊断标准依照国家卫生部颁发的《发热伴血小板减少综合征防治指南》2010版本执行。即,患者符合任意流行病学史:流行季节在丘陵、林区及山地等地工作、生活或旅游;发病前2周内有蜱虫叮咬史;或出现临床症状如发热、外周血血小板或白细胞计数降低。且同时具有以下任意实验室检测结果:病例标本核酸检测阳性;SFTSV IgG阳转或在恢复期滴度4倍及4倍以上升高;病例标本中分离出SFTSV。即被诊断为SFTS确诊病例。(2)疑似病例:本研究中参加两次疫情首发死亡病例丧事人员中出现发热等临床表现且实验室检测外周血血小板和白细胞计数降低者。(3)密切接触者(密接):参加两次疫情首发死亡病例护理及丧事的人员中,未出现不适症状者。
1.3 临床资料收集
参照病例定义,开展病例主动搜索,采用现场流行病学调查(流调)、电话流调开展个案调查和聚集性疫情调查,收集感染者的基本信息、发病情况、临床症状等资料。除首发病例外,其余人员收集可能的暴露方式和采取的防护措施;结合流调,通过病毒全基因组测序,综合考虑发病时间、潜伏期、暴露方式等信息,明确感染途径和传播链。
1.4 SFTSV病原进化分析
采用实时荧光RT-PCR方法对人员血清标本进行SFTSV核酸检测,应用全基因组测序技术对阳性标本进行测序和序列比对。结合文献调研,筛选出基因库里曾经报道过的SFTS聚集性疫情上传的近乎完整的SFTSV序列,外群选择heartland virus (Accession:JX005842),使用MEGA X软件的Muscle方法进行比对,手动调整比对错误的区域并删除所有插入缺失列,然后使用邻接法与本研究获得的SFTSV序列一起构建进化树,用Bootstrap法进行进化树的验证分析,检验次数设置为1000,以确保进化树分支的稳定性,其余参数选择默认值。
2 结果与分析
2.1 两起聚集性疫情的流行病学特征分析
将两起疫情按发生时间先后分别命名为聚集性疫情1和聚集性疫情2,两起疫情无时空关联,且原发患者均死亡,继发患者治愈。聚集性疫情1包含4人,确诊患者2人(张某,高某田),密接2人;聚集性疫情2包含6人,确诊患者2人(彭某芳,易某山),密接4人。现将病例关系特征及流行病学调查分析报告如下。
原发病例1,张某,女,68岁,农民,居住于河南省信阳市浉河区董家河乡。既往体健,发病前两周有高频率(4~5天/周)野外活动史。2022年5月1日,患者在采摘茶叶过程中左肩胛区皮肤被蜱虫叮咬(表1),5月8日,患者出现发热、乏力、纳差,伴恶心、头晕、头痛和口干等症状,最高体温39.7℃。该患者在发病4天后入院,经实验室诊断确诊为SFTSV感染,入院时病毒CT值为29.08。入院后病情迅速恶化,5月16日复查病毒载量明显升高,CT值降至17.89,家属提出转院申请,转院后患者很快陷入昏迷。5月18日放弃治疗出院,同日死于家中。
继发病例1是原发病例1的儿子,5月23日出现发热、乏力、头晕、厌食、恶心和头痛等症状。5月27日,继发病例1经实验室诊断确诊SFTSV感染后收治入院。经流行病学调查发现,继发患者1近期无蜱虫叮咬史,5月16~18日,在医院陪护原发病例1时,曾多次直接或间接接触原发病例1的血液,期间仅佩戴口罩,未戴手套,未做其他防护措施。入院后,化验结果回示该患者白细胞减少、血小板降低,伴有电解质紊乱、肝功能异常、肾功能不全,并出现了全身炎症反应综合征和感染性多脏器功能障碍综合征。迅速采取措施进行抗全身炎症反应综合征和抗感染性多脏器功能障碍综合征治疗;同时,针对该患者的病情特点,给予了退热、补液、调节电解质紊乱、升白细胞、保肝、止吐、止泻等对症支持治疗;此外,联用静注人免疫球蛋白增强其机体免疫调节功能及抗感染能力。经以上治疗后,患者病情迅速得以改善,2022年6月6日,患者SFTSV核酸检测阴性,治愈出院,预后良好。原发病例1的丈夫和儿媳与原发病例1也存在时空交集,被定义为密切接触者。在原发病例1死亡后,两位密切接触者与原发病例1的遗体和贴身衣服有过接触,其儿媳还曾握住原发病例1的手数秒,期间佩戴了口罩和一次性橡胶手套,明确无血液接触史,这两名密切接触者无任何不适(表1,图1和2)。
原发病例2,彭某芳,女,75岁,农民,居住于河南省信阳市光山县马畈。高血压病史10年余,患者发病前两周在居住地周边有高频率(4~5天/周)野外活动史和户外劳作史,常出没于菜地,沿路有杂草和灌木丛,左小腿处有疑似虫叮咬痕迹。2023年5月20日,患者无明显诱因出现发热,乏力症状,最高体温39.5℃,5月27日在当地医院确诊SFTSV感染后转入本院,实验室复查SFTSV核酸阳性,病毒CT值为12.50。入院后,患者病情急剧恶化,出现多器官功能障碍、中毒性脑病和肝功能衰竭症状,家属放弃治疗出院,5月28日凌晨7时,患者于家中去世。
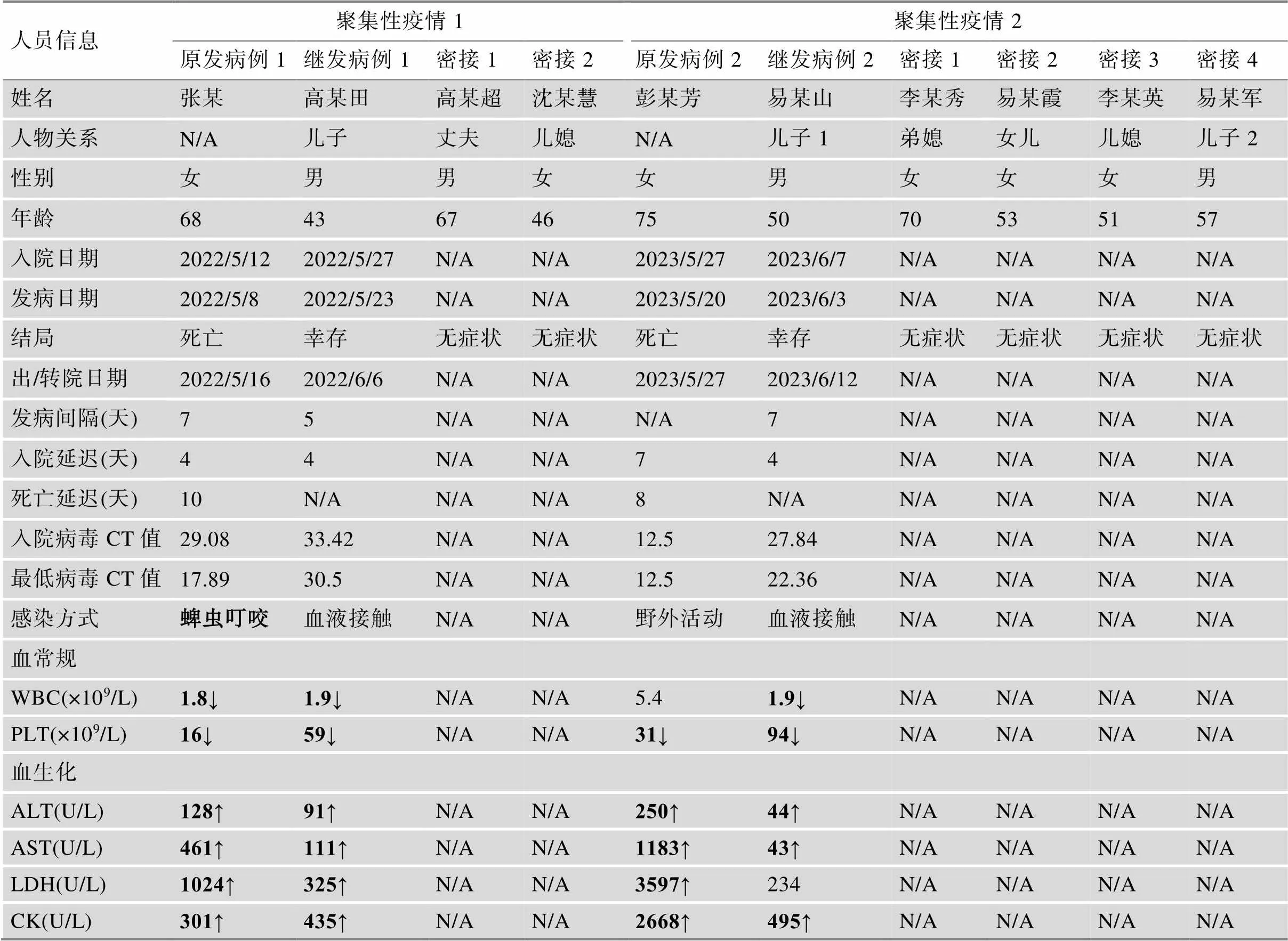
表1 两起SFTS聚集性疫情家庭成员信息
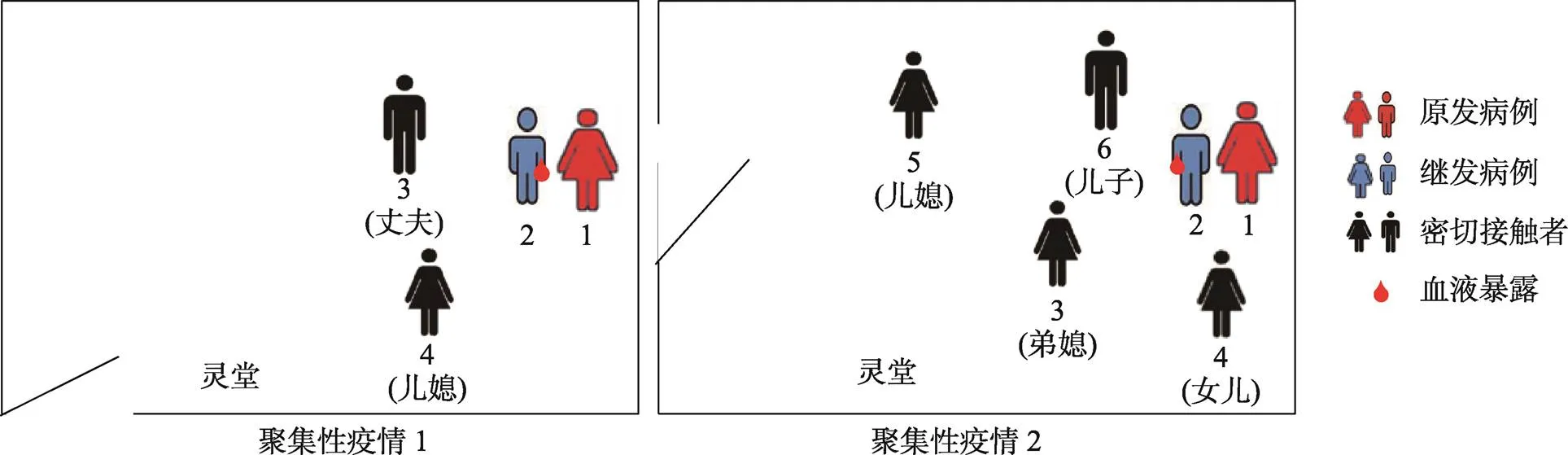
图1 病例暴露情况示意图
左:聚集性疫情1;右:聚集性疫情2。图示为两起聚集性疫情中各自涉及人员在灵堂的相对空间位置,数字分别对应表1中两起疫情涉及的人员(顺序从左往右)。

图2 两起SFTS聚集性疫情中患者的重要事件时间线
A:聚集性疫情1;B:聚集性疫情2。两名继发病例全程参与两名首发病例的陪护过程,并有明确的血液分泌物接触史。
继发病例2是原发病例2的小儿子,6月3日出现发热、乏力、咳嗽、厌食、恶心和头痛症状,6月7日经实验室确诊SFTSV感染收治入院,入院时病毒CT值为27.84。流行病学调查显示,继发病例2近半月无蜱虫叮咬史,全程参与原发病例2的护理及死亡后遗体清理工作。原发病例2住院期间,有牙龈出血和下颌震颤等症状,发热时震颤明显,继发病例2在给患者擦拭嘴角时,曾被患者牙齿磕碰到右手,接触到患者血液,期间未佩戴手套,未做其他防护措施,检查手部无伤口,清水洗手后未做其他处理。入院后,继发病例2病情加重,病毒载量持续上升,病毒CT值最低降至22.36。结合临床表现及病毒载量可以发现,继发病例2的病情明显较继发病例1更严重,因此,在继发病例1的治疗方案基础上,对继发病例2联用了抗病毒治疗和激素治疗,增强其机体的病毒清除能力及抗炎能力。值得一提的是,抗生素的应用在SFTS患者的临床治疗上较为慎重,CT结果提示该患者伴有肺部感染,因此应用了头孢菌素进行了抗感染治疗。经过5天治疗后,患者病毒载量首次出现下降趋势,病毒CT值上升为23.34,提示体内病毒复制得到控制,患者病情逐渐趋于稳定,进入恢复期,家属要求转院治疗。转院后,继发病例2治愈出院。原发病例2的其余4名亲属与其有过密切接触史,大儿子和女儿曾在医院陪护,有粪便接触史;儿媳前往医院探望1次,无肢体接触;弟媳参与遗体清理。4名密切接触者均佩戴口罩和一次性橡胶手套,无血液接触证据,这4名密切接触者均无不适症状(表1,图1和2)。
2.2 病毒溯源分析
本研究对4名SFTS患者的病毒全基因组测序均获得了近乎完整的SFTSV序列,trimAI裁剪后L、M、S片段的序列长度分别为6367 bp、3343 bp和1744 bp。系统进化分析显示,聚集性疫情1和聚集性疫情2中所涉病例的病毒基因组序列分别聚集在一起,两起聚集性疫情中患者的基因组序列各自聚集在一个属于中国谱系的单独分支中,聚集性疫情1的两名患者SFTSV为基因型I,聚集性疫情2的两名患者SFTSV为基因型II (图3,A~C)。结果表明,两起SFTS聚集性疫情中的患者各自感染的SFTSV是同一起源,为SFTSV通过血液接触感染引发人际传播提供了遗传学证据。
2.3 SFTSV序列比对与进化分析
通过文献调研,本研究从基因库中筛选出SFTS聚集性疫情中流行的13名SFTS患者的SFTSV序列(表2),再从基因库挑选出SFTSV各个谱系的代表序列(37条)。基于54条SFTSV序列和一条外群(heartland virus)构建进化树发现,目前共有7种不同的SFTSV基因型在中国流行,其中3种基因型(基因型Ⅰ/Ⅱ/Ⅵ)曾在SFTS聚集性疫情中被报道,即多种不同的SFTSV基因型均可以引起该病毒出现人际传播感染,提示SFTS聚集性疫情的发生可能和SFTSV基因型无明显关联。
结合本研究报道的两起聚集性疫情与既往报道过的SFTS聚集性疫情事件(表2),发现接触或者暴露于SFTSV感染者的血液可能是SFTS出现人际传播的主要途径。
3 讨论
SFTSV主要在丘陵/山区流行,人群普遍易感,流行季节在不同省份略有区别,在主要流行区流行季节为4~10月,5~7月为流行高峰期[19, 20]。本研究报道了两起SFTS聚集性疫情,原发患者居住于河南省信阳市,均在5月发病,与SFTS的流行病学地区分布和时间分布相吻合[21]。蜱虫叮咬是SFTSV感染传播的主要途径,经流调发现,原发病例1有明确蜱虫叮咬史,原发病例2蜱虫叮咬史不详,但发病前2周有高频率野外活动史,且身上有疑似虫咬伤痕迹,存在被蜱虫叮咬感染SFTSV的可能[22]。这些均提示在SFTS流行地区需做好健康教育,提醒居民在野外活动及户外劳作时,采取有效的防护措施防止蜱虫叮咬十分重要。
Li等[21]研究表明,高龄、基础疾病、入院时间延迟和高病毒载量是SFTS患者预后不良的高危因素。本研究中两名原发病例均为高龄女性,考虑免疫功能低下以及合并慢性基础病增加了患者的死亡风险。四名SFTS患者均出现过病毒载量持续增高的情况,最终两名原发病例死亡,两名相对年轻的继发病例经治疗后则康复出院(表1)。此外,两名原发病例入院时病毒载量极高,两名继发病例入院时病毒载量相对较低,且继发病例的陪护亲属中未出现三代病例。这提示高病毒载量不仅是预后不良的高危因素,还会增加SFTSV的人际传播感染风险。同时,早期诊治,及时控制病毒载量可能对改善SFTS患者的不良结局具有重要意义。根据流行病学调查结果,两名继发病例从接触原发病例血液到发病仅间隔了5天和7天,可见SFTS死亡患者的血液具有高传播风险,提示在SFTS确诊患者的护理过程中,尤其是面对高病毒载量(病毒载量>1×109copies/ml,或CT值<20)的重症患者时,陪护家属及医护人员更需要做好个人防护。
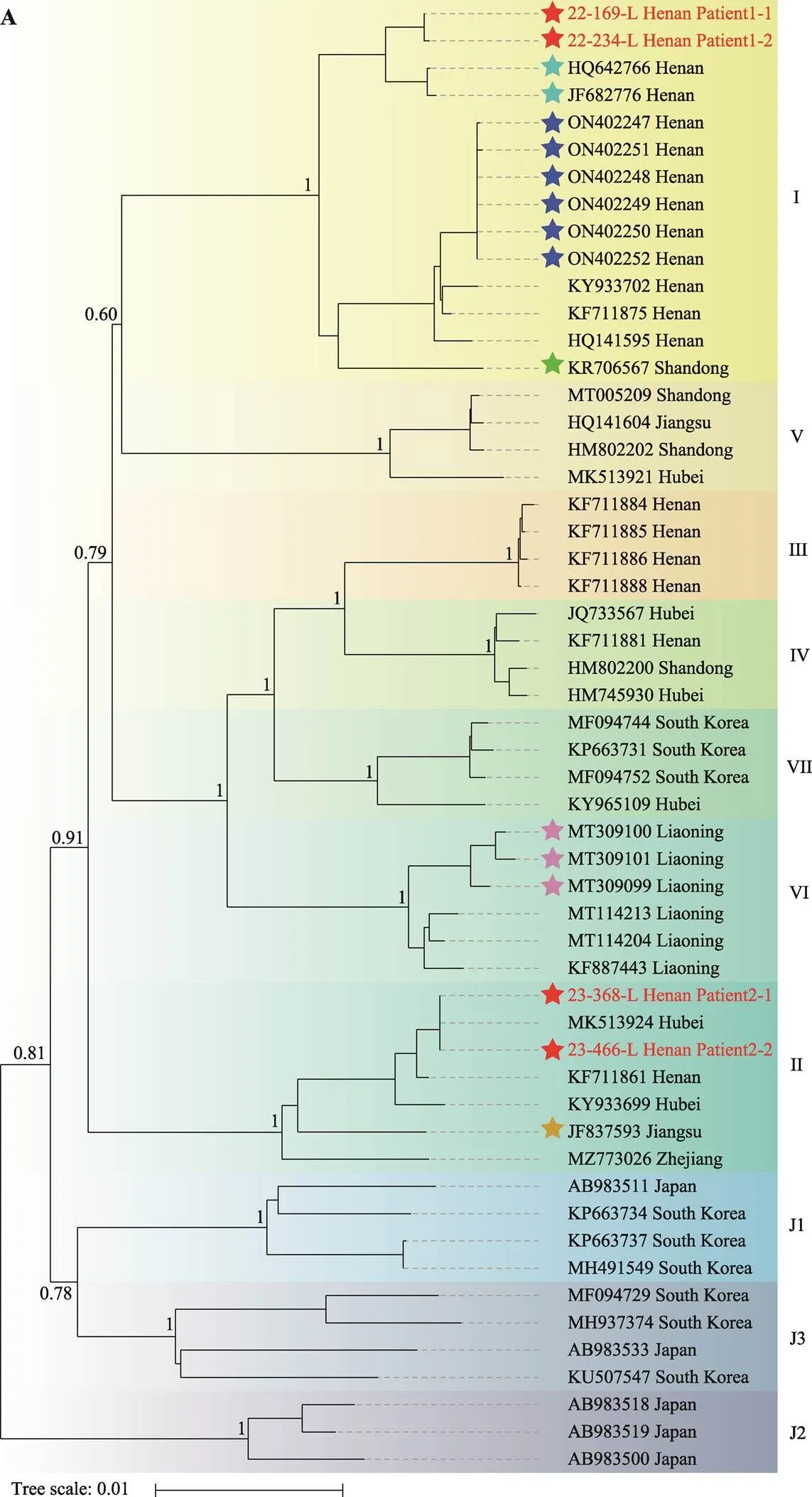
A:SFTSV的L片段系统发育树。B:SFTSV的M片段系统发育树。C:SFTSV的S片段系统发育树。4名SFTS患者的病毒序列以“年份-编号-片段地理病人编号”命名,标注为红色;既往报道的13名聚集性SFTS患者的病毒序列以五角星标注,以不同颜色区分,其他37条各个谱系的代表序列从基因库获得,使用1条heartland virus序列作为外群对照。基于以上资料用Mega X的邻接法构建进化树,Bootstrap检验,重复检验1000次。

表2 SFTS聚集性疫情报道的SFTSV基因序列
*本研究获得的SFTSV基因序列,命名规则为“年份-编号-片段地理”。
随后,本研究对两起疫情中SFTSV的可能传播途径进行了分析。流调显示,继发病例和原发病例居住地分散,发病前无时空交集,且接触原发病例非血液分泌物的密切接触者无不适症状。据此可以推测继发病例可能因为接触了原发病例的血液分泌物感染SFTSV(图1,表1),这一结果也验证了经血液接触传播可能是SFTS聚集性发病的关键途径之一。此外,曾与原发病例有时空交集的其余6名密切接触者,在佩戴口罩和手套等情况下,虽曾接触过原发病例的排泄物,但最终没有感染SFTSV,结合此前的聚集性疫情报道提示,SFTS患者的粪便等非血液分泌物可能具有较低的传播风险[2,3]。
SFTS是新发传染病,误诊率和漏诊率较高,死亡风险大[22],因此预防SFTSV出现人际传播十分重要。尽管多地曾报道过SFTS聚集性疫情,但病原学特征研究相对较少,SFTS聚集性疫情和SFTSV基因型的遗传关联性仍亟待探究。本研究通过文献调研,筛选出曾报道过的SFTS聚集性疫情上传的SFTSV序列[2,7~9,23],与本研究获得的病毒序列一起构建进化树,首次将SFTS聚集性疫情和SFTSV基因型进行遗传关联分析。结果显示两起疫情中两组SFTSV序列分别处于同一进化分支中,核苷酸同源性高达99.9%~100%。此外,至少有7种不同基因型的SFTSV病毒株在中国流行,其中3种基因型曾在SFTS聚集性疫情中被报道,提示SFTS聚集性疫情的发生可能和SFTSV基因型无明显关联,其余4种病毒基因型是否会引发人际传播感染,有待进一步研究报道。当然,本研究也存在一定局限性,比如:两次聚集性疫情涉及到的SFTS确诊病例数较少;缺乏患者居住地周边环境样本调查分析等。
综上所述,本研究报道了2022~2023年发生在河南省信阳市的两起SFTS聚集性疫情,评估了SFTSV的人际传播感染风险,提示接触SFTS确诊患者的血液可能在SFTSV的人际传播感染中发挥着重要作用。因此,在SFTS患者护理过程中,陪护亲属及医护人员做好个人防护,及时清理血液污染是防止SFTSV出现人际传播的有效方法。如:正确的佩戴口罩,穿戴一次性橡胶手套,接触病人身体前后做好手部清洗及消毒。在处理患者的体液分泌物(血液、粪便、小便、痰液等)时,尽可能穿戴一次性防护服,佩戴护目镜,或者佩戴防护面罩等,从而降低SFTSV出现人际传播感染的风险。值得注意的是,SFTS死亡病例尸体的规范化处理在降低SFTS人际传播风险方面也尤其重要。有关部门应加强对SFTS死亡病例后续处理工作的重视程度,在遗体清理至出殡前,相关人员必须采取穿戴防护服、手套、口罩、护目镜或面罩等综合防护措施[2,18]。对医疗工作者而言,除持续加强SFTS病例监测力度外,同时应针对重点人群大力开展蜱传疾病的健康教育,普及防治知识,降低SFTSV感染率。最后,提高临床医生对SFTS的诊治水平,降低误诊率和漏诊率,对降低SFTS患者的死亡风险也同样重要。
[1] Yu XJ, Liang MF, Zhang SY, Liu Y, Li JD, Sun YL, Zhang LH, Zhang QF, Popov VL, Li C, Qu J, Li Q, Zhang YP, Hai R, Wu W, Wang Q, Zhan FX, Wang XJ, Kan B, Wang SW, Wan KL, Jing HQ, Lu JX, Yin WW, Zhou H, Guan XH, Liu JF, Bi ZQ, Liu GH, Ren J, Wang H, Zhao Z, Song JD, He JR, Wan T, Zhang JS, Fu XP, Sun LN, Dong XP, Feng ZJ, Yang WZ, Hong T, Zhang Y, Walker DH, Wang Y, Li DX. Fever with thrombocytopenia associated with a novel bunyavirus in China., 2011, 364(16): 1523–1532.
[2] Tang XY, Wu WL, Wang HF, Du YH, Liu LC, Kang K, Huang XY, Ma H, Mu F, Zhang SQ, Zhao GH, Cui N, Zhu BP, You AG, Chen HM, Liu GH, Chen WJ, Xu BL. Human-to-human transmission of severe fever with thrombocytopenia syndrome bunyavirus through contact with infectious blood., 2013, 207(5): 736–739.
[3] Jiang XL, Zhang S, Jiang M, Bi ZQ, Liang MF, Ding SJ, Wang SW, Liu JY, Zhou SQ, Zhang XM, Li DX, Xu AQ. A cluster of person-to-person transmission cases caused by SFTS virus in Penglai, China., 2015, 21(3): 274–279.
[4] Chen HB, Hu K, Zou JJ, Xiao JX. A cluster of cases of human-to-human transmission caused by severe fever with thrombocytopenia syndrome bunyavirus., 2013, 17(3): e206–e208.
[5] Zhan JB, Wang Q, Cheng J, Hu B, Li J, Zhan FX, Song Y, Guo DY. Current status of severe fever with thrombocytopenia syndrome in China., 2017, 32(1): 51–62.
[6] Gai ZT, Liang MF, Zhang Y, Zhang S, Jin C, Wang SW, Sun LF, Zhou N, Zhang QF, Sun YL, Ding SJ, Li C, Gu W, Zhang FS, Wang YS, Bian PF, Li XY, Wang ZQ, Song XG, Wang XJ, Xu AQ, Bi ZQ, Chen SJ, Li DX. Person- to-person transmission of severe fever with thrombocytopenia syndrome bunyavirus through blood contact., 2012, 54(2): 249–252.
[7] Huang DY, Jiang YP, Liu XP, Wang B, Shi JM, Su Z, Wang H, Wang T, Tang S, Liu HY, Hu ZH, Deng F, Shen S. A cluster of symptomatic and asymptomatic infections of severe fever with thrombocytopenia syndrome caused by person-to-person transmission., 2017, 97(2): 396–402.
[8] Wu YX, Yang X, Leng Y, Li JC, Yuan L, Wang Z, Fan XJ, Yuan C, Liu W, Li H.Human-to-human transmission of severe fever with thrombocytopenia syndrome virus through potential ocular exposure to infectious blood., 2022, 123: 80–83.
[9] Bao CJ, Guo XL, Qi X, Hu JL, Zhou MH, Varma JK, Cui LB, Yang HT, Jiao YJ, Klena JD, Li LX, Tao WY, Li X, Chen Y, Zhu Z, Xu K, Shen AH, Wu T, Peng HY, Li ZF, Shan J, Shi ZY, Wang H. A family cluster of infections by a newly recognized bunyavirus in eastern China, 2007: further evidence of person-to-person transmission., 2011, 53(12): 1208–1214.
[10] Wang YL, Deng BC, Zhang J, Cui W, Yao WQ, Liu P. Person-to-person asymptomatic infection of severe fever with thrombocytopenia syndrome virus through blood contact., 2014, 53(8): 903–906.
[11] Liu Y, Li Q, Hu WF, Wu JB, Wang YB, Mei L, Walker DH, Ren J, Wang Y, Yu XJ. Person-to-person transmission of severe fever with thrombocytopenia syndrome virus., 2012, 12(2): 156–160.
[12] Yoo JR, Heo ST, Park D, Kim H, Fukuma A, Fukushi S, Shimojima M, Lee KH. Family cluster analysis of severe fever with thrombocytopenia syndrome virus infection in Korea., 2016, 95(6): 1351–1357.
[13] Tao MY, Liu Y, Ling F, Zhang R, Shi XG, Ren JP, Guo S, Sun JM, Jiang JM. Characteristics of three person-to- person transmission clusters of severe fever with thrombocytopenia syndrome in southeastern China., 2021, 105(3): 794–800.
[14] Jung IY, Choi W, Kim J, Wang E, Park SW, Lee WJ, Choi JY, Kim HY, Uh Y, Kim YK. Nosocomial person-to-person transmission of severe fever with thrombocytopenia syndrome., 2019, 25(5): 633.e1–633.e4.
[15] Liu Q, He B, Huang SY, Wei F, Zhu XQ. Severe fever with thrombocytopenia syndrome, an emerging tick-borne zoonosis., 2014, 14(8): 763–772.
[16] Jeong EJ, Song JY, Lim CS, Lee I, Park MS, Choi MJ, Jeon JH, Kang SH, Jung BK, Yoon JG, Hyun HJ, Noh JY, Cheong HJ, Kim WJ. Viral shedding from diverse body fluids in a patient with severe fever with thrombocytopenia syndrome., 2016, 80: 33–35.
[17] Gong Z, Gu S, Zhang Y, Sun J, Wu X, Ling F, Shi W, Zhang P, Li D, Mao H, Zhang L, Wen D, Zhou B, Zhang H, Huang Y, Zhang R, Jiang J, Lin J, Xia S, Chen E, Chen Z. Probable aerosol transmission of severe fever with thrombocytopenia syndrome virus in southeastern China., 2015, 21(12): 1115–1120.
[18] Kim WY, Choi W, Park SW, Wang EB, Lee WJ, Jee Y, Lim KS, Lee HJ, Kim SM, Lee SO, Choi SH, Kim YS, Woo JH, Kim SH. Nosocomial transmission of severe fever with thrombocytopenia syndrome in Korea., 2015, 60(11): 1681–1683.
[19] Zhang DW, Sun CK, Yu HY, Li JX, Liu WD, Li ZF, Bao CJ, Liu DP, Zhang N, Zhu FC, Hu JL. Environmental risk factors and geographic distribution of severe fever with thrombocytopenia syndrome in Jiangsu province, China.2019, 19(10): 758–766.
[20] Sun JM, Lu L, Wu HX, Yang J, Ren JP, Liu QY. The changing epidemiological characteristics of severe fever with thrombocytopenia syndrome in China, 2011-2016., 2017, 7(1): 9236.
[21] Li H, Lu QB, Xing B, Zhang SF, Liu K, Du J, Li XK, Cui N, Yang ZD, Wang LY, Hu JG, Cao WC, Liu W. Epidemiological and clinical features of laboratory-diagnosed severe fever with thrombocytopenia syndrome in China, 2011-17: a prospective observational study., 2018, 18(10): 1127–1137.
[22] He ZQ, Wang BH, Li Y, Du YH, Ma HX, Li XL, Guo WS, Xu BL, Huang XY. Severe fever with thrombocytopenia syndrome: a systematic review and meta-analysis of epidemiology, clinical signs, routine laboratory diagnosis, risk factors, and outcomes., 2020, 20(1): 575.
[23] Mao LL, Deng BC, Liang YH, Liu Y, Wang ZJ, Zhang J, Wu W, Yu L, Yao WQ. Epidemiological and genetic investigation of a cluster of cases of severe fever with thrombocytopenia syndrome bunyavirus., 2020, 20(1): 346.
Epidemiololgical and etiological analysis of two clusters of severe fever with thrombocytopenia syndrome
Xin Yang1, Yongxiang Wu1, Yu Leng1, Jiachen Li2, Chaojie Wang1, Yimei Yuan3, Zhen Wang3, Lan Zhang3, Hao Li1, Wei Liu1
Severe fever with thrombocytopenia syndrome (SFTS) is an emerging infectious disease, caused by severe fever with thrombocytopenia syndrome virus (SFTSV), which is primarily transmittedtick bites. Clusters of SFTS caused by human-to-human transmission have been reported both at home and abroad, mainly focused on the transmission or exposure modes. However, the correlation between SFTS clusters and viral genotypes has not been investigated. This study mainly reported two clusters of SFTS in Xinyang City, Henan Province, from 2022 to 2023, discussed the possible route of person-to-person transmission of SFTSV infection and analyzed the association between SFTS clusters and virus genotypes. We found that two groups of SFTSV in two clusters were clustered separately into different genotypes through viral sequence analysis of 4 confirmed patients. We also performed phylogenetic analysis, after including SFTSV sequences obtained from SFTS clusters deposited in the GenBank. Three SFTSV genotypes have been reported among cases of human-to-human transmission, suggesting that the occurrence of SFTS clusters may not be related to SFTSV genotypes. This study provided genetic evidence for revealing the chain of human-to-human transmission of SFTS clusters, indicating that contact with patients’ blood is an important transmission route of SFTSV. The findings laid the foundation for preventing and controlling human-to-human transmission of SFTS.
severe fever with thrombocytopenia syndrome; tick-borne diseases; human-to-human transmission; genetic analysis
2023-06-29;
2023-09-15;
2023-09-29
国家自然科学基金面上项目(编号:82172270)资助[Supported by the National Natural Science Foundation of China (No. 82172270)]
杨鑫,硕士,医师,研究方向:公共卫生。E-mail: 499163792@qq.com
刘玮,博士,研究员,研究方向:传染病防控。E-mail: lwbime@163.com
黎浩,博士,研究员,研究方向:病原微生物学。E-mail: lihao_1986@126.com
10.16288/j.yczz.23-176
(责任编委: 周钢桥)