PAD4依赖的中性粒细胞胞外诱捕网加重包虫囊液所致过敏性休克
2023-11-24何金盼
何金盼,崔 键,戴 庆
(新疆医科大学第一附属医院麻醉科,新疆围术期器官保护重点实验室(XJDX1411),乌鲁木齐 830054)
包虫病作为一种人畜共患疾病,是由寄生在肝脏和肺等器官的细粒棘球蚴幼虫导致的严重寄生虫病[1]。人体感染包虫后,幼虫在人体内形成囊性包虫,诱发囊肿,并释放包虫囊液。包虫囊液所致过敏性休克(anaphylactic shock,AS)是引起患者死亡的主要并发症,在临床实践中发生率高达2.0%[2]。如果治疗不及时,将会危及生命。
中性粒细胞是人体循环中最丰富的白细胞。它们在抵抗细菌、真菌和寄生虫病原体的免疫防御中起着至关重要的作用[3]。2004年Brinkmann等[4]首次报道称中性粒细胞在受到刺激后可形成中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs)。其中,精氨酸脱亚胺酶4(peptidyl arginine deiminase 4,PAD4)通过催化组蛋白的精氨酸残基转化为瓜氨酸,导致染色质解凝,这是NETs形成的关键[5]。NETs表面装饰大量中性粒细胞胞质蛋白和颗粒蛋白,如髓过氧化物酶(myeloperoxidase,MPO)、乳铁蛋白和基质金属蛋白酶等[6]。NETs可以结合并释放毒力因子,杀死病原微生物防止其传播。然而据研究发现,过度的NETs形成可能导致蛋白水解酶以及组蛋白的大量释放,从而产生细胞毒性,引起过敏反应并加重组织损伤[7]。例如在细菌感染引起的脓毒血症中,NETs可以加速器官衰竭。而抑制PAD4酶活性可通过抑制NETs产生,提高脓毒症小鼠生存率[8]。除此之外,机体过敏期间形成的IgG免疫复合物(包括组胺和蛋白酶等)可能通过诱导NETs释放加重过敏反应[9]。然而未有研究报道PAD4介导的NETs是否加重包虫囊液所致AS,其分子机制也有待进一步研究。
本研究通过给小鼠注射包虫囊液抗原,构建AS模型,通过敲除PAD4抑制NETs形成,观察是否可以改善模型小鼠症状,并研究其分子机制,以期为包虫囊液所致AS的临床防治研究提供一定的参考思路。
1 材料和方法
1.1 实验动物
20只野生型(wild type,WT)CB7BL/6 PAD4+/+小鼠以及20只同窝PAD4-/-敲除型小鼠(SPF级),8~10周,体质量平均(20.18±2.04)g,均购于江苏集萃药康生物科技股份有限公司,动物生产许可证号:SYXK(苏)2018-0019。所有小鼠均置12 h光照/12 h黑暗环境中,于24 ℃的恒定温度中饲养,实验期间可自由获取标准饮食和水。本动物实验经我院伦理委员会审核,审批号:20220416-062。
1.2 主要仪器和试剂
100×青霉素-链霉素溶液(货号:PB180120)购自武汉普诺赛生命科技有限公司;红细胞裂解液(货号:C3702)购自上海碧云天生物技术有限公司;Percoll细胞分离液(货号:17089101)购自北京智杰方远科技有限公司;胎牛血清(货号:C0235)购自美国Gibco公司;RPMI 1640培养基(货号:PM150110B)购自武汉普诺赛生命科技有限公司;TRIzol试剂(货号:abs9331)购自爱必信(上海)生物科技有限公司;M-MLV 4 First-Strand cDNA Synthesis Kit反转录试剂盒(货号:MT403-01)购自北京博迈德基因技术有限公司;qPCR引物由上海生工生物工程有限公司合成;SYBR Real-Time PCR试剂盒(货号:QPG-040)购自上海吉玛生物科技有限公司;绿箐SYTOX Green(货号:001-TY9036)购自北京毕特博生物技术有限责任公司;离子霉素(货号:I9657)购自美国Sigma;Picogreen(货号:12641ES01)购自翌圣生物科技(上海)股份有限公司;流式抗体:FITC标记的CD4(货号:ab59474)、PE标记的IFN-γ(货号:ab95673)和APC标记的IL-4(货号:ab95715)购自美国abcam公司;Ficol1分离液(货号:LDS1075)购自天津灏洋生物公司。IL-4、IL-5和IgE的ELISA检测试剂盒购自上海雨桐生物科技有限公司。
Spark多功能酶标仪购自瑞士Tecan公司;倒置荧光显微镜(型号:TS2)购自尼康仪器(上海)有限公司;7300 Plus Real-Time PCR system、FACSCalibur多色流式细胞仪购自美国BD公司。
1.3 实验方法
1.3.1 粗制包虫囊液抗原 于本市屠宰场获取自然感染细粒棘球蚴的绵羊,取绵羊肝脏。在无菌条件下获取肝脏中的包虫囊液,待其自然沉淀后,弃上清液。根据张秦[10]研究方法,使用含有抗生素(青霉素、链霉素各500 U)的生理盐水冲洗底部沉淀3次。随后将其冻存于-80 ℃冰箱内。
1.3.2 包虫囊液所致AS模型建立 将小鼠分为WT组、WT模型组、PAD4-/-组和PAD4-/-模型组,每组各10只。WT模型组和PAD4-/-模型组小鼠腹腔注射细粒棘球绦虫的幼虫微囊建立包虫感染小鼠模型,每只小鼠的注射剂量约为50个微囊。WT组和PAD4-/-组给予等量生理盐水代替。1个月后,将小鼠进行全身麻醉,解剖若发现包虫囊泡时则认为包虫囊液模型成功。两个模型组小鼠均再次注射相同剂量的包虫囊液。若小鼠出现喘息,呼吸困难,嘴和尾巴周围发绀,甚至表现为震颤和抽搐,则认为小鼠出现包虫囊液所致AS[11]。并记录小鼠24 h内死亡情况。将成功造模的小鼠数据纳入后续实验。
1.3.3 脾脏中性粒细胞的分离培养 将小鼠眼球摘除后颈椎脱臼处死,置于75%酒精中浸泡消毒10 min,在无菌环境下打开小鼠腹腔,取小鼠脾脏,置于1 ml生理盐水中充分研磨,使用200目筛网进行过滤,得到脾脏单细胞悬液。4 ℃,1 000 r/min离心5 min后,弃上清,加入适量红细胞裂解液以去除红细胞。再次离心弃上清,使用无菌生理盐水洗涤2次。使用适量生理盐水重悬细胞沉淀,缓慢加入配制好的Percoll细胞分离液中,室温1 000 r/min离心30 min。轻轻吸出位于中层的中性粒细胞,1 000 r/min离心5 min,使用含有10%胎牛血清的RPMI 1640培养基重悬细胞。置于37 ℃,含有5% CO2的细胞培养箱内培养。
1.3.4 qRT-PCR检测PAD4基因表达 用TRIzol试剂从中性粒细胞中提取总RNA,并使用酶标仪检测RNA质量(浓度、纯度)。使用M-MLV 4 First-Strand cDNA Synthesis Kit反转录试剂盒将所得到的RNA逆转录为cDNA,按照SYBR Real-Time PCR试剂盒的说明配制qRT-PCR反应体系。反应条件:95 ℃ 1 min;95 ℃ 10 s,60 ℃ 30 s,72 ℃ 30 s,共40个循环。采用2-ΔΔCt值比较各组之间目的基因的相对表达量,以GAPDH为内参基因。引物序列如下:PAD4上游引物:5′-TTCAAGTGGTGGCACATGGT-3′,下游引物:5′-AGATCTCTTGCTGCACCTCG-3′;GAPDH上游引物:5′-CAGGAGAGTGTTTCCTCGTCC-3′;下游引物:5′-GATGGGCTTCCCGTTGATGA-3′。
1.3.5 绿菁染色法检测NETs形成水平 绿箐SYTOX Green是一种可轻易穿过受损细胞质膜而不能透过活细胞质膜的绿色核酸染料,可用来检测NETs的DNA网状结构。将提取的脾脏中性粒细胞均匀铺于24孔板内,每孔1×106个细胞,在避光条件下,加入细胞核染料绿箐(1 μmol/L),轻轻混匀,孵育10 min,在含有氩激光488 nm激发器的荧光显微镜下观察,使用Image J软件对形成网状结构的细胞进行统计。
1.3.6 NETs与外周血单核细胞(peripheral blood mononuclear cell,PBMC)共孵育 提取健康小鼠的脾脏中性粒细胞,以1×106的密度接种于24孔板中,加入10 μmol/L的离子霉素刺激3 h后,弃掉上清液,加入新鲜RPMI 1640培养基继续培养2 h后,轻轻吹起中性粒细胞,在1 000 r/min下离心5 min,获取的上清液,采用picogreen荧光染料检测双链DNA的浓度,即为NETs含量。收集健康WT小鼠的外周血,Ficol1密度梯度离心法分离PBMC均匀平铺于24孔板内。实验分为对照组(不加NETs)和NETs组,NETs组加入200 μg/ml浓度的NETs后,置于37 ℃,含5% CO2细胞培养箱中共孵育24 h后,进行后续实验检测。
1.3.7 流式细胞术检测Th1/Th2细胞比例 分别抽取造模组和对照组外周静脉血,Ficoll密度梯度离心法分离PBMC。分别加入FITC标记的CD4抗体10 μl,混匀,室温放置20 min对细胞表面抗原进行染色。Triton通透并固定细胞后进行PBS洗涤,进行胞内细胞因子染色,实验管分别加入PE标记的IFN-γ抗体和APC标记的IL-4抗体各10 μl,对照管加入同型对照抗体,4 ℃避光孵育30 min后,PBS洗涤2次后,采用流式细胞仪检测分析。用FlowJo软件进行数据分析。
1.3.8 ELISA检测血清中IL-4、IL-5和IgE蛋白的含量 参考ELISA试剂盒的说明书进行IL-4、IL-5和IgE的含量检测。依次制备梯度稀释的标准品后加入标准孔中,加入10 μl待测样品与40 μl样品稀释液,置于37 ℃恒温培养箱中反应30 min。加入50 μl的辣根过氧化物酶标试剂,继续37 ℃反应30 min,反应结束后,分别加入显色液A和显色液B,室温反应10 min后可观察明显颜色变化。加入终止液终止反应。使用酶标仪于450 nm波长处检测吸光度值。

2 结果
2.1 敲除PAD4缓解包虫囊液所致AS症状
与WT组比较,WT模型组小鼠休克率和死亡率明显升高;与WT模型组比较,PAD4-/-模型组小鼠休克率和死亡率明显降低(见表1)。

表1 敲除PAD4对包虫囊液所致AS症状的影响 例(%)
2.2 敲除PAD4抑制包虫囊液所致NETs形成
qRT-PCR结果显示,与WT组比较,WT模型组小鼠脾脏中中性粒细胞PAD4 mRNA表达升高(P<0.05);与WT模型组比较,PAD4-/-模型组小鼠脾脏中中性粒细胞PAD4 mRNA表达降低(P<0.05);PAD4-/-组和PAD4-/-模型组小鼠脾脏中中性粒细胞PAD4 mRNA表达水平无显著性差异(P>0.05,见图1)。绿菁染色结果显示,与WT组比较,WT模型组小鼠NETs形成水平升高(P<0.05);与WT模型组比较,PAD4-/-模型组小鼠NETs形成水平降低(P<0.05);PAD4-/-组和PAD4-/-模型组小鼠NETs形成水平无显著性差异(P>0.05,见图1)。
2.3 敲除PAD4恢复包虫囊液所致Th1/Th2细胞比例失衡
流式细胞术结果显示,与WT组比较,WT模型组小鼠PBMC中Th2细胞比例升高,Th1/Th2细胞比例降低(P<0.05);与WT模型组比较,PAD4-/-模型组小鼠PBMC中Th2细胞比例降低,Th1/Th2细胞比例升高(P<0.05);PAD4-/-组和PAD4-/-模型组小鼠PBMC中Th2细胞比例和Th1/Th2细胞比例无显著性差异(P>0.05,见图2)。
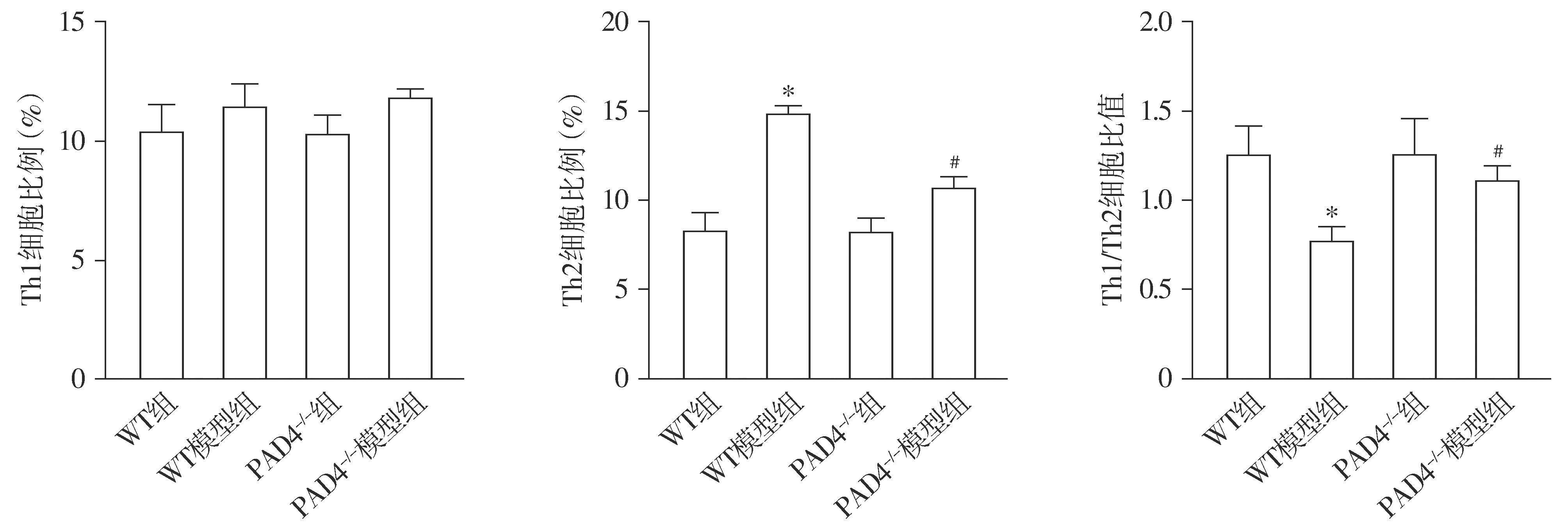
与WT组比较,*P<0.05;与WT模型组比较,#P<0.05
2.4 敲除PAD4缓解包虫囊液所致过敏性反应
ELISA结果显示,与WT组比较,WT模型组小鼠血清中IL-4、IL-5和IgE水平升高(P<0.05);与WT模型组比较,PAD4-/-模型组小鼠血清中IL-4、IL-5和IgE水平降低(P<0.05);PAD4-/-组和PAD4-/-模型组小鼠血清中IL-4、IL-5和IgE水平无显著性差异(见图3)。
2.5 NETs诱导Th1/Th2细胞比例失衡和过敏性反应
流式细胞术结果显示,与对照组比较,NETs组Th2细胞比例升高,Th1/Th2细胞比例降低(P<0.05,见图4)。ELISA结果显示,与对照组比较,NETs组细胞上清中IL-4、IL-5和IgE水平升高(P<0.05,见图5)。

与对照组比较,*P<0.05

与对照组比较,*P<0.05
3 讨论
包虫病是细粒棘球蚴幼虫侵入人体引起的寄生虫病。在手术过程或者发生外伤时,包虫原头节会脱落并扩散至腹腔或其他器官中,形成新的包囊,导致疾病反复发作。此外,包虫囊液感染形成的囊肿可能发生破裂,进而导致AS,在临床严重程度和免疫学特征上均不同于Ⅰ型超敏反应[12]。因此,临床上针对Ⅰ型超敏反应的治疗,往往无法治愈包虫囊液所致的AS,这给临床治疗带来了很大困难[13]。
中性粒细胞是发生炎症或感染后快速募集并杀死病原微生物的一类免疫细胞。在人类包虫病中,中性粒细胞在包囊中大量浸润[14]。最近的研究发现绵羊的中性粒细胞体外接触包虫原头节后,可以触发NETs形成[15]。这表明中性粒细胞除了可以通过吞噬、释放炎性因子等经典功能发挥作用外,还可能通过释放NETs对抗寄生虫感染疾病。目前针对NETs产生的机制已经有大量研究进行了报道。中性粒细胞在受到刺激后,细胞膜上的Ca2+通道打开,细胞外的Ca2+内流至细胞质中,导致PAD4酶被激活[16]。PAD4是PAD家族中唯一携带核定位信号的酶[17]。在被激活之后,PAD4进入细胞核,催化染色质上的组蛋白发生瓜氨酸化。这一过程使得组蛋白的正电荷减弱,降低了它们与DNA的静电结合能力,从而导致染色质结构变得不稳定,出现解螺旋。随后,DNA被释放到细胞质中,并与髓过氧化物酶(MPO)和中性粒细胞弹性蛋白酶(NE)等细胞质颗粒蛋白结合。这个复合物随后被从细胞中释放出来,形成被称为NETs的结构[18]。NETs形成受各种因素的影响,包括细胞的黏附、代谢和环境刺激,细菌和病毒往往会被中性粒细胞的吞噬作用清除,而寄生虫更倾向于诱导NETs的形成[19]。Mendez等[20]在牛的奥氏奥斯特线虫慢性感染疾病中观察到了NETs的产生,同时研究表明,寄生虫触发的NETs形成可能反映了宿主针对寄生虫入侵的早期先天免疫反应应答,以此对抗寄生虫感染[21]。以上研究证据均表明NETs可能是对抗寄生虫感染的关键,然而并未曾有进一步的机制探索。
值得注意的是,目前越来越多的研究已经发现,PAD4介导的NETs形成可以加重诸如COVID-19等多种感染性疾病的发展[21]。在COVID-19感染者中,NETs在患者肺部大量浸润。体外实验表明NETs可对正常肺上皮细胞产生杀伤作用,而用脱氧核糖核酸酶抑制NETs后可以逆转这种损伤[22]。在本实验中,通过使用WT和PAD4敲除的小鼠进行腹腔注射包虫囊液进行造模,探究PAD4介导的NETs形成是否会加重由包虫感染导致的AS,结果表明,敲除PAD4缓解包虫囊液所致AS症状,表现为休克率和死亡率明显降低。同时敲除PAD4抑制了小鼠中性粒细胞NETs的形成,提示NETs可能在包虫囊液所致AS中过度产生,进而促进了该疾病的恶化。
Th1/Th2细胞的平衡与免疫调节系统密切相关。Th1/Th2失衡时,Th2细胞分化增加导致过敏反应加重[23]。因此调节Th1/Th2平衡对包虫囊液所致AS具有重要意义。本研究发现,WT模型组小鼠PBMC中Th1/Th2细胞比例降低,而敲除PAD4可以显著增加Th1/Th2细胞比例。同时NETs与PBMC共孵育实验表明,NETs可直接调节Th1/Th2比例,以上结果表明PAD4介导的NETs可能通过加重Th1/Th2细胞比例的失衡加重疾病进程。Th2细胞免疫反应是抗炎反应,IL-4和IL-5为Th2型细胞因子,它们可以刺激B细胞产生IgE抗体,继而刺激肥大细胞释放组胺,引起过敏反应[24]。本研究结果发现,NETs可以增加PBMC的IL-4、IL-5和IgE分泌能力,而PAD4敲除可以显著抑制小鼠血清中IL-4、IL-5和IgE水平的升高,缓解包虫囊液所致过敏性反应。
综上所述,敲除PAD4可以通过抑制中性粒细胞NETs的形成,改善包虫囊液所致AS。PAD4敲除可能通过恢复包虫囊液所致Th1/Th2细胞比例失衡,抑制包虫囊液所致过敏性反应进而缓解包虫囊液所致AS。以上结果初步明确了PAD4介导的NETs形成在包虫囊液所致AS中的作用,可为其临床治疗提供可能的治疗靶点。
