胆汁酸和 MAPK信号通路对 HepG2细胞中 PPARα转录表达的调控作用
2023-11-24黄娜娜庞碧滢黄晓霞熊文婷刘吉升
黄娜娜,庞碧滢&,黄晓霞,李 馨,熊文婷,孔 波*,刘吉升
(1广州大学生命科学学院代谢性疾病实验室,广州 510006;2广州大学生命科学学院生物技术教研室;&共同第一作者;*通讯作者,E-mail:kongbo@gzhu.edu.cn;#共同通讯作者,E-mail:jisheng.liu@gzhu.edu.cn)
非酒精性脂肪肝病(non-alcoholic fatty liver di-sease,NAFLD)是全球性重大公共健康问题[1],目前,NAFLD发病机制尚未完全阐明,临床上尚无有效的治疗药物和手段。肝细胞中脂肪过度累积,导致肝细胞损伤,并引发肝脏的炎症反应,是NAFLD的关键特征[2]。降低肝脏的脂肪积累和提高肝脏的脂肪酸β氧化是延缓或阻止NAFLD发展进程的有效手段。
过氧化物酶体增殖物激活受体α(peroxisome proliferation activated receptor α,PPARα)是肝脏中促进脂质氧化分解的关键调节因子,其参与调控的代谢过程与NAFLD的发病机制密切相关,是开发NAFLD相关治疗药物的重要靶点[3]。成纤维细胞生长因子15(fibroblast growth factor 15,FGF15)是小鼠肠道中的一种调节肝胆汁酸(bile acids,BAs)合成的肠因子,FGF19是其人类同源物[4]。FGF15/19与肝细胞表面的FGFR4受体结合后激活下游的ERK1/2、JNK1/2信号通路,从而调控胆汁酸的负反馈抑制合成[5]。本课题前期研究表明,在FGF15转基因小鼠的肝脏中,PPARα及其下游靶基因的水平显著上调[6],PPARα mRNA水平升高表明FGF15可能在转录水平调控PPARα的表达,其具体机制还尚不清楚。FGF15/19可能通过其下游的ERK1/2、JNK1/2信号通路调控PPARα的转录表达。此外,FGF15转基因小鼠中胆汁酸水平及组成发生变化,胆汁酸作为信号分子也可能通过激活不同的受体或信号通路调控PPARα的转录表达。法尼酯X受体(farnesoid X receptor,FXR)是胆汁酸的生理受体,作为转录因子与FXR反应元件(FXR response element, FXRE)结合调控下游靶基因的转录表达,是胆汁酸发挥调节作用的重要部分[7]。本研究构建了包含hPPARα基因5′端启动子区域的荧光素酶报告基因质粒,通过双荧光素酶报告基因系统在HepG2细胞中研究了ERK1/2、JNK1/2信号通路、FXR以及胆汁酸对hPPARα转录表达的调控作用,并进一步验证参与调控的顺式作用元件,为防治NAFLD的研究提供新思路。
1 材料和方法
1.1 细胞株及主要试剂
人肝癌细胞HepG2购自中科院上海细胞库;人胚胎肾细胞HEK293T由广州大学精准基因编辑中心乔云波教授课题组馈赠;萤火虫荧光素酶报告基因质粒PGL4-UPRE-luc2P-Hygro(101788)、海肾荧光素酶报告基因内参质粒phR-Luc(139644)购自美国Addgene平台;PCI-T7-EGFP质粒由广州大学精准基因编辑中心王刚教授课题组馈赠;荧光素酶报告基因质粒PGL4-3×FXRE、荧光素酶报告基因阴性对照质粒PGL4-Basic、hFXR过表达质粒PCI-T7-hFXR由本实验室(广州大学精准基因编辑中心孔波教授课题组)构建。DNA胶回收纯化试剂盒、质粒抽提试剂盒、T4 DNA连接酶、2×Taq Master Mix PCR试剂、DH5α感受态细胞、ExFect转染试剂、BCA蛋白定量试剂盒等购自南京诺唯赞公司;海肾荧光素酶检测试剂、萤火虫荧光素酶检测试剂、蛋白酶磷酸酶抑制剂混合物、ERK1/2一抗、JNK1/2一抗、β-actin一抗、山羊抗鼠二抗、山羊抗兔二抗、超敏ECL发光反应液、U0126、SP600125、GW4064等购自碧云天生物技术有限公司;p-ERK1/2一抗、p-JNK1/2一抗购自美国CST公司;限制性内切酶SfiⅠ购自美国Thermofisher公司;胎牛血清(FBS)、DMEM培养基、penicillin-streptomycin双抗、胰酶、Opti-MEM培养基等购自美国Invitrogen公司;胆汁酸(CDCA、LCA、DCA、GDCA、UDCA)购自阿拉丁化学试剂网。
1.2 主要仪器
超净工作台(苏州苏净集团安泰公司,SW-CJ-1FD型);二氧化碳培养箱(上海一恒公司,BPN-150CW型);微量分光光度计(美国Thermofisher公司,NanoDrop);PCR扩增仪(美国Thermofisher公司,ABI miniAMP PCR);多功能酶标仪(瑞士Tecan公司,Infinite M Plex);倒置显微镜(日本OLYMPUS公司,KX-41型);多功能凝胶成像仪(美国UVP公司,Biospectrum615型)。
1.3 萤火虫荧光素酶报告基因质粒的构建
以hPPARα基因转录起始位点为+1,将hPPARα基因的5′端上游约2 kb的序列分为两个片段,命名为P1和P2。在后续的实验中,为了进一步研究SP600125调控hPPARα基因转录表达的顺式作用元件,将P2片段分为3个短片段,命名为P2-1、P2-2、P2-3。利用引物设计软件primer premier 6设计合成特异引物,所克隆片段及相应引物见表1。参考诺唯赞2×Taq Master Mix PCR试剂说明书,以HepG2细胞基因组DNA为模板PCR扩增hPPARα基因启动子片段,参考SfiⅠ限制性内切酶、T4 DNA连接酶、DH5α感受态细胞的说明书进行酶切、连接和转化,在报告基因质粒(pGL4-luc2P-Hygro)启动子上游插入hPPARα基因启动子片段,构建得到萤火虫荧光素酶报告基因质粒PGL4-P1、PGL4-P2(见图1)和PGL4-P2-1、PGL4-P2-2和PGL4-P2-3(见图2)。将构建得到的荧光素酶报告基因质粒转染HepG2细胞,转染24 h检测荧光素酶的表达,验证所克隆片段的转录活性。

图1 包含hPPARα基因启动子片段的萤火虫荧光素酶报告基因质粒示意图
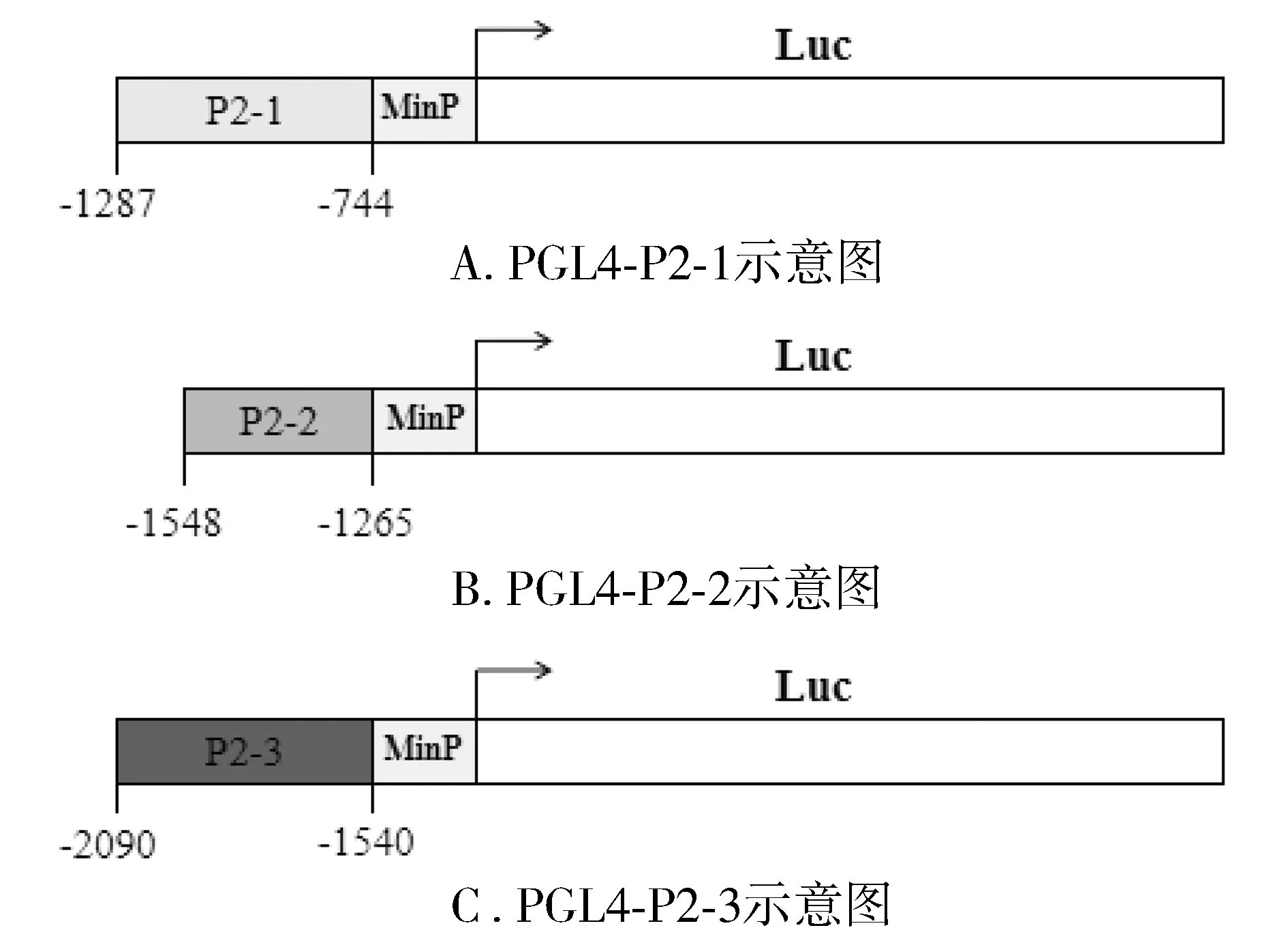
图2 包含P2截短片段的萤火虫荧光素酶报告基因质粒示意图

表1 DNA片段及相应引物序列
1.4 细胞培养
HepG2细胞培养在含有10%胎牛血清、1%青霉素/链霉素双抗的DMEM培养基中,于37 ℃、5% CO2、90%相对湿度的培养箱中培养。传代时用无菌PBS洗涤细胞1次,加入适量0.25%的胰酶消化液,置于细胞培养箱中静置消化3 min,加入等体积完全培养基终止消化,轻柔吹打成单细胞悬液,按照1∶4的比例分到新的培养皿中培养。HEK293T细胞培养条件同上,传代时加入适量胰酶消化液,静置消化30 s。
1.5 Western blot检测U0126、SP600125对ERK1/2、JNK1/2信号通路的抑制作用
通过Western blot检测ERK1/2信号通路小分子抑制剂U0126、JNK1/2信号通路小分子抑制剂SP600125在HepG2细胞中对ERK1/2、JNK1/2信号通路的抑制作用。参照说明书以及已发表文献中的常用浓度[8],分别用5 μmol/L和10 μmol/L的U0126或SP600125处理HepG2细胞,同时设置DMSO溶剂处理作为对照组,处理1 h,去除细胞培养液,用PBS洗涤1次,加入RIPA裂解液于冰上裂解细胞10 min,4 ℃离心收集上清,使用BCA蛋白定量试剂盒测定蛋白浓度。样品加入蛋白上样缓冲液,混匀后于100 ℃变性5 min。SDS-PAGE分离蛋白,转移到PVDF膜上,5%脱脂奶粉室温封闭1 h,使用1×TBST于室温摇床上洗膜3次,5 min/次。以适当比例稀释一抗(pERK1/2、pJNK1/2、ERK1/2、JNK1/2、β-actin稀释度均为1∶1 000),将膜与一抗于4 ℃孵育过夜。TBST洗膜后与稀释的辣根过氧化物酶标记二抗(1∶10 000)室温孵育1 h,TBST洗膜,加入ECL反应液,置于凝胶成像仪中进行曝光和图像采集。
1.6 细胞转染
以合适的密度将细胞铺到6孔板中,待细胞密度生长到90%~95%时进行转染,转染前更换新鲜的无抗生素完全培养基。每孔转染3 μg萤火虫荧光素酶报告基因质粒和20 ng海肾荧光素酶报告基因内参质粒,转染试剂用量为10 μl,质粒和转染试剂分别用200 μl opti-MEM培养基稀释,将稀释后的质粒和转染试剂混合均匀,静置15~20 min,滴入细胞培养孔中,轻轻摇匀,放入培养箱中培养6~8 h进行后续处理。
共转染hFXR过表达质粒(PCI-T7-hFXR)时,每孔转染2.5 μg hFXR过表达质粒、2.5 μg萤火虫荧光素酶报告基因质粒和20 ng海肾荧光素酶报告基因内参质粒。
1.7 双荧光素酶报告基因试验
1.7.1 细胞处理及分组 为了研究ERK1/2、JNK1/2信号通路以及胆汁酸对hPPARα转录表达的调控作用。在HepG2细胞中分别瞬时转染包含hPPARα基因启动子片段的荧光素酶报告基因质粒(PGL4-P1、PGL4-P2)以及阴性对照质粒(PGL4-basic),同时转染海肾荧光素酶报告基因质粒(phR-Luc)作为内参,转染6~8 h,用胰酶消化,离心收集细胞,以每个6孔板接种于30个96孔板孔的比例将细胞均匀分到96孔板中,分别用5 μmol/L U0126,5 μmol/L SP600125,50 μmol/L胆汁酸(CDCA、LCA、DCA、GDCA、UDCA)处理,同时设置DMSO溶剂处理作为对照组,每组3个重复。处理不同时间(12,24,36,48 h)进行双荧光素酶报告基因试验检测。
在过表达hFXR的HepG2细胞中研究hFXR对hPPARα转录表达的调控作用。首先使用带有3个串联FXRE的荧光素酶报告基因质粒(PGL4-3×FXRE)验证过表达的hFXR在HepG2细胞中的活性。在HepG2细胞中进行不同转染:PGL4-3×FXRE与PCI-T7-hFXR共转染;PGL4-3×FXRE与PCI-T7-EGFP(PCI-T7-hFXR的对照质粒)共转染;PGL4-basic与PCI-T7-hFXR共转染;PGL4-basic与PCI-T7-EGFP共转染,然后用2 μmol/L GW4064(FXR高效特异性激动剂)处理转染后的细胞;同时设置DMSO溶剂处理作为对照组,每组3个重复,处理48 h进行双荧光素酶报告基因试验检测。接下来检测hFXR对hPPARα基因启动子片段的调控作用,在HepG2细胞中进行分组转染:包含hPPARα基因启动子片段的荧光素酶报告基因质粒与PCI-T7-hFXR共转染、包含hPPARα基因启动子片段的荧光素酶报告基因质粒与PCI-T7-EGFP共转染、PGL4-Basic与PCI-T7-hFXR共转染、PGL4-Basic与PCI-T7-EGFP共转染,然后用2 μmol/L GW4064处理转染后的细胞,同时设置DMSO溶剂处理作为对照组,每组3个重复,处理48 h进行双荧光素酶报告基因试验检测。
1.7.2 双荧光素酶活性检测 细胞处理结束后,去除培养液,用PBS洗涤细胞1次,每孔加入60 μl报告基因细胞裂解液,室温裂解细胞5 min,吹打并吸取细胞裂解产物至1.5 ml离心管中,15 000g离心3 min,取上清用于检测。将10 μl上清加入96孔检测板,加入50 μl萤火虫荧光素酶检测试剂,迅速混匀后置于酶标仪中检测萤火虫荧光素酶活性(firefly luciferase activity,FLuc),再取10 μl同一上清,加入50 μl海肾荧光素酶检测试剂于酶标仪中检测海肾荧光素酶活性(renilla luciferase activity,RLuc)。以相对荧光素酶活性(FLuc/RLuc)反映所插入片段的转录活性强弱。以转染阴性对照质粒PGL4-basic的细胞中处理组与DMSO溶剂组的相对荧光素酶活性比值为1,对转染包含hPPARα基因启动子片段的荧光素酶报告基因质粒细胞中处理组与DMSO溶剂组的相对荧光素酶活性比值作归一化,得到相对荧光素酶活性变化倍数,消除质粒上启动子转录活性的本底变化,从而反映处理试剂对启动子片段的调控作用。
1.8 转录因子结合位点预测
为了进一步研究JNK1/2信号通路调控hPPARα转录表达的顺式作用元件,使用转录因子结合位点预测网站PROMO(http://alggen.lsi.upc.es/cgi-bin/promo_v3/promo/promoinit.cgi?dirDB=TF_8.3)和JASPAR(http://jaspar.genereg.net/)对P2片段上可能存在的JNK1/2信号通路下游转录因子结合位点(AP-1、c-Jun、cFos等)进行预测。
为了进一步研究FXR调控hPPARα基因转录表达的顺式作用元件,使用核受体结合位点预测网站(https://www.nubiscan.unibas.ch/)对P2片段上可能存在的FXR结合位点进行预测。
1.9 重组PCR定点突变
以突变位点为中心,设计1对部分重叠的正反向突变引物,所突变位点及相应突变引物见表2。使用两组引物分别进行PCR扩增:①片段全长的正向引物与突变位点的反向突变引物;②突变位点的正向突变引物与片段全长的反向引物。将PCR反应产物进行DNA Oligo退火,并以退火产物为模板,用片段的全长引物进行PCR扩增得到突变后的片段。

表2 突变的位点及相应突变引物序列
对P2-1片段中预测得到的两个c-Jun结合位点进行突变验证。c-Jun结合位点序列为TGA(C/G)TCA,将预测得到的位点1序列AGCGTCA突变为ATCTATT,位点2序列ACAAAGTCA突变为ACGTATTAG。将突变后的片段分别插入荧光素酶报告基因质粒(pGL4-luc2P-Hygro)的启动子上游,得到位点突变后的荧光素酶报告基因质粒PGL4-P2-1_MUT1和PGL4-P2-1_MUT2。
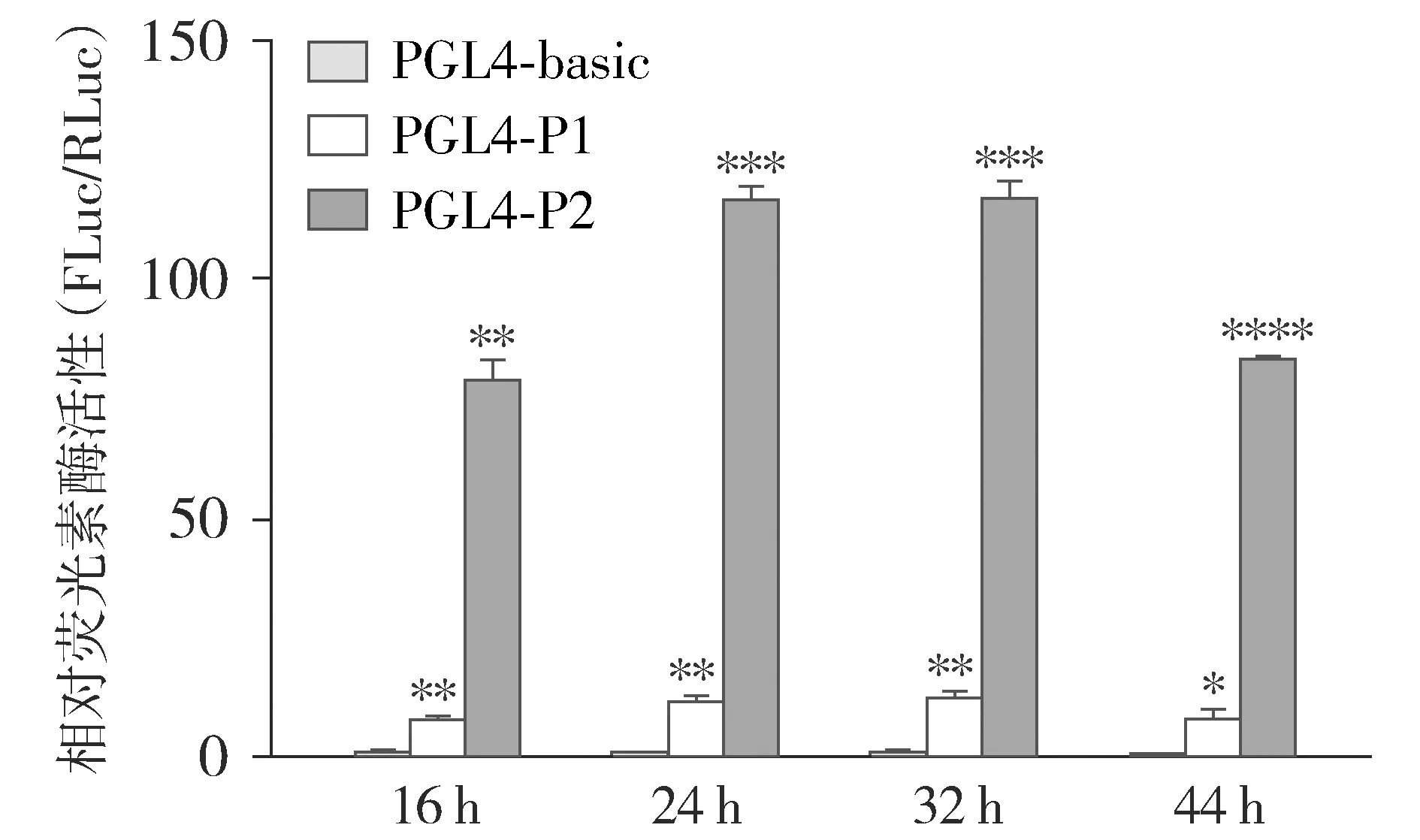
对预测得到的潜在FXR结合位点进行突变验证,FXRE片段为被一个核苷酸分隔的反向重复序列(AGGTCAnTGACCT),将预测所得到的潜在FXR结合位点序列GGGTCAcACACCT突变为GTAGGCcACATTA,将突变后的片段插入荧光素酶报告基因质粒(pGL4-luc2P-Hygro)的启动子上游,得到位点突变后的荧光素酶报告基因质粒PGL4-P2-3_MUT。
1.10 统计学分析
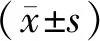
2 结果
2.1 hPPARα基因启动子片段的转录活性验证
双荧光素酶报告基因试验结果显示,与PGL4-basic相比,转染PGL4-P1、PGL4-P2质粒的HepG2细胞中相对荧光素酶活性显著上调,其中P2片段的转录活性更强(P<0.05,见图3)。转染PGL4-P2-1、PGL4-P2-2、PGL4-P2-3质粒的HepG2细胞中相对荧光素酶活性显著上调,其中P2-1片段的转录活性最强(P<0.000 1,见图4)。
与PGL4-Basic组相比,*P<0.05,**P<0.01,***P<0.001,****P<0.000 1

与PGL4-basic组相比,****P<0.000 1
2.2 ERK1/2、JNK1/2信号通路对hPPARα启动子片段转录活性的调控作用
Western blot结果显示,5,10 μmol/L的U0126显著抑制ERK1/2的磷酸化活性(P<0.01);5,10 μmol/L的SP600125显著抑制JNK1/2的磷酸化活性(P<0.01,见图5)。

与对应的DMSO组相比,*P<0.05,**P<0.01
双荧光素酶报告基因试验结果显示,5 μmol/L U0126处理的细胞中,P1、P2片段的启动子活性没有显著变化;5 μmol/L SP600125处理的细胞中,P1片段的启动子活性没有显著变化,而P2片段的启动子活性显著下调(P<0.05,见图6)。
2.3 SP600125对P2截短片段的调控作用
双荧光素酶试验结果显示,5 μmol/L SP600125处理对3个短片段的启动子活性均有显著的抑制作用(P<0.001,见图7)。

与PGL4-basic组相比,***P<0.001
2.4 P2片段中JNK1/2信号通路下游转录因子结合位点的预测及定点突变验证
P2-1片段中预测得到两个c-Jun结合位点(见图8)。双荧光素酶报告基因试验结果显示,位点1突变后SP600125对P2-1片段的抑制作用减弱了约13.3%(P<0.000 1),而位点2突变后SP600125的抑制作用未发生变化(见图9)。

图9 PGL4-P2-1质粒中的位点突变示意图及SP600125对突变前后P2-1片段的调控作用
2.5 FXR对hPPARα启动子片段转录活性的调控作用
双荧光素酶报告基因试验结果显示,在过表达hFXR的HepG2细胞中,转染PGL4-3×FXRE,GW4064处理48 h显著增强了相对荧光素酶活性(P<0.001,见图10)。过表达hFXR的HepG2细胞中,GW4064处理48 h,P1、P2片段的转录活性均显著上调(P<0.01,见图10)。

A.双荧光素酶报告基因试验检测HepG2细胞中过表达的hFXR活性 B.双荧光素酶报告基因试验检测hFXR对P1、P2片段的调控作用与PGL4-Basic组相比,**P<0.01,***P<0.001
2.6 P2片段中FXR潜在结合位点的预测及定点突变验证
P2片段中预测得到两个潜在的FXR结合位点,分别位于P2-2和P2-3片段上(见图11)。双荧光素酶报告基因试验结果显示,在过表达hFXR的HepG2和HEK293T细胞中,GW4064处理显著增加了P2-3片段的转录活性(P<0.01),而P2-2片段的转录活性仅在HEK293T细胞中显著增加(P<0.05,见图12)。对P2-3中的位点进行突变后,HepG2细胞中hFXR对P2-3片段转录活性的诱导作用减弱了约20%(P<0.05,见图13)。

图11 P2片段上所预测的FXRE位点示意图
图13 PGL4-P2-3质粒中FXRE位点突变示意图及突变前后hFXR对P2-3片段的调控作用
2.7 胆汁酸对hPPARα启动子片段转录活性的调控作用
双荧光素酶报告基因试验结果显示,未过表达hFXR的HepG2细胞中,50 μmol/L LCA处理24 h和48 h显著抑制了P2片段的启动子活性(P<0.05),而DCA、CDCA、GDCA和UDCA处理后,P2片段的启动子活性无显著变化(见图14)。进一步研究结果显示,50 μmol/L LCA处理24 h时,P2-1片段的启动子活性被显著抑制(P<0.05),P2-2和P2-3片段的启动子活性无显著变化(见图15)。100 μmol/L LCA处理24 h时,3个片段的启动子活性均被显著抑制(P<0.01或P<0.05),其中对P2-1片段的启动子活性抑制最强(见图15)。
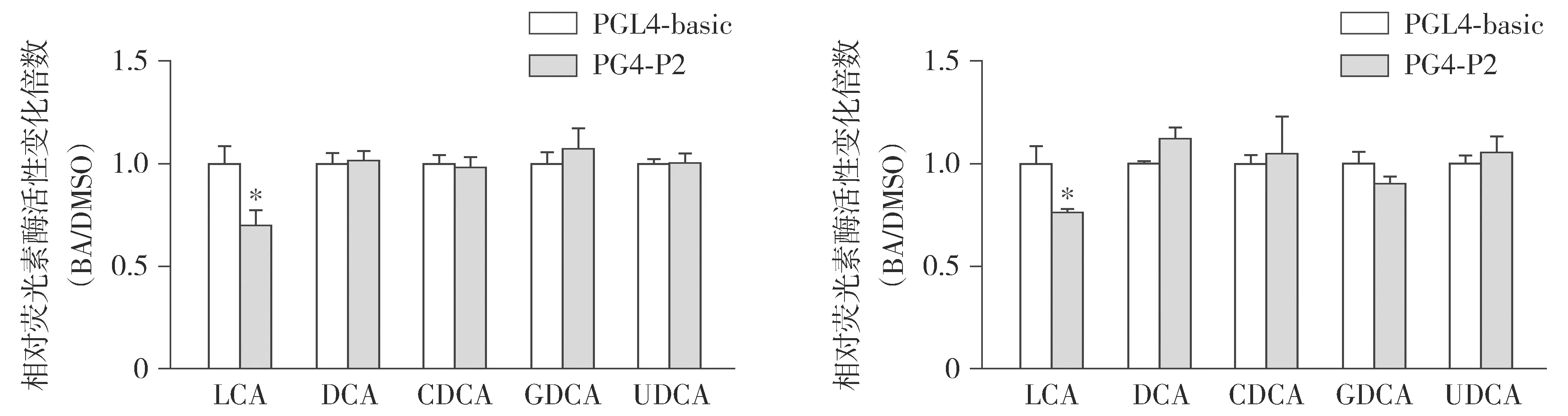
A.处理24 h B.处理48 h
3 讨论
NAFLD患病率逐年升高,已经成为世界范围内的主要公共健康威胁,其通常与肥胖、胰岛素抵抗、糖尿病、高血压、血脂异常、动脉粥样硬化、全身性炎症相关,是代谢综合征的肝脏表现[9-12]。PPARα是配体激活的转录因子,在体内参与脂质代谢、葡萄糖稳态、炎症和胰岛素信号等过程的调控,在NAFLD的发病过程中起重要的调节作用[13]。
基于FGF15转基因小鼠肝脏中PPARα及其下游靶基因水平显著上调的研究基础,本研究探究了HepG2细胞中FGF15/19下游的ERK1/2、JNK1/2信号通路以及胆汁酸对hPPARα转录表达的调控作用。首先构建包含hPPARα启动子片段的荧光素酶报告基因质粒并在HepG2细胞中验证了所克隆的片段具有转录活性,尤其P2片段中可能存在调控hPPARα基础转录表达的关键调节因子。本研究结果显示,P1、P2片段在HepG2细胞中对荧光素酶基因表达的调控作用随时间先增强后减弱,转染24,32 h的调控作用最强,因此后续实验中转染8 h的HepG2细胞,再继续处理12,16,24,36 h进行双荧光素酶报告基因试验检测。使用ERK1/2信号通路的选择性小分子抑制剂U0126和JNK1/2信号通路的选择性小分子抑制剂SP600125研究ERK1/2、JNK1/2信号通路对hPPARα基因启动子片段的调控作用。本结果表明抑制ERK1/2信号通路后,P1、P2片段的转录活性均无显著变化;抑制JNK1/2信号通路后,P1片段的转录活性无显著变化,而P2片段的转录活性被显著抑制。进一步研究结果表明,SP600125对P2片段的抑制作用是由片段中预测到的一个c-Jun结合位点部分介导的,表明JNK1/2信号通路参与调控hPPARα的基因转录,FGF19在体内可能通过激活JNK1/2信号通路调控PPARα的转录表达。
此外,胆汁酸、FXR、FGF15/19三者相互作用,在体内维持着动态平衡。FGF15转基因小鼠肝脏中PPARα及其下游靶基因水平的增加也可能是由于胆汁酸的水平和组成发生变化。FXR是胆汁酸的生理受体,是胆汁酸发挥调节作用的重要部分,许多研究显示了FXR和PPARα在NAFLD发病机制中的串扰作用[14,15]。文献报道,PPARa与FXR共同激活在特定生理条件或环境下可以对NAFLD产生积极信号,在NAFLD患者中联合使用PPARa与FXR激动剂可能是未来治疗NAFLD的一种新选择[16,17]。因此,本研究探究了FXR对hPPARα转录表达的调控作用,结果表明,在HepG2细胞中过表达hFXR,用GW4064激活后能够诱导P1、P2片段的转录活性。已有文献报道[18],胆汁酸通过激活FXR诱导hPPARα转录表达,并在hPPARα的启动子中验证了1个位于P1片段的FXR反应元件。本研究在P2片段中验证了1个新的FXR结合位点,该位点的发现为人类FXR和PPARα通路之间的串扰提供了更多的分子证据。
除了激活FXR之外,胆汁酸还可能激活其他的受体或信号通路调控hPPARα的转录表达。本研究结果表明,在没有过表达hFXR的HepG2细胞中,LCA处理显著降低了P2片段的启动子活性,并且可能主要作用于P2-1片段中的顺式作用元件。不同胆汁酸对受体的结合能力不同[19],对FXR的结合和激活能力CDCA>CA>LCA>DCA,这些胆汁酸在体内可能通过激活FXR调控PPARα的转录表达。由图10结果可知,在没有过表达hFXR的HepG2细胞中,转染PGL4-3×FXRE,GW4064处理没有增强相对荧光素酶活性,表明HepG2细胞中内源表达的FXR水平很低,因此LCA对P2片段的调控作用可能是独立于FXR的,可能通过LCA激活的PXR、VDR、CAR等受体或相关信号通路介导[19],其具体机制还需进一步研究。胆汁酸代谢与NAFLD的发生密切相关,许多研究表明,NAFLD患者的血液和肝脏中胆汁酸水平升高[20]。而还有一些研究表明,与健康人相比,NAFLD患者的总胆汁酸水平没有差异,但胆汁酸的组成发生了显著变化[21]。干扰胆汁酸合成和代谢的方法是目前防治NAFLD的重要研究方向[22]。本研究结果表明,胆汁酸调控PPARα的转录表达,体内胆汁酸池中CDCA等激活FXR的胆汁酸水平升高可能诱导hPPARα的转录表达,而LCA水平升高则可能抑制hPPARα的转录表达。不同胆汁酸对hPPARα的调控作用不同,表明胆汁酸的组成变化可能通过调控hPPARα的转录表达从而影响脂质代谢。
综上所述,本研究验证了JNK1/2信号通路、FXR以及LCA对hPPARα的转录调控作用,FGF19在体内调控hPPARα转录表达的机制一方面可能通过激活JNK1/2信号通路起作用,另一方面可能通过影响胆汁酸的水平和组成起作用。胆汁酸、FGF15/19、FXR、PPARα在NAFLD的病理机制中发挥着重要作用,是开发相关治疗药物的重要靶点,目前相关治疗药物的广泛使用受到其不良反应的限制,研究FXR、FGF19、胆汁酸调控PPARα的信号通路和参与作用的蛋白因子能为科学实验和临床研究提供更多的思路。
