基因沉默SIRT7抑制缺氧诱导的肺动脉平滑肌细胞增殖及迁移
2023-11-24高砚丽任引刚
张 莹,高砚丽,任引刚
(空军军医大学第二附属医院老年医学科,西安 710038;*通讯作者,E-mail:yingangr937@163.com)
肺动脉高压是一类常见的心血管疾病,预后极差,严重危害人类的健康[1]。肺动脉高压可导致右心室肥大和衰竭,最终引起死亡[2]。肺动脉高压的病理相当复杂,血管重塑被认为是肺动脉高压的主要病理特征[3]。平滑肌细胞过度增殖和肥大导致的中膜增厚,是血管重塑重要过程之一。在病理条件的刺激下,肺动脉平滑肌细胞由收缩型转化为合成型,合成型的平滑肌细胞具有更强的增殖和迁移能力,从而导致肺动脉中膜增厚,血管阻力增加,导致血管压力持续升高[4]。目前临床治疗肺动脉高压的效果并不令人满意,无法阻止和逆转疾病的进展过程[5]。肺动脉高压涉及多种基因的异常表达和信号通路的调控,发掘对肺动脉平滑肌增殖和迁移具有重要调控的基因,可为该疾病的临床治疗干预提供新的思路和治疗靶标。
转化生长因子-β1(transforming growth factor-β1,TGF-β1)是一个多能效的细胞因子,调控多种生物学过程,并参与多种疾病的发生和进展过程[6,7]。TGF-β1与转化生长因子β受体Ⅰ(transforming growth factor-β receptor Ⅰ,TβRⅠ)结合,引起细胞质内Smad2和Smad3的磷酸化,然后磷酸化的Smad2/3蛋白复合体入核,从而激活下游基因的表达[8]。激活后的TGF-β1/Smad信号通路可调控细胞增殖、迁移、细胞外基质合成、细胞分化和细胞表型转化等生物学功能[9]。据报道,TGF-β1/Smad信号通路的过度激活与肺动脉高压的进展密切相关[10]。TGF-β1/Smad信号通路通过促进肺动脉平滑肌细胞的过度增殖和迁移,引起血管重塑,导致肺动脉高压的发生[11]。靶向抑制TGF-β1/Smad信号通路已成为开发肺动脉高压治疗的新策略。因此,TGF-β1/Smad信号通路在肺动脉高压中的调控机制值得进一步的研究,探寻对该信号通路具有重要调控作用的分子,对于开发新的治疗方法具有十分重要的意义。
沉默信息调节因子2相关酶类7(silent information regulator 2 related enzyme 7,SIRT7)是SIRTs蛋白家族的重要一员,具有组蛋白去乙酰化酶和去琥珀酰化酶的活性[12]。SIRT7参与多种生物学过程,包括细胞衰老、细胞应激、代谢反应和炎症反应等,在多种病理条件下发挥关键作用[13,14]。据报道,SIRT7过表达能够促进气道平滑肌细胞的增殖和迁移[15],表明SIRT7可能参与平滑肌细胞表型转化。目前,关于SIRT7是否参与肺动脉平滑肌细胞的增殖和迁移,还没有相关研究。体外低氧培养人肺动脉平滑肌细胞(human pulmonary artery smooth muscle cells,HPASMCs)引起细胞的过度增殖和迁移,是体外模拟肺动脉高压研究的经典模型。本文通过该模型研究SIRT7对低氧诱导的HPASMCs增殖和迁移的调控作用,并探讨其可能的分子作用机制。
1 材料和方法
1.1 材料与试剂
HPASMCs购自美国菌种保藏中心ATCC;RNA提取试剂Trizol、CCK-8和EdU试剂盒购自上海碧云天生物科技有限公司;cDNA合成试剂盒和FastSYBR Mixture购自江苏康为世纪生物科技股份有限公司;蛋白提取试剂盒和蛋白浓度测定试剂盒购自北京全式金生物科技有限公司;LV-sh-SIRT7购自上海吉玛制药技术有限公司;AnnexinⅤ-FITC/PI凋亡试剂盒购自武汉伊莱瑞特生物科技股份有限公司;兔抗人SIRT7抗体、GAPDH抗体、TGF-β1抗体和HRP标记的山羊抗兔二抗购自武汉三鹰生物技术有限公司;兔抗人TβRⅠ抗体购自上海艾博抗贸易有限公司;兔抗人Smad2抗体、p-Smad2抗体、Smad3抗体和p-Smad3抗体购自美国Cell Signaling Technology公司。
1.2 实验方法
1.2.1 细胞培养和慢病毒感染 将HPASMCs接种于含平滑肌细胞生长因子的专属培养基中,置于5% CO2的培养箱中37 ℃生长。将HPASMCs接种于6孔板中(1×106个/孔),按感染复数(multiply of infection,MOI)为50加入慢病毒,并添加5 μg/ml Polybrene提高感染效率。将细胞板放回细胞培养箱孵育,24 h后更换新鲜培养基,继续培养3~4 d;中途更换细胞液,保持良好细胞状态。收集细胞检测靶基因表达变化,并进行后续实验。
1.2.2 细胞分组和处理 将HPASMCs分为:常氧对照组、低氧组、低氧+LV-sh-Ctrl组和低氧+LV-sh-SIRT7组。常氧对照组HPASMCs置于常氧培养箱中(含5% CO2和95%空气)孵育48 h。低氧组HPASMCs置于厌氧培养箱中(含3% O2、5% CO2和92% N2)孵育培养48 h,建立低氧诱导模型。低氧+LV-sh-Ctrl组HPASMCs感染对重组照腺病毒LV-sh-Ctrl,然后进行低氧处理。低氧+LV-sh-SIRT7组HPASMCs感染表达SIRT7 shRNA的重组腺病毒LV-sh-SIRT7,然后进行低氧处理。
1.2.3 RT-qPCR检测SIRT7的mRNA表达 待细胞处理完成,收集细胞,加入Trizol充分裂解细胞,按试剂盒步骤抽提细胞总RNA。采用SuperRT cDNA合成试剂盒,根据试剂盒操作步骤,将RNA逆转录为cDNA。将cDNA、FastSYBR Mixture和引物混合为20 μl反应体系,采取预变性95 ℃,20 s;40个循环的热循环程序(变性95 ℃,3 s;退火/延伸60℃,30 s)进行PCR扩增。以GADPH为内参基因,采用2-ΔΔCt公式分析RT-qPCR结果,计算基因相对表达水平。
1.2.4 Western blotting检测SIRT7、TGF-β1、TβRⅠ、p-Smad2和p-Smad3的蛋白表达 待细胞处理完成,收集细胞,加入蛋白提取缓冲液和蛋白酶抑制剂,充分裂解细胞,提取细胞总蛋白。测定蛋白浓度后,按30 μg/孔将蛋白样品加到配置好的浓缩胶孔中,进行SDS-PAGE电泳。电泳完成,将蛋白从分离胶中转移到PVDF膜上。将膜放入5%脱脂奶粉中,室温封闭1 h。将膜放入一抗稀释液(SIRT7抗体稀释度为1∶1 000;TGF-β1抗体稀释度为1∶800;TβRⅠ抗体稀释度为1∶1 000;Smad2抗体稀释度为1∶1 000;p-Smad2抗体稀释度为1∶500;Smad3抗体稀释度为1∶1 000;p-Smad3抗体稀释度为1∶500;GAPDH抗体稀释度为1∶2 000),4 ℃摇床过夜。TBST洗膜,放入到二抗的稀释液(稀释度为1∶5 000)中,室温孵育1 h。二抗孵育完成后,TBST洗膜。将ECL发光液均匀涂抹膜上,孵育2 min。将膜放入成像仪中,进行成像和拍照。
1.2.5 CCK-8检测细胞生长活性 将HPAMSCs集中到96孔中,置于5% CO2的培养箱中37 ℃过夜培养,使细胞贴壁。待细胞处理完成,加入CCK-8溶液(10 μl/孔),继续培养2 h。采用酶标仪测定细胞溶液在450 nm波长处的吸光度。
1.2.6 EdU检测细胞增殖 将HPAMSCs接种在盖玻片上,待细胞处理完成,将EdU溶液加入到细胞培养孔中,使终浓度达到20 μmol/L,细胞继续培养2 h。吸去培养液,加入4%多聚甲醛,室温固定15 min。洗涤细胞,然后加入含0.3% Triton X-100的PBS,室温避光孵育30 min。洗涤细胞后,加入DAPI溶液,室温避光孵育10 min,对细胞核进行染色。采用抗荧光淬灭封片液封片,荧光显微镜检测和拍照,选取固定视野对EdU阳性细胞(绿色荧光)数量和细胞核(蓝色)数量计数,计算细胞增殖率。
1.2.7 Annexin Ⅴ-FITC/PI凋亡实验 待细胞处理完成后,采用胰酶消化细胞,PBS洗涤和重悬细胞,进行计数。收集2×105个细胞,重悬在500 μl的1×Annexin Ⅴ Binding Buffer缓冲液中,并加入5 μl的Annexin Ⅴ-FITC和5 μl的PI染色液。室温避光孵育20 min,反应完成后,立即采用式细胞仪分析细胞凋亡比例。
1.2.8 Transwell细胞迁移实验 收集HPASMCs重悬在不含血清生长因子的培养基中,并加入到Transwell小室(200 μl/孔)。将500 μl含血清生长因子的完全培养基加入到下室。将细胞放入厌氧培养中,低氧诱导48 h。取出小室,用棉签擦除上层残留的细胞,加入4%多聚甲醛溶液固定30 min;洗涤后,加入0.1%结晶紫溶液染色20 min。洗涤并干燥后,采用倒置显微镜观察和拍照。随机选取3个固定大小的视野,进行计数统计分析。

2 结果
2.1 低氧处理HPAMSCs对SIRT7表达的影响
RT-qPCR结果显示,与常氧对照组比较,低氧组SIRT7的mRNA表达水平升高,差异有统计学意义(P<0.01,见图1A)。Western blotting结果显示,与常氧对照组比较,低氧组SIRT7的蛋白表达量显著增加(P<0.01,见图1B),与SIRT7的mRNA表达水平变化一致。

A.RT-qPCR检测SIRT7 mRNA表达变化 B. Western blotting检测SIRT7蛋白表达变化
2.2 感染慢病毒LV-sh-SIRT7对HPAMSCs中SIRT7表达的影响
RT-qPCR结果显示,与低氧组和低氧+LV-sh-Ctrl组比较,低氧+LV-sh-SIRT7组SIRT7的mRNA表达水水平显著降低(P<0.01,见图2A)。Western blotting结果显示,与低氧组和低氧+LV-sh-Ctrl组比较,低氧+LV-sh-SIRT7组SIRT7的蛋白表达量显著减少(P<0.01,见图2B)。

A.RT-qPCR检测SIRT7 mRNA表达变化 B.Western blotting检测SIRT7蛋白表达变化
2.3 基因沉默SIRT7对低氧诱导的HPASMCs生长和增殖的影响
CCK-8结果显示,与常氧对照组比较,低氧组和低氧+LV-sh-Ctrl组HPASMCs的生长活性升高(P<0.01);与低氧组和低氧+LV-sh-Ctrl组比较,低氧+LV-sh-SIRT7组HPASMCs的生长活性显著降低(P<0.01,见图3)。EdU结果显示,与常氧对照组比较,低氧组和低氧+LV-sh-Ctrl组HPASMCs的增殖率显著增加(P<0.01);与低氧组和低氧+LV-sh-Ctrl组比较,低氧+LV-sh-SIRT7组HPASMCs的增殖率显著降低(P<0.01,见图3)。
2.4 基因沉默SIRT7对低氧处理的HPASMCs凋亡的影响
细胞凋亡实验结果显示,与常氧对照组比较,低氧组和低氧+LV-sh-Ctrl组HPASMCs的凋亡率降低(P<0.05);与低氧组和低氧+LV-sh-Ctrl组比较,低氧+LV-sh-SIRT7组HPASMCs的凋亡率显著升高(P<0.01,见图4)。

图4 流式细胞术检测基因沉默SIRT7对低氧处理的HPASMCs凋亡的影响
2.5 基因沉默SIRT7对低氧诱导的HPASMCs迁移的影响
Transwell结果显示,与常氧对照组比较,低氧组和低氧+LV-sh-Ctrl组HPASMCs的迁移水平升高(P<0.01);与低氧组和低氧+LV-sh-Ctrl组比较,低氧+LV-sh-SIRT7组HPASMCs的迁移水平显著降低(P<0.01,见图5)。
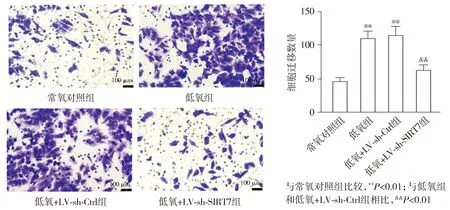
图5 Transwell实验检测基因沉默SIRT7对低氧诱导的HPASMCs迁移的影响 (×200)
2.6 基因沉默SIRT7对低氧诱导的HPASMCs中TGF-β1/Smad信号通路的影响
Western blotting结果显示,与常氧对照组比较,低氧组和低氧+LV-sh-Ctrl组TGF-β1、TβRⅠ、p-Smad2和p-Smad3蛋白表达量增加(P<0.01);与低氧和低氧+LV-sh-Ctrl组比较,低氧+LV-sh-SIRT7组TGF-β1、TβRⅠ、p-Smad2和p-Smad3的蛋白表达量显著减少(P<0.01,见图6)。
3 讨论
肺动脉高压的发病机制涉及多种基因的异常表达和信号通路的异常调控。肺动脉平滑肌细胞介导的血管重塑是肺动脉高压发病的重要因素。鉴定对肺动脉平滑肌细胞异常增殖和迁移具有调控作用的基因,对于了解肺动脉高压的发病机制,具有十分重要的意义。本文通过低氧处理HPASMCs建立肺动脉高压研究的一个常用细胞模型,发现基因敲除SIRT7有效抑制低氧诱导的HPASMCs过度增殖和迁移,并且抑制TGF-β1/Smad信号通路的激活。本研究表明SIRT7可能通过调控TGF-β1/Smad信号通路在肺动脉高压的血管重塑过程中发挥重要作用。
SIRT7对于细胞的存活和增殖具有重要的调控作用。SIRT7在代谢活跃的细胞中高表达,并且通过调控rDNA的转录来促进细胞周期的进展[16,17]。在一些压力应激条件下,SIRT7能够抑制细胞凋亡和损伤,提高细胞的存活[18]。但是,细胞过度的增殖和存活会导致其他疾病发生,例如肿瘤。据报道,SIRT7在多种肿瘤组织中高表达,并且促进肿瘤细胞的增殖和迁移[19-21]。目前,关于SIRT7是否参与调控肺动脉平滑肌细胞的增殖和迁移,尚未有研究报道。本研究发现,SIRT7在低氧处理的HPAMSCs中表达水平升高。通过基因沉默技术敲低SIRT7在HPAMSCs中的表达水平,则可抑制低氧诱导的细胞增殖和迁移,同时促进细胞的凋亡发生。本研究结果与过往研究发现一致,表明SIRT7对细胞增殖、迁移和凋亡具有重要调控作用,其介导的肺动脉平滑肌细胞的增殖和迁移可能在肺动脉高压发病过程中发挥关键作用。
既往研究表明,SIRT7高度参与平滑肌细胞的表型转换,而平滑肌细胞表型的转换是多种疾病发生的基础。Fang等[15]报道SIRT7能够促进气道平滑肌细胞的增殖和迁移,与哮喘中的气道重塑密切相关。在体外培养的血管平滑肌细胞中,基因沉默SIRT7显著抑制细胞的增殖和迁移能力[22]。另外,在小鼠股动脉损伤模型中,敲除SIRT7可以减轻内膜的增生,与抑制血管平滑肌细胞的增殖密切相关[22]。这些研究表明,SIRT7与平滑肌细胞过度增殖和迁移密切相关。本研究结果显示,基因沉默SIRT7有效抑制低氧诱导的肺动脉平滑肌细胞的增殖和迁移,表明SIRT7是肺动脉平滑肌细胞增殖和迁移的促进调控因子。然而,有一些研究也表明SIRT7对平滑肌细胞的增殖和迁移具有抑制作用。在氧化型低密度脂蛋白刺激的血管平滑肌细胞中,过表达SIRT7可以抑制血管平滑肌细胞的增殖和迁移[23]。因此,SIRT7可能在不同的病理条件下对平滑肌细胞的增殖和迁移发挥不同的调控作用。本研究结果支持SIRT7对平滑肌细胞的增殖和迁移发挥促进作用。鉴于此,SIRT7在不同病理条件下对不同类型的平滑肌细胞的调控作用,值得进一步研究和探讨。
TGF-β1/Smad信号通路是调控肺动脉高压中血管重塑的一个关键信号通路[10]。TGF-β1通过与细胞膜受体TβRⅠ结合,引起Smad2/3的磷酸化,引起下游通路的激活,从而促进肺动脉平滑肌细胞的增殖和迁移,导致肺动脉高压的发生和进展[24]。鉴定对TGF-β1/Smad信号通路具有调控作用的分子,对于开发靶向抑制TGF-β1/Smad信号通路治疗肺动脉高压具有十分重要的意义。目前,多项研究已表明,SIRT7对TGF-β1/Smad信号通路调控具有重要的调控作用。在心肌纤维细胞中,基因沉默SIRT7抑制TGF-β1/Smad信号通路的激活,从而减轻心肌纤维化的发生[25]。基因沉默SIRT7通过抑制TGF-β1/Smad信号通路的激活,降低瘢痕成纤维细胞的增殖水平,并且促进细胞凋亡的发生[26]。在气道平滑肌细胞中,基因沉默SIRT7通过抑制TGF-β1/Smad信号通路的激活来减弱细胞的增殖和迁移能力[15]。这些研究表明,SIRT7对TGF-β1/Smad信号通路的激活发挥促进作用。本研究发现,基因沉默SIRT7可降低TGF-β1、TβRⅠ、p-Smad2和p-Smad3在低氧处理的HPASMCs中的表达水平。因此,本研究结果与过往报道一致,进一步证明了SIRT7是TGF-β1/Smad信号通路激活的关键调控分子。
综上所述,基因沉默SIRT7抑制低氧诱导的HPASMCs的增殖和迁移,其作用机制可能与抑制TGF-β1/Smad信号通路密切相关。本研究表明SIRT7通过调控肺动脉平滑肌细胞的增殖和迁移介导血管重塑的发生,在肺动脉高压的发病过程中发挥重要作用。本研究为解释肺动脉高压的分子发病机制提供了新的思路,为临床治疗方法的研发提供了新的靶标和理论基础。但是,肺动脉高压发病机制相当复杂,仅凭体外细胞研究数据,还不能说明SIRT7在肺动脉高压的发病过程中的重要性。因此,关于SIRT7在肺动脉高压发病中的明确作用和分子机制还需通过开展动物模型实验进行更深入的研究和验证。
