多期增强联合iShim-DWI与T2WI对T1和T2期直肠癌术前分期的对照研究
2023-11-23张风光杨开兰张宏凯赵可可高朋瑞杜峰白冰妹黎海亮曲金荣
张风光,杨开兰,张宏凯,赵可可,高朋瑞,杜峰,白冰妹,黎海亮,曲金荣
目前,全直肠系膜切除术(total mesorectal excision,TME)仍是治疗直肠癌的标准术式,辅以放化疗可显著降低肿瘤复发率[1]。临床上T分期为T2期的直肠癌患者,首选治疗方式是直接行手术切除;而部分T1期患者可选择内镜下粘膜切除术或经肛门内镜显微术,从而保留患者肠道功能,降低手术带来的损伤[2]。因此直肠癌术前T1和T2期准确分期对手术治疗方式的选择有重要的指导意义。MRI是对直肠癌原发肿瘤进行术前分期的重要影像学检查[3-4],主要采用小视野(FOV)不压脂T2WI作为分期的主要依据,而多期增强扫描及DWI通常仅为参考序列。因为目前的影像检查无论是MRI还是腔内超声均不能提供完全准确的分期,如腔内超声仅对于T2期以内小肿瘤有优势,而MRI判读T3分期存在过分期的可能[5]。最近Wan等[6]研究发现由于直肠粘膜下层有丰富的血管结构,增强扫描后可见强化的血管主干,只要其存在,至少说明肿瘤没有侵透粘膜下层,有助于T1期诊断,对T0~T1、T2期总的准确率可提高到87%。DWI通过探测水分子的运动情况反映其在人体内的扩散程度,细胞间水分子的扩散程度是否受限反映了组织结构的致密性,目前已广泛应用于肿瘤的术前检测及疗效评估等[7]。但传统DWI易受肠蠕动伪影和磁敏感伪影的干扰,应用于肠道检查时价值有限。近年来研究表明,单层动态匀场技术(integrated slice-specific dynamic shimming,iShim)在扫描过程中可实时优化每层图像的磁场均匀性,能够有效提高图像分辨率及改善图像变形。因此,本研究进一步探讨动态增强联合iShim-DWI在鉴别T1和T2期直肠癌中的诊断价值,并与单独使用T2WI的评价结果进行对照研究,进一步提高直肠癌术前T1与T2期分期的准确性,有利于手术方式的选择。
材料与方法
1.入组资料
回顾性筛选2020年1月-2021年12月本院经术前肠镜活检病理证实的直结肠癌患者,本研究经本院伦理委员会批准,知情同意书可以免除。入组标准为:①患者行磁共振T2WI、iShim-DWI、多期增强检查,各序列图像满足诊断需求;②临床资料及术后病理完整;③术前未做相关治疗;④MRI检查前2天内未做肠镜下活检;⑤术前肠镜活检病理证实的直肠癌。排除不能在MRI检查后2周内行手术治疗的患者和所有术后大体病理证实为非直肠癌患者。本研究最终纳入患者122例,男75例,女47例;年龄34~77岁,平均(48.5±9.0)岁;术后大体病理结果为绒毛状/管状腺瘤伴高级别上皮内瘤变,局灶癌变8例,隆起型腺癌83例,溃疡型腺癌31例;病理分期T1期53例,T2期69例,其中侵犯浅肌层39例,侵犯深肌层30例。
2.MRI检查
采用3.0T MR扫描仪(MAGNETOM Skyra,Siemens Healthcare,Erlangen,Germany),使用腹部8通道相控线圈,所有患者在检查前12 h清肠准备,检查前15~20 min肌注10 mg盐酸山莨菪碱注射液,并确认患者无相关禁忌症。
先行常规T2WI扫描,后行iShim-DWI扫描。具体扫描参数为:横轴面常规T2WI,TR 10000 ms,TE 123 ms,FOV 260 mm×260 mm,体素0.87 mm×0.68 mm×4.0 mm;iShim-DWI,TR 5200 ms,TE 68 ms,FOV 220 mm×220 mm,体素1.7 mm×1.7 mm×4.0 mm;T1VIBE多期增强,TR 3.41 ms,TE 1.33 ms,FOV 380 mm×380 mm,体素1.1 mm×1.1 mm×2.4 mm,层厚2.4 mm,期相为8期,注入对比剂后20 s开始连续扫描2个动脉期、间隔20 s后连续扫描2个静脉期、间隔20 s、20 s、30 s扫描3个延迟期,多期增强扫描时间约192 s。增强扫描经肘静脉注入Gd-DTPA 15 mL,流率2.5 mL/s。
3.MRI图像分析
由具有10年以上腹盆部MRI影像诊断经验的影像科医师在不知病理分期结果的情况下独立分别对T2WI、动态增强联合iShim-DWI进行分析,每位医师先独立阅读T2WI图像,至少间隔7天后阅读动态增强和iShim-DWI图像;然后,两位医师一起共同协商阅片,采集统一意见为最终分期结果,并将分期结果与术后病理分期进行对照分析,同时有一位病理医师进行病理图片解读。根据第7版美国癌症联合委员会(American Joint Committee on Cancer,AJCC)发布的直肠癌TNM分级系统来评价[8]。T分期:T1期肿瘤侵犯黏膜下层,T2期为肿瘤侵犯肌层但未突破肌层,T3期为肿瘤突破肌层浸润直肠系膜但未侵犯直肠筋膜,T4期为肿瘤侵犯直肠筋膜或周围器官。MRI根据肿瘤信号侵犯肠壁深度及肌层外侵犯情况来分期。
具体图像评价指标包括:T2WI高信号的粘膜下层是否完整,T2WI上固有肌层的低信号是否中断,肠壁外缘是否光整;DWI序列观察病变基底部低信号主干是否存在及完整,低信号粘膜下层是否完整,直肠肌层是否完整连续;多期增强图像选择延迟期图像为主进行评价,评价欠满意时结合动脉期及门脉期图像。增强扫描序列评价包括病变粘膜下强化条纹是否存在及完整,肌层信号是否完整。另外观察病变形态(隆起型及扁平型),肿瘤在各序列所显示的信号特征。
4.统计分析
所有数据采用SPSS 17.0统计软件进行分析,使用Kappa一致性检验评估两位放射科医师对T分期的一致性(kappa值为0~0.20一致性较差;0.21~0.40一致性一般;0.41~0.60一致性中等;0.61~0.80一致性较好;0.81~1.00一致性非常好)。直肠癌MRI的T分期结果与术后病理T分期结果进行对照,分别计算动态增强联合iShim-DWI,单独T2WI对直肠癌T分期诊断符合率以及诊断敏感度、特异度、阳性预测值(positive predictive value,PPV)、阴性预测值(negative predictive value,NPV)。采用χ2检验比较两种技术诊断符合率差异,P<0.05为检验标准。采用受试者操作特征(receiver operating characteristic,ROC)曲线分析比较T2WI与多期增强联合iShim-DWI对T分期的准确性。
结 果
两位放射科医师采用多期增强联合iShim-DWI评估直肠癌的T分期时一致性非常好(Kappa值=0.852,P<0.001),在单独使用T2WI进行T分期时,两者放射科医师评估结果的一致性也非常好(Kappa值=0.836,P<0.001)。
122例直肠癌病变在常规T2WI呈稍高或稍低信号,较粘膜下层信号低,较粘膜层信号高,在DWI序列呈中高信号,在动态增强序列早期中度强化,部分明显强化,延迟期信号减低或呈等信号。122例病例中,T1期增强序列显示粘膜下强化条纹37例,DWI序列显示病变基底部低信号主干存在30例。
T2WI术前诊断T1期直肠癌的诊断符合率为62.3%,其中46例过高分期;增强联合iShim-DWI序列术前诊断T1期直肠癌的诊断符合率为87.7%,其中12例过高分期,两者的诊断符合率差异有统计学意义(χ2=44.01,P<0.05,表1)。T2WI术前诊断T2期直肠癌的诊断符合率为46.7%,其中29例过高分期;增强联合iShim-DWI序列术前诊断T2期直肠癌的诊断符合率为85.2%,其中7例过高分期,3例被低估,两种技术的诊断符合率差异有统计学意义(χ2=12.90,P<0.05,表1)。
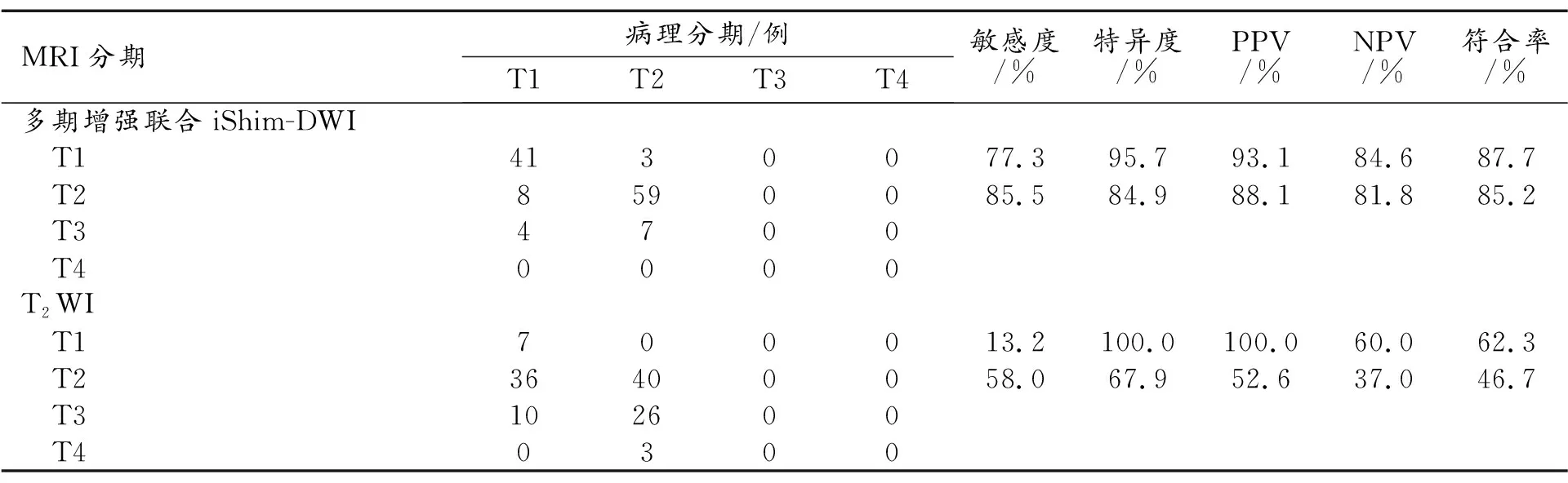
表1 多期增强联合iShim-DWI与T2WI对直肠癌T分期的结果
增强联合iShim-DWI、T2WI对直肠癌MRI的T1、T2分期敏感度、特异度、PPV、NPV见表1,动态增强联合iShim-DWI与常规T2WI诊断T1分期的ROC曲线下面积分别为0.865(95%CI:0.792~0.939)和0.566(95%CI:0.462~0.670),诊断T2分期的ROC曲线下面积分别为0.852(95%CI:0.778~0.926)和0.450(95%CI: 0.347~0.553),见图3、4。增强联合iShim-DWI曲线下面积均大于T2WI。
讨 论
直肠癌是临床上常见的恶性肿瘤之一,患者的死亡率降低与早期筛查诊断、治疗方式完善有着直接联系[9-10]。T分期作为直肠癌预后的独立影响因素之一,直接决定临床治疗方案的选择[11]。MRI具有极好的软组织分辨率及多序列、多参数、多平面成像的优势,在判断肿瘤侵犯深度、淋巴结转移、系膜筋膜浸润情况及肠壁外血管侵犯等方面均优于其他检查。但MRI在肿瘤接近或是侵犯分期临界面时(粘膜下层与肌层、肌层与肠周脂肪)判断有一定难度[12],MRI直肠癌T1期与早期T2期的鉴别是T分期的难点之一。
目前直肠癌MRI分期主要采用小FOV不压脂T2WI序列作为分期的主要依据[13,14],其图像显示低信号的粘膜、肌层与中高信号粘膜下层及周围高信号脂肪背景形成良好对比,同时病变呈稍低信号;粘膜下层高信号的存在及肌层低信号的连续性是在T2WI上区分T1与T2期的主要鉴别点。但对于部分接受放化疗治疗的患者,由于治疗后肿瘤周围的炎性水肿、纤维化等因素影响,会增加误判的可能性[15-16],肿瘤周围的炎症反应、局部纤维化在MRI上可表现为与肿瘤浸润突破肠壁类似的征象[17]。此外,T2期肿瘤边缘常出现条索状、毛刺状等异常信号与肿瘤实性成分难以区分,这是由于促纤维增生性反应所致,同时由于扫描角度、人为评价误差、固有肌层血管穿行等因素,导致肌层边缘不连续,往往导致过高分期;当粘膜水肿时,T2WI粘膜下高信号增宽显示较好,当粘膜下层较薄时,高信号连续性显示不佳,肿瘤T1期诊断困难。在肌层连续的情况下,肿块比较大,如病变位于粘膜下与肌层分界不清的情况下,T1与T2鉴别困难。本研究中T1期中有36例高估为T2期,主要由于粘膜下层高信号显示模糊,与浅肌层分界不清;T1期中有10例、T2期中有26例高估为T3期,主要由于肿瘤周围炎性条索、扫描层面未能垂直病变导致肌层信号模糊不连续,从而导致过高分期。
由于直肠粘膜下层有丰富的血管结构,增强扫描后可见强化的血管主干,只要其存在,至少说明肿瘤没有浸透粘膜下层,有利于对T1期诊断;同时肌层外纤维组织增强后往往呈延迟强化,而肿瘤组织信号减低,有利于对T2期诊断,避免过高分期。本研究中53例T1期病变中增强序列显示粘膜下强化条纹征象37例,均与大体病理分期相符合。但增强扫描也有其局限性,直肠病变、粘膜下层强化程度有时同肌层,不易区分,肌层边缘不一定显示完整。单独使用时对T2期有时易高估为T3期;另外由于强化的肌层折入病变基底部时,单独使用易误认为粘膜下强化条纹,造成低估为T1期,本研究中有3例T2期低估为T1期。另外粘膜下增强条纹对隆起型病变显示较为清晰,对肠壁局限性增厚病变显示欠佳。本研究中动态增强联合iShim-DWI序列术前直肠癌T1分期诊断符合率为87.7%,与文献中[6]研究结果基本一致。
DWI为现阶段唯一观察活体水分子微观运动的成像方式[18-19],通过测定水分子扩散情况反映细胞组织、细胞膜完整性。与纤维增生组织相比,肿瘤组织由于肿瘤细胞的过度异常增殖,肿瘤实质细胞密度更高,间隙更小,在DWI序列中呈明显高信号,有助于区分肿瘤纤维化与直肠周围间隙中促纤维增生反应。同时直肠粘膜下层在DWI序列上呈低信号,其病理基础主要是血管及间质、脂肪组织成分为主,有利于辅助增强序列判断血管主干完整性;另外在DWI序列上肿瘤实质为高信号,粘膜及肠腔粘液呈中高信号,肌层稍低信号,粘膜下层呈低信号,病变与粘膜下层、肌层信号存在明显差异,有利于判断其是否受侵,增强T1及T2期鉴别敏感度。
传统DWI序列应用于肠道检查时,易受肠蠕动伪影及磁敏感伪影干扰,导致图像质量不佳及图像变形。iShim-DWI是在常规单次激发EPI序列的基础上采用逐层动态匀场的方式,使采集区域B1场均匀度大幅提高,降低了相邻两种磁化率差别较大的组织引起的的磁敏感伪影,明显提高了图像的成像质量,很大程度上改善了图像的几何变形和减轻了伪影。目前,iShim在乳腺、前列腺、膀胱、肾脏、甲状腺和全身扩散方面有较多的研究和较好的图像质量[20-24], 然而在直肠癌诊断图像质量方面的报道较少。本研究采用iShim-DWI 技术,使病变及粘膜下低信号显示更加清晰,有效提高图像分辨率及改善图像变形。DWI和增强序列联合应用,可以明显提高T1和T2期诊断。笔者认为,在肌层连续的情况下,如没有出现粘膜下强化带及DWI低信号主干,倾向于提示T2期诊断可能性,如出现则提示T1期诊断可能性。DWI粘膜下低信号存在(图1、2)提示至少没有侵及肌层。另外DWI序列对显示肌层边缘连续性效果较好,可弥补增强序列不足,有助于T2期鉴别。本研究中4例增强序列粘膜下条纹主干显示不清,DWI序列弥补其不足,清晰显示粘膜下低信号轮廓,纠正分期,提高T1期诊断符合率。但部分病例中也存在DWI序列粘膜下低信号显示模糊,而增强扫描序列粘膜下强化条纹显示较清晰,二者互相弥补,增强鉴别敏感度。

图1 a)T2WI横轴面示管壁增厚呈软组织影,管壁边缘毛糙,周围可见索条影,同时粘膜下高信号影显示不清,对粘膜下及肌层侵犯不易判断;b)DWI(b值=800 s/mm2)示病变扩散受限呈中高信号,肌层边缘连续,根部可见低信号影(箭),提示粘膜下层血管及纤维脂肪组织;c)增强横轴面示肌层边缘连续,可见粘膜下强化条纹影(箭);d)增强矢状面示肌层边缘连续,可见粘膜下强化条纹影(长箭),部分可见二级分支(短箭),说明肿瘤没有浸透粘膜下层,提示T1期;e)镜下见肿瘤细胞(长箭)侵及粘膜下层(短箭,HE,×100)。图2 a)T2WI横轴面示管壁不均匀增厚,管壁边缘毛糙,周围可见索条影,对粘膜下及肌层侵犯不易判断;b)DWI(b值=800 s/mm2) 示病变扩散受限呈中高信号,粘膜下层呈低信号(长箭),肌层边缘连续,局部低信号粘膜下层中断不连续(短箭),提示侵及肌层;c)增强横轴面示病变呈稍低信号,肌层边缘完整,结合DWI,提示T2期;d)镜下见肿瘤细胞(长箭)侵及肌层(短箭,HE,×100)。
本研究ROC曲线分析(图3、4)提示,增强联合iShim-DWI对直肠癌T1、T2分期的诊断效能高于常规T2WI,对直肠癌MRI的T1分期敏感度、NPV、符合率高于T2WI,对直肠癌MRI的T2分期敏感度、特异度、PPV、NPV、符合率高于T2WI。
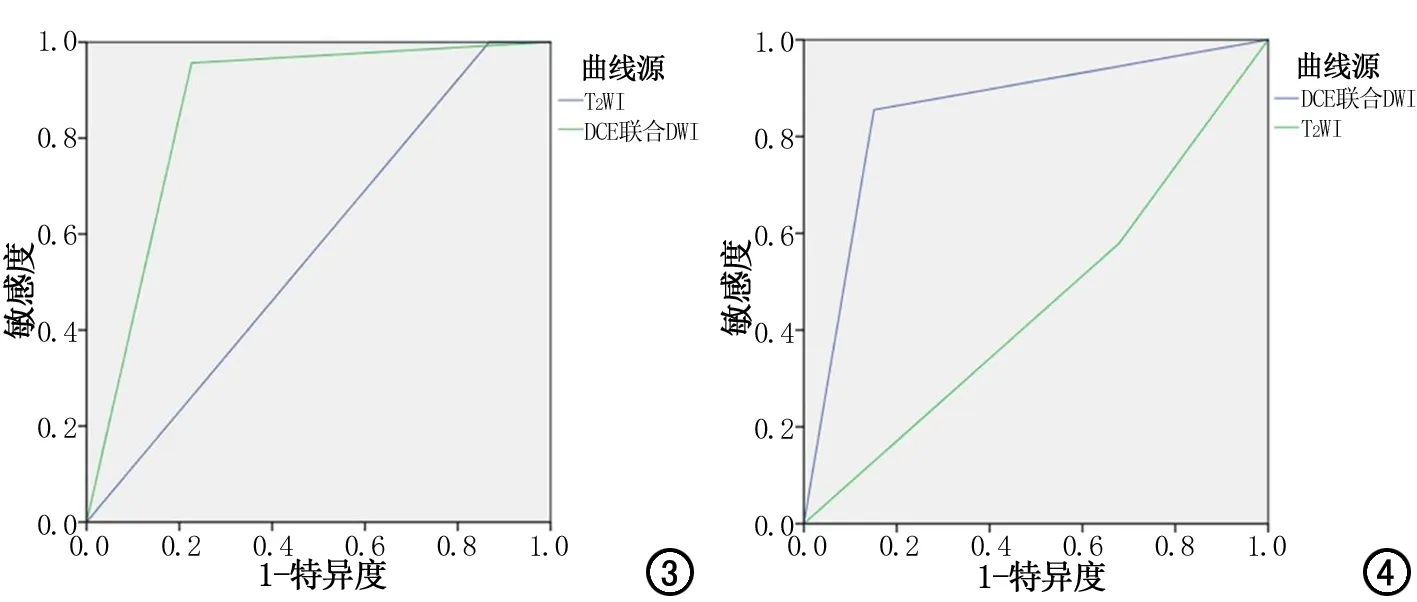
图3 动态增强联合DWI-iShim与常规T2WI诊断T1分期的ROC曲线。ROC曲线下面积分别为0.865和0.566。 图4 动态增强联合DWI-iShim与常规T2WI诊断T2分期的ROC曲线。ROC曲线下面积分别为0.852和0.450。
本研究也有一定的局限性:增强序列显示的粘膜下条纹主干及DWI显示的粘膜下条状低信号影的存在对病变是否局限于粘膜层鉴别能力有限,仅能提示至少没有浸透粘膜下层,粘膜下血管主干及二级血管分支完整可能提示病变局限于粘膜层,由于例数较少尚需要进一步研究。另外,本研究中T1期病例相对较少,需要加大样本量进一步研究证实。
综上所述,与T2WI相比,磁共振多期增强联合iShim-DWI有助于提高直肠癌T1及T2期分期的准确性,可作为直肠癌T分期的主要参考序列,对手术治疗方式的选择有重要的指导意义,有助于改善临床个体化治疗策略。
