基于CESM影像与病理指标预测乳腺癌HER-2和Ki-67表达的价值
2023-11-23陈军李庆荣刘宁杨光华蓓王勇全冠民
陈军, 李庆荣, 刘宁, 杨光, 华蓓, 王勇, 全冠民
乳腺癌已超过肺癌成为世界上最常见的恶性肿瘤,2020年全球新增病例230万例,死亡68.5万例[1]。随着个性化精准医疗的发展,肿瘤生物标志物检测在临床诊疗方面发挥着越来越重要的作用,其中人类表皮生长因子受体2(human epidermal growth factor receptor-2,HER-2)和肿瘤细胞增殖指数Ki-67与乳腺癌的生长、发展息息相关,其表达水平越高,肿瘤侵袭性越强,转移风险越高,预后越差[2,3]。目前Ki-67、HER-2等表达水平的检测主要通过对活检或术后病理标本进行免疫组织化学染色显示。乳腺癌是一种高度异质性肿瘤,活检或手术取样属于侵入性操作,难以全面地反应肿瘤内部的异质性,可能存在抽样误差,影响结果的准确性,因此临床亟须一种早期、有效、简便的检测细胞因子表达水平的方法[4]。乳腺X线摄影现已成为乳腺癌筛查的重要手段,且近年来,已有相关研究表明乳腺癌的X线、超声及MR影像特征等与HER-2及Ki-67的表达水平有关[3,4]。对比增强能谱乳腺摄影(contrast enhancement spectral mammography,CESM)是近年来国际上新出现的一种检查技术,它将常规乳腺 X 线摄影与对比增强技术相结合,实现病变形态与血供信息的完美融合[5]。目前关于乳腺癌CESM影像特征与Ki-67、HER-2相关性研究较少。本研究通过分析乳腺癌的CESM影像及病理指标与Ki-67、HER-2的相关性,分别构建Ki-67和HER-2预测模型,早期、有效、简便地预测Ki-67、HER-2表达水平,帮助患者制定个性化的治疗方案。
材料与方法
1.研究对象
回顾性分析2019年10月-2021年10月行CESM检查的乳腺癌患者,检查前均签署了知情同意书。纳入标准:①CESM检查发现乳腺肿块型病变;②CESM检查后1周内完成乳腺肿物切除术,术后病理证实为乳腺导管原位癌或浸润性导管癌;③术前未进行任何临床治疗。排除标准:①碘对比剂过敏或严重肾功能不全;②图像质量不佳或伪影较重无法进行分析。
2.CESM扫描方法
采用GE Senographe Essential全数字乳腺摄影机。对比剂采用碘帕醇(370 mg I/mL,上海博莱科信谊药业),剂量为1.22 mL/kg。经高压注射器以3 mL/s的流率高压注入上臂静脉,开始注射对比剂2 min后,先拍摄健侧乳腺头尾位(cranio caudal,CC)、患侧乳腺 CC 位,后依次为健侧内外斜位(medial lateral oblique,MLO)、患侧 MLO 位,7 min内4个体位拍摄完成。拍摄条件采用自动曝光模式,每个体位均采集低能和高能图像各1帧,经乳腺后处理专用工作站接收到的低能图像及经后处理得到“减影”图像。
3.图像分析
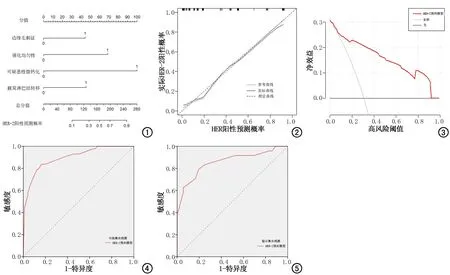
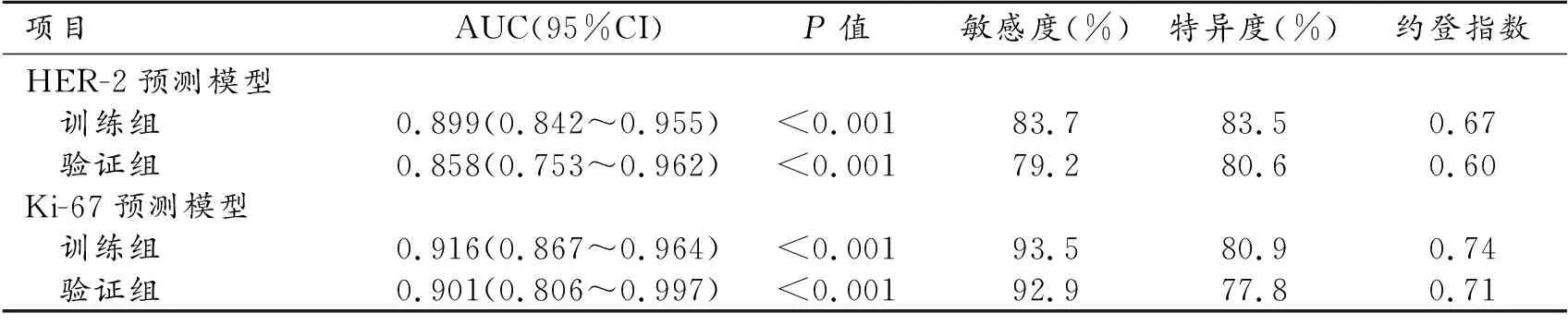
采用上海岱嘉PACS-UniWeb软件后处理图像。由两名具有5年乳腺影像诊断经验的主治医师在不知晓患者病例资料的情况下根据乳腺影像报告与数据系统(breast imaging reporting and data system,BI-RADS)标准[6]进行阅片,二者意见不同时经协商达成一致。对于乳腺多发肿块,选择直径最大者进行分析。纳入分析的定性参数:腺体密度(非致密型/致密型)、背景实质强化分型(轻微/轻度/中度/显著)、肿块位置(包括侧别、象限)、数目(单发/多发)、密度(低密度/等密度/高密度)、形态(规则/不规则)、强化均匀性(均匀/不均匀)、有无边缘毛刺征、有无可疑恶性微钙化(沙粒状、细多形性、细线性或细分支性簇状微钙化,视为可疑恶性微钙化)。纳入分析的定量参数:发病年龄、最大径(CC位或MLO位减影图测量最大径)、相对强化灰度比值(the percentage rate of signal of enhancing lesion and background of CC or MLO,RS%CC、RS%MLO)[7]、相对强化灰度差值(relative signal difference,RSD)[8](RS%CC/MLO=(S'c-S'b)/S'b×100%;RSD=(RS%MLO-RS%CC)/%RSCC×100%:CC位或MLO位减影图上病变强化明显且均匀区域手动勾画ROI1(避开出血、坏死区域,约0.5~2 cm2),记录CC位(早期)或MLO位(晚期)强化灰度值,记为S'c(signal in enhancing lesion of CC or MLO);并在同一图像中乳腺脂肪强化均匀区域勾画 ROI2(约1 cm2),记录CC位或MLO位背景灰度值,记为S'b(signal in the background of CC or MLO),每个部位均测量3次并取平均值。参考动态增强MRI(dynamic contrast enhance-MRI,DCE-MRI),将病灶强化曲线分为三种类型:上升型(RSD≥10%)、稳定型(-10% 4.术后病理 记录乳腺癌组织学类型及分级、脉管侵犯情况、腋窝淋巴结转移情况。组织学分级采用改良的Scarff-Bloom-Richardson分级系统,根据癌组织中小管或腺体形成、细胞核多形性和核分裂象技术进行分级。每项指标都分别评分1~3分,将这3项指标得分相加:3~5分为Ⅰ级;6~7分为Ⅱ级;8~9分为Ⅲ级,其中导管原位癌视为0级。观察雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)及Ki-67表达。以阳性细胞≥10%为ER/PR表达阳性,<10%为ER/PR表达阴性;以阳性细胞≥14%为Ki-67阳性,<14%为Ki-67阴性;HER-2表达分为0、+、及,将0和+判定为表达阴性、为表达阳性,对HER-2()情况进一步行荧光原位杂交检测,若HER-2基因扩增则判定为表达阳性,反之为阴性。 5.统计学分析 1.基本资料 本研究最终纳入200例患者,均为女性,年龄30~74岁,平均(50.44±9.71)岁。按照7:3比例分为训练集(n=140)和验证集(n=60)。CESM检查与手术间隔时间平均(3.14±1.12)天。所有病例经手术病理证实,包括导管原位癌22例(低核级8例、中核级10例、高核级4级,伴微浸润4例),浸润性导管癌178例(1级29例、2级124例、3级25例)。训练集与验证集间患者年龄、CESM影像征象、乳腺病理指标间差异均无统计学意义(P>0.05)。 2.CESM影像与病理指标与HER-2、Ki-67的相关性 乳腺肿块形态不规则、边缘毛刺征、强化均匀性、可疑恶性微钙化、RS%CC、RS%MLO、腋窝淋巴结转移、PR在HER-2阴性组和阳性组间差异均有统计学意义(P<0.05)。肿块最大径、边缘毛刺征、强化均匀性、RS%CC、RS%MLO、组织学类型、组织学分级、脉管浸润、腋窝淋巴结转移、ER、RP在Ki-67阳性组和阴性组间差异均有统计学意义(P<0.05),见表1、2。 表1 训练集乳腺癌CESM影像特征与HER-2、Ki-67的相关性 表2 训练集乳腺癌病理指标与与HER-2、Ki-67的相关性 3.HER-2和Ki-67预测模型的构建及效能评估 为有利于结果解读及简化HER-2及Ki-67预测模型,根据ROC曲线Cut-off值将连续变量转换为二分类变量(最大径、RS%CC、RS%MLOCut-off值:1.71 cm,3.19%,4.00%;2.71 cm,3.31%,3.02%)。HER-2预测模型构建:以HER-2阳性作为因变量,将上述有统计学意义的11项指标作为自变量(X)建立Logistic回归模型,结果显示:边缘毛刺征(X1)、强化均匀性(X2)、可疑恶性微钙化(X3)、腋窝淋巴结转移(X4)为预测HER-2阳性的独立预测因子(表3)。HER-2预测模型: Logit(P1)=-4.468+1.185×X1+1.830×X2+ 2.670×X3+ 1.213×X4 (1) 其中边缘毛刺征阳性、强化不均匀、可疑恶性微钙化、腋窝淋巴结转移别记为1分,否则记为0分。Hosmer-Lemeshow检验显示,P=0.458模拟拟合良好。在训练集中,该模型预测HER-2阳性的ROC曲线下面积(area under curve,AUC)为0.899,敏感度为83.7%,特异度为83.5%;将验证集代入模型中,得出该模型的AUC值为0.858,敏感度为79.2%,特异度为80.6%(表4,图1~5)。 图1 乳腺癌HER-2预测模型的列线图。包括边缘毛刺征、强化均匀性、可疑恶性微钙化、腋窝淋巴结转移4个独立预测因子。 图2 训练集HER-2预测模型校正曲线。校准预测曲线与标准曲线贴合良好,提示预测模型对HER-2阳性的预测概率与实际概率具有较好的一致性。 图3 训练集HER-2预测模型决策曲线。该预测模型在多数概率阈值中,具有良好的临床应用价值。 图4 训练集预测模型预测HER-2阳性的ROC曲线。 图5 验证集预测模型预测HER-2阳性的ROC曲线。 表4 训练集和验证集HER-2和Ki-67预测模型的预测效能 Ki-67预测模型构建:以Ki-67阳性作为因变量,将上述有统计学意义的 11项指标作为自变量(Y)建立Logistic回归模型,结果显示:最大径(Y1)、边缘毛刺征(Y2)、强化均匀性(Y3)、RS%CC(Y4)、组织学分级(Y5)为预测Ki-67阳性的独立预测因子(表3)。Ki-67预测模型: Logit(P2)=-9.178+3.121×Y1+1.027×Y2+1.090×Y3+1.493×Y4+1.924×Y5 (2) 其中肿块最大径>2.71 cm、边缘毛刺征阳性、强化不均匀、RS%CC>3.31%分别记为1分,否则记为0分;组织学分级中导管原位癌记为0分,浸润性导管癌Ⅰ级记为1分,Ⅱ级为2分,Ⅲ级为3分。Hosmer-Lemeshow检验显示,P=0.251模拟拟合良好。在训练集中,该模型预测Ki-67阳性的AUC值为0.916,敏感度为93.5%,特异度为80.9%;将验证集代入模型中,得出该模型的AUC值为0.901,敏感度为92.9%,特异度为77.8%(表4,图6~10)。 图6 乳腺癌Ki-67预测模型的列线图。包括最大径、边缘毛刺征、强化均匀性、RS%CC、组织学分级5个独立预测因子。 图7 训练集Ki-67预测模型校正曲线。校准预测曲线与标准曲线贴合良好,提示预测模型对Ki-67阳性的预测概率与实际概率具有较好的一致性。 图8 训练集Ki-67预测模型决策曲线。该预测模型在多数概率阈值中,具有良好的临床应用价值。 图9 训练集预测模型预测Ki-67阳性的ROC曲线。 图10 验证集预测模型预测Ki-67阳性的ROC曲线。 4.预测模型相关定量及定性参数一致性分析 两位影像诊断医师测量肿块最大径及强化灰度比值RS%cc均具有良好的一致性(ICC=0.893、0.912);两者判定边缘毛刺征、强化均匀性、可疑恶性微钙化均具有较好的一致性(Kappa=0.817、0.805、0.845)。 乳腺癌作为一种具有高度异质性的疾病,随着分子生物学的发展,从细胞、分子、基因学角度研究乳腺癌已是目前临床治疗的热点。美国临床肿瘤学会推荐将HER-2、Ki-67等作为乳腺癌重要的免疫组织化学指标,目前已广泛应用于乳腺癌的靶向及内分泌治疗中[9]。HER-2是表皮生长因子受体家族的一员,属原癌基因,能够调控乳腺癌新生血管上皮细胞增殖、生长、分化;Ki-67是一种表达于增殖细胞的核抗原,能够调控癌细胞有丝分裂及增殖活性,因此HER-2和Ki-67表达水平与肿瘤进展、转移及预后有关[2,10]。理论上,肿瘤基因及细胞因子介导的病理改变可改变乳腺癌的组织病理学及生物学特征,间接影响其影像学表现[10,11]。本研究通过分析CESM影像特征及病理指标与HER-2、Ki-67的相关性,构建预测模型,结果显示HER-2和Ki-67预测模型具有较好的预测能力,其AUC值分别为0.858~0.899、0.901~0.916。 近年来,一些研究已证实乳腺癌的影像及病理指标与HER-2、Ki-67表达关系密切。本研究也发现边缘毛刺征、强化均匀性、可疑恶性微钙化、腋窝淋巴结转移与HER-2阳性独立相关;最大径、边缘毛刺征、强化均匀性、RS%CC、组织学分级与Ki-67阳性独立相关。肿瘤大小是乳腺癌重要的预后因素,任波等[12]发现肿块直径>2.0 cm的浸润性乳腺癌患者的HER-2和Ki-67阳性率明显高于肿瘤直径≤2 cm者;而李翠平等[13]认为浸润性乳腺癌HER-2和Ki-67表达与肿瘤直径无关(P>0.05)。本研究发现HER-2与肿块最大径无关(P=0.104),而Ki-67与最大径独立相关(P=0.024),最佳截断值为2.71 cm,考虑可能与Ki-67表达水平能够调控癌细胞有丝分裂及增殖活性有关。目前研究普遍认为边缘毛刺征是乳腺癌一个较特异性恶性征象,反映了肿瘤的生长模式及生物学行为。陈倩等[14]发现边缘毛刺征在HER-2和Ki-67阳性组的比例高于阴性组,但差异无统计学意义(P>0.05),考虑与该研究样本量(n=70)较小和非肿块型乳腺癌(n=23)的边缘特征不典型有关。苗环等[15]和闫峰山等[16]纳入肿块型乳腺癌患者,发现边缘毛刺征与HER-2、Ki-67阳性密切相关(P均<0.05),与本研究结果相一致,考虑可能由于HER-2、Ki-67高水平表达刺激细胞增殖、浸润和迁移,癌细胞迅速沿间质浸润生长,在影像上表现为毛刺征。研究发现HER-2基因与SPCA2-Orai1钙通道相关,随着HER-2高表达,Orai1通道的开放,使得Ca2+被储存在细胞内[17]。本研究发现肿块型乳腺癌伴可疑恶性微钙化与HER-2阳性密切相关,与何莹等[11]等研究相一致。李冬芹等[18]进一步分析微钙化形态,发现细线或细分支状、线段状微钙化的HER-2高表达,而簇状、不定形、不均质微钙化的HER-2阴性表达。本研究中可疑恶性微钙化样本量(n=50)较小,未能进行恶性微钙化形态分类的亚组分析。李敏红等[19]和闫峰山等[16]发现肿瘤内部强化不均匀与HER-2阳性及Ki-67阳性密切相关(P均<0.05),与本研究基本一致。HER-2和Ki-67表达直接或间接诱导生成血管内皮生长因子(vascular endothelial growth factor,VEGF),VEGF促进大量新生微血管生成,同时促进细胞分裂和蛋白水解酶的分泌,导致肿瘤内部发生缺血缺氧、液化坏死,进而导致肿瘤强化不均匀[14]。本研究发现RS%CC是预测Ki-67阳性的独立预测因子,提示Ki-67表达水平越高,肿瘤新生毛细血管密度高,微血管灌注更明显,早期强化程度(RS%CC)更显著。雷昊等[20]发现达峰时间(time to peak,TTP)与Ki-67表达呈负相关,进一步佐证了早期强化率与Ki-67表达密切相关。 HER-2高表达能够促进肿瘤增殖及分化,增强细胞运动能力,更易扩散及转移,因此HER-2高表达与乳腺癌淋巴结转移呈正相关[21],与本研究结果相一致。另外本研究发现Ki-67表达水平与组织学类型及分级有关,乳腺浸润性导管癌Ki-67阳性表达率明显高于导管原位癌,乳腺浸润性导管癌Ⅱ级和Ⅲ级的Ki-67阳性表达率高于Ⅰ级,与Shin等[22]研究结果一致。 当前通过影像学检查预测乳腺癌HER-2和Ki-67表达水平已是国内外研究的热点。部分学者通过分析乳腺癌X线、超声及MRI特征,构建Nomogram模型或深度学习模型,旨在预测HER-2及Ki-67的表达水平,为临床个性化治疗提供决策支持[23,24]。乳腺X线摄影是乳腺疾病检查的重要影像学方法之一,帅鸽等[3]基于乳腺X线摄影影像组学特征构建预测模型,预测HER-2阳性的AUC值为0.889~0.927;Tagliafico等[25]基于数字乳腺断层摄影影像组学特征构建模型,预测Ki-67阳性的AUC值为0.698。随着CESM技术的成熟及广泛应用,部分学者尝试通过CESM影像特征预测乳腺癌的分期、淋巴结转移及肿瘤生物标志物水平等[26,27]。Dominique等[27]基于CESM影像组学特征,构建CheXNet深度学习模型,预测HER-2阳性的AUC值为0.608,预测Ki-67阳性的AUC值为0.600,该研究仅纳入CESM明显强化的乳腺癌,并不包括无强化及弱强化的患者。而La Forgia等[28]纳入所有无强化、弱强化及明显强化的乳腺癌患者,提取CESM影像组学特征,构建多元线性判别模型,发现其预测HER-2阳性的AUC为0.908,预测Ki-67阳性的AUC为0.848。鉴于影像组学特征提取操作复杂,数据繁杂,解读困难,耗时长等原因,本研究通过简便、直观的人工判读CESM影像和病理特征,通过Logistic回归分析,构建Nomogram预测模型,结果显示HER-2及Ki-67预测模型均具有较好的预测能力,其中HER-2预测模型的AUC值为0.858~0.899,与帅鸽等[3]和La Forgia等[28]模型预测效能相似;Ki-67预测模型的AUC为0.901~0.916,其预测效能优于La Forgia等[28]研究。 本研究的主要局限性:①本研究样本量较少且为回顾性研究,期待未来扩大样本量、开展前瞻性研究。②本研究所选取的病例只包括乳腺导管原位癌及浸润性导管癌,并不涉及其他特殊类型乳腺癌(乳头状癌、粘液癌、髓样癌等),因此该模型仅适用于预测非特殊类型乳腺癌的HER-2和Ki-67表达水平。③本研究HER-2和Ki-67预测模型的构建是基于肿块型乳腺癌的CESM影像特征及病理指标,因此该模型并不适用于乳腺非肿块型病变(如结构扭曲、不对称致密等),后期仍需要进一步探索乳腺非肿块型病变的HER-2和Ki-67预测模型。 综上所述,乳腺癌的HER-2和Ki-67表达水平与部分CESM影像学特征及病理指标关系密切,HER-2和Ki-67预测模型可作为一种有效和简便的方法用于预测乳腺癌患者HER-2和Ki-67的表达情况,对于临床医生决策及患者预后有一定帮助。结 果



讨 论
