趋化因子CCL11-糖胺聚糖-趋化因子受体CCR3的相互作用研究*
2023-11-23李冠霖刘恒姮丁彦之李计强葛保胜
李冠霖 刘恒姮 丁彦之 李计强 葛保胜
(中国石油大学(华东)化学工程学院生物工程与技术中心,重质油国家重点实验室,青岛 266580)
趋化因子是一种能够诱使免疫细胞产生趋化作用的细胞因子总称,其通过与相对应趋化因子受体及内皮细胞表面的糖胺聚糖(glycosaminoglycans,GAGs)相互作用行使生物学功能,在细胞发育、肿瘤发生、血管生成、炎症反应、伤口修复和神经再生等[1]重要细胞生理过程中发挥着重要作用。许多疾病的发生都与趋化因子及其受体的表达或调控异常相关[2],因此,趋化因子及其受体多年来一直是疾病治疗和药物设计的重要作用靶点。
据报道,大多数趋化因子及其受体均有形成二聚体或寡聚体的倾向[3]。然而,文献同时证实,趋化因子单体是对其受体具有最高亲和力和促进细胞迁移的形式[4]。那么趋化因子寡聚的目的是什么?为了探究趋化因子寡聚的生理学意义,Proudfoot 等[4]设 计 了 趋 化 因 子 单 体 突 变 体(RANTES (CCL5)、MCP-1 (CCL2) 和MIP-1b(CCL4)),并研究发现细胞迁移需要趋化因子寡聚。同样,GAGs结合缺陷突变体研究表明,趋化因子在体内行使功能也需要与GAGs结合[5],这提示趋化因子可以在GAGs 链上聚集并发挥作用[6]。在细胞迁移过程中,趋化因子通过在GAGs 上聚集,使其形成浓度梯度,提供牵引趋化细胞所需的亲和力,特别是存在血流剪切力的情况下[7-8]。然而,Joseph 等[9]提出,只有游离趋化因子以及延伸的趋化梯度,才能驱动中性粒细胞从循环到组织的运输,GAGs 结合趋化因子不能激活受体。并且,CC 型趋化因子二聚体中,对受体激活至关重要的残基被埋入二聚体内部,且二聚体结构与受体结合空间不相容,因此,CC 型趋化因子二聚体不能激活受体,诱导细胞迁移[10]。目前为止,对于趋化因子-糖胺聚糖GAG-G 蛋白偶联受体(G protein-coupled receptors,GPCR)受体三者之间的作用关系,以及趋化因子或其受体聚集在其中发挥的作用如何都还不清楚。探究阐明趋化因子、趋化因子受体及GAGs三者之间相互作用过程及机制对于深入理解趋化因子受体的激活及其发挥功能的作用机制具有重要意义。
趋化因子CCL11是Eotaxins家族的成员,最早发现于致敏豚鼠抗原刺激后的支气管肺泡灌溉液(bronchoalveolar lavage fluid,BALF)中,CCL11与其受体CCR3 的结合[11]会触发一系列信号转导事件,包括细胞骨架重排、蛋白激酶C的激活以及受体的长期内化等[12]。CCL11 及CCR3 被认为是抗哮喘药物的可能靶点,在变应性和非变应性的炎症反应中起着关键作用[13-14],此外,CCL11 还参与局部缺血诱导的血管壁重塑,在许多疾病中起着潜在的作用。细胞表面最普遍的GAGs是硫酸乙酰肝 素(heparan sulfate, HS) 与 硫 酸 软 骨 素(chondroitin sulfate,CS)。CS 以蛋白聚糖侧链的形式广泛存在于各种细胞间基质及细胞表面中[15],在多种生化反应中起到极为重要的作用。例如,参与神经系统的生长、胞质分离、病毒黏附、形态形成、生长因子信号转导等[16]。Culley等[17]研究发现,GAGs(如肝素)会抑制嗜酸性粒细胞对CCL11的趋化反应以及抑制细胞内的钙通量,同时抑制CCL11与CCR3的结合。趋化因子也可以与可溶性GAG 或细胞表面受体形成复合物,该可溶性GAG-趋化因子复合物无法再与趋化因子受体结合,导致生物活性被阻断[18]。Culley等[17]研究证明硫酸乙酰肝素可在体外抑制趋化因子诱导的嗜酸性粒细胞活化。
本文以CCL11-GAGs-CCR3为研究体系,构建了单分子表达水平的CCR3-EGFP 稳转细胞系,选择3 种GAGs(硫酸软骨素1~3,链长依次增加),利用全内反射荧光成像(total internal reflection fluorescence,TIRF)、等温滴定量热(isothermal titration calorimetry,ITC)和细胞趋化等技术探究GAGs与CCL11的相互作用,以及GAGs-CCL11对CCR3-EGFP 稳转细胞趋化行为的调控及CCR3-EGFP 在细胞膜上聚集状态的影响,以期为阐明CCL11-GAGs-CCR3三者之间的作用关系及相关药物的设计和疾病治疗提供理论依据。
1 材料与方法
1.1 材料
中国仓鼠卵巢细胞(Chinese hamster ovary cell,CHO) 购自中国科学院细胞库。CCL11-MKO 融合蛋白表达载体pET-28a-ccl11-MKO和CCR3-EGFP 表达 载体pcDNA3.1-ccr3-egfp质 粒均由本实验室构建并保存;鼠抗anti-His单克隆抗体,HRP-labeled Goat Anti-Mouse lgG 购自上海生工公司;硫酸软骨素1(0.5 ku)购自Aladdin 公司;硫酸软骨素2(5~20 ku)购自Solarbio 公司;硫酸软骨素3(50~100 ku)购自BBI 公司;兔抗CCR3 单克隆抗体购自Abcam公司;Amersham ECL显色试剂盒购自GE healthcare (GE) 公司;Transwell Chambers趋化小室购自Corning公司;多聚甲醛购自源叶生物公司。
1.2 方法
1.2.1 利用ITC探究GAGs与CCL11的相互作用
使用Malvern公司Microcal ITC200仪器进行等温滴定量热实验。GAGs放置于滴定针内,空白溶液和CCL11样品溶液放置于样品池内。先用GAGs溶液滴定缓冲液作为空白对照,再使用不同分子质量的硫酸软骨素溶液滴定CCL11。其中样品池中样品为350 μl,进样器中样品为100 μl。ITC 实验过程中,参比池、样品池及上样针每次实验使用前必须多次清洗干净保证无其他杂质,加样时保证无气泡,且所有样品均用0.45 μm滤膜过滤,参比池中加入超纯水。不同样品浓度及配比的滴定实验参数的设定如表1所示:

Table 1 Parameter settings in ITC experiment
1.2.2 单分子成像技术考察GAGs对CCL11-MKO聚集状态的影响
将不同分子质量大小的GAGs 与CCL11-MKO(C-C motif chemokine 11-monomeric Kusabira Orange,CCL11-MKO)(文档S1)分别按照1∶1、10∶1、100∶1的比例进行混合孵育,并稀释至蛋白质浓度为10-10mol/L,静置20 min后,采用单分子pull-down 技术将样品固定在组装的洁净样品池中,使用532 nm 激光对样品进行激发,通过激发滤光片R532 nm 和发射滤光片582/75 nm 采集相应波长范围的信号。采用荧光猝灭阶数分析技术[19],考察不同GAG处理后CCL11-MKO的聚集变化。
1.2.3 细胞趋化实验
将实验室前期构建好的CCR3-EGFP 稳转细胞复苏后悬浮于含有0.5% 胎牛血清(FBS) 的DMEM 培养基中,分别取100 μl(1×106/ml)接种于Transwell Chambers 上层小室,对应下层小室分别添加500 μl含0.5% FBS的DMEM培养基及终浓度为50 nmol/L 的CCL11 与CCL11-MKO,于37℃、5% CO2细胞培养箱中继续孵育5 h。趋化结束后用多聚甲醛室温固定15 min,上室膜晾干后加入终浓度为0.1%结晶紫,室温染色20 min,蒸馏水漂洗3次,用棉签将上室顶层细胞擦掉,在显微镜下进行细胞计数,每组设3次平行试验。
1.2.4 CCL11-GAG作用下CCR3-EGFP的活细胞单分子成像
将所构建的稳定表达CCR3-EGFP 的稳转细胞株均匀接种至细胞培养皿(2 cm)中,待细胞汇合度达到80%左右时,吸出培养基,加入摩尔比为1∶1、10∶1、100∶1 的硫酸软骨素3 与CCL11 混合溶液(CCL11 终浓度均为1 000 nmol/L),4℃孵育15 min,吸出培养基并用0.22 μm 无菌滤膜过滤处理的1×PBS 轻轻漂洗3 遍,加入150 μl DMEM无酚红培养基,利用TIRF 技术进行单分子成像,将成像结果用ImageJ处理,并用Matlab进行分析。对每一帧荧光点的荧光强度进行统计,取所选点前3 帧的平均荧光强度,得到强度分布图用Origin 进行高斯拟合[20-21],考察不同CCL11-GAG复合体对CCR3-EGFP在活细胞膜上聚集作用的影响。
2 结 果
2.1 利用ITC研究GAGs与CCL11相互作用
研究表明,趋化因子-GAGs 的相互作用对于CCL11 介导的信号转导具有重要影响,缺乏寡聚能力或与GAGs结合能力的趋化因子突变体在体内无法行使正常功能[22],故趋化因子寡聚及趋化因子与GAGs 相互作用可能是偶联的。本文利用ITC技术研究了CCL11与GAGs的相互作用。不同长度的硫酸软骨素可与CCL11结合,硫酸软骨素1号由于分子质量较小,分子链较短,其与CCL11 可以看出有明显相互作用,但由于滴定放热过少,数据无法有效拟合(图1)。通过Origin软件对其他两种GAGs与CCL11溶液的滴定数据拟合后得到各项热力学常数(表2)。分析实验结果可知,随着硫酸软骨素链长的增加,结合放热增加,表明其相互作用增强,硫酸软骨素与CCL11 的结合常数(Ka)由2.15×106±4.66×105增大至3.72×107±7.48×106。经计算,硫酸软骨素2 与CCL11 的结合比为1∶1,即平均约1 个硫酸软骨素结合1 个CCL11,硫酸软骨素3 则逐渐转变为1 个硫酸软骨素结合约16 个CCL11。
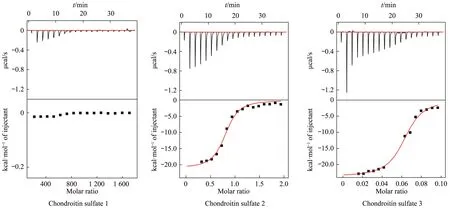
Fig.1 Interaction analysis of chondroitin sulfate with CCL11 using ITC technique

Table 2 The fitting data of interactions between Chondroitin sulfate and CCL11
2.2 不同GAGs对CCL11-MKO体外聚集状态的影响
为了进一步探究不同GAGs对CCL11体外聚集状态的影响,利用单分子荧光TIRF 成像技术(图2a,b),研究了不同GAGs 对CCL11-MKO 聚集状态的影响。图2c 为pH=7、20 mmol/L NaCl 条件下的荧光强度拟合结果,从图中可以得出pH=7 时,溶液中CCL11-MKO 单体比例约为73%(P<0.01),寡聚体约为27%(P<0.05),说明在pH=7 情况下CCL11-MKO主要以单体形式存在,也存在部分二聚体形式。同时采用荧光阶数漂白分析技术进一步验证该方法的可靠性(图2d),荧光强度125 时约为一阶漂白,即表示CCL11单体,荧光强度160时约为二阶漂白,表示此时CCL11 为二聚体。同样可以证实,大部分的CCL11-MKO荧光颗粒以单体形式存在且荧光强度在110~140之间,单体比例约占73%。
将GAGs 与CCL11-MKO 混合孵育后进行单分子成像,并根据其荧光强度拟合及荧光漂白阶数分析对其聚集状态进行统计(图2e)。随着硫酸软骨素1 比例的增加,其显示出对CCL11-MKO 的聚集有少量的促进作用。而硫酸软骨素2在物质的量比例为1∶1 和10∶1 时,随着比例的增加,其对CCL11-MKO 的聚集有着显著促进作用。CCL11-MKO 的寡聚体量在GAGs 与CCL11-MKO 摩尔比为10∶1时达到了48%。但令人意外的是,硫酸软骨素2 在GAGs 与CCL11-MKO 比例达到100∶1时,CCL11-MKO聚集状态反而有所降低,说明随着硫酸软骨素2号比例的增加,过多的硫酸软骨素竞争结合CCL11-MKO,反而不利于CCL11-MKO聚集体的形成。同样,硫酸软骨素3 号在1∶1 时,CCL11-MKO 聚集体就达到了最大值,随着GAGs与CCL11-MKO 比例增加,CCL11-MKO 聚集体反而降低。这表明,随着GAGs 链的加长,GAGs 与CCL11的相互作用增强,倾向于形成GAGs-CCL11复合物,同时对CCL11 聚集体的形成有一定促进作用,所以推测,在体内血液流动的条件下,长链GAGs对CCL11在内皮细胞表面特定部位的停留贡献更高。
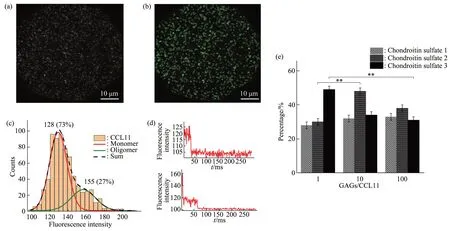
Fig.2 Total internal reflection fluorescence imaging and aggregation analysis of CCL11-MKO
2.3 GAGs-CCL11聚集体对CCR3-EGFP稳转细胞趋化作用的影响
CCL11 对CCR3 表达细胞具有典型的趋化作用,为探究GAGs-CCL11形成的复合体与CCR3的相互作用,本实验室构建了CCR3-EGFP 稳转细胞细胞系,并以此为基础考察了CCL11-GAGs 聚集体对CCR3-EGFP 稳转细胞趋化作用的影响(图3)。硫酸软骨素3的加入会对CCL11诱导的趋化作用产生抑制。不同比例的硫酸软骨素3与CCL11对CCR3-EGFP 稳转细胞趋化实验结果发现,硫酸软骨素3 加入比例为1∶1 时,CCL11 对CCR3-EGFP稳转细胞的趋化能力显著降低,再增加GAGs-CCL11 比例,CCL11 的趋化能力再没有出现显著变化,提示该比例下,已基本实现了对CCR3-EGFP稳转细胞趋化的最大抑制能力。针对不同分子质量大小的GAGs实验发现,在加入比例为1∶1条件下,随着硫酸软骨素链长的增加,趋化抑制现象逐渐增强,由硫酸软骨素1 的10%左右的抑制率,增强到硫酸软骨素3的60%左右。结合上述单分子实验分析结果分析,这提示硫酸软骨素的添加促进了CCL11 的聚集,导致趋化因子对受体激活至关重要的残基不再暴露,从而抑制了CCL11 对CCR3-EGFP稳转细胞的趋化作用。

Fig.3 Chemotaxis analysis of CCL11 on CCR3-EGFP stable transfected cells
2.4 GAGs-CCL11对活细胞膜上CCR3-EGFP聚集状态的影响
为探究GAGs-CCL11 复合物对活细胞膜上趋化因子受体CCR3聚集状态的影响,首先分析所构建的CCR3-EGFP 是否适合单分子成像。将所构建的CCR3-EGFP 稳转细胞株接种至底部透明培养皿中,进行TIRF 单分子成像(图4a)。CCR3-EGFP稳转细胞轮廓清晰,CCR3-EGFP 荧光斑点均匀分散在细胞膜表面。利用ImageJ 软件提取每个点的荧光强度,并取前3帧图片中每个荧光点强度的平均值,利用Origin软件做出荧光强度分布图并进行高斯拟合。通过高斯拟合峰的数量和峰值之间的关系可以推断CCR3-EGFP 荧光颗粒的聚集状态(图4b),同时结合荧光强度与阶数漂白对应关系(图4c)进行统计分析。经统计337 个CCR3-EGFP 颗粒分析可知,大部分CCR3-EGFP 荧光颗粒以单体形式存在且荧光强度在25~55之间,单体约占83%(P<0.01)。这表明所构建筛选的CCR3-EGFP 稳转细胞株适合于进一步的细胞膜上单分子成像分析。

Fig.4 Aggregation state statistics of CCR3-EGFP on CHO cell membrane
为探究CCL11-GAGs 对CCR3-EGFP 聚集状态的影响,将GAGs 与CCL11 共同孵育后作用于CCR3-EGFP稳转细胞株,通过TIRF进行单分子成像,对细胞膜上CCR3-EGFP 聚集状态进行统计。CCL11 与硫酸软骨素3 共同作用时CCR3-EGFP 在细胞膜上聚集状态统计结果(图5a,b)为:单独加入CCL11 时,CCR3-EGFP 在细胞膜上的聚集状态约在33%左右。随着硫酸软骨素3 的加入,CCR3-EGFP 的寡聚体降低,在硫酸软骨素3 号与CCL11 为1∶1 时,CCR3-EGFP 在细胞膜上的聚集体由33%降为18%,后续增加硫酸软骨素3 比例,对CCR3-EGFP在细胞膜上的聚集状态影响不显著。还考察了不同分子质量大小GAGs与CCL11共同作用下(比例设为1∶1)CCR3-EGFP 聚集状态进行统计,图5c 为结晶紫染色后趋化细胞成像,实验结果表明:随着硫酸软骨素链长的增加,其对CCL11 引起的CCR3-EGFP 在细胞膜上聚集现象的抑制作用增强。综合以上分析,硫酸软骨素的加入,会在一定程度上促进CCL11 的聚集,但该聚集受到GAGs长度等因素的影响。CCL11-GAGs复合体会抑制CCL11 诱导的细胞膜上CCR3-EGFP 的聚集,并对CCL11 诱导的细胞趋化作用产生负面影响。
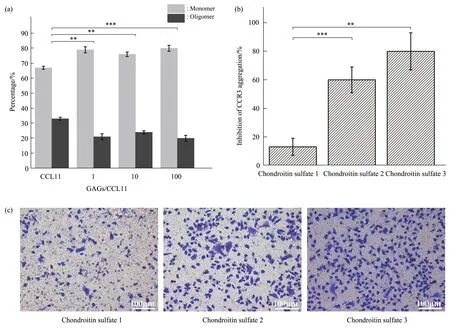
Fig.5 Statistics of CCR3-EGFP aggregation status upon binding of GAGs-CCL11
3 讨 论
趋化因子是能使免疫细胞发生趋化作用的细胞因子的总称,其参与调节细胞在一系列发育、稳态和炎症过程中的迁移,并在介导白细胞黏附和细胞迁移中发挥关键作用[23-24]。趋化因子通常与免疫细胞表面的趋化因子受体及内皮细胞表面的GAGs相互作用,从而牵引免疫细胞到达相应的病灶部位并发挥作用。研究表明,趋化因子与GAGs的相互作用是其在体内实现功能必不可少的,二者之间的相互作用非常重要[25-26]。趋化因子CCL11 是参与嗜酸性粒细胞募集和介导哮喘相关组织损伤的主要趋化因子,其与受体CCR3相互作用能够介导嗜酸性粒细胞在寄生虫感染和过敏反应部位的迁移和积累,CCR3参与炎症反应的发生、发展过程,已经被作为治疗炎症反应相关疾病的重要治疗靶点[27-28]。因此深入探究CCL11 与GAGs 及其受体CCR3的相互作用,有助于全面理解CCL11-GAGs-CCR3介导的相关疾病发病机理及其治疗途径。
本文首先利用ITC 及TIRF 技术探究了GAGs与CCL11 之间的相互作用,结果发现不同长度的GAGs均可以与CCL11体外结合。随着硫酸软骨素链长的增加,结合放热增加,相互作用增强,由1个硫酸软骨素结合1 个CCL11,逐渐转变为1 个硫酸软骨素结合多个CCL11。同时单分子荧光成像实验表明,随着硫酸软骨素链长的增加,其在一定程度上对CCL11-MKO聚集作用增强,但是聚集程度并不会随着GAGs链长的增加线性提升,而是存在饱和效应,这与Ellyard 等[29]报道结果一致:GAGs可以但并不一定显著促进CCL11聚集体的生成。因此,CCL11 在血流剪切力的情况下形成浓度梯度从而诱导并牵引CCR3细胞的关键因素,可能不是CCL11 聚集体的形成,可能是CCL11 单体与GAGs 相互作用的结果,且长链的GAGs 与CCL11 的相互作用更强,从而对CCL11 在特定位点的停留有更强的稳定效应。
趋化因子受体与趋化因子结合并被激活的过程可以调节多种生理作用,包括白细胞运输、增殖、分化和肿瘤转移等。趋化因子受体CCR3属于A类GPCRs,在过敏反应和其他免疫介导的炎症疾病中起关键作用。CCR3参与哮喘、关节炎以及特异性皮肤炎等过敏性炎症的发展过程,同时也是HIV-1病毒感染人体免疫细胞的辅助受体[30]以及老年性黄斑病变的有效药物靶点[31]。CCL11 与其受体CCR3相互作用能够介导嗜酸性粒细胞在寄生虫感染和过敏反应部位的迁移和积累,被认为是抗哮喘药物的可能靶点。本文通过考察CCL11-GAGs 共同作用下对CCR3-EGFP 稳转细胞趋化效应的影响发现,GAGs 的加入会抑制CCL11 对CCR3-EGFP稳转细胞的趋化效应,且随着硫酸软骨素链长的增加,抑制作用增强。此现象与GAGs与CCL11相互作用相符,随着硫酸软骨素链长增加,其与CCL11相互作用增强,使溶液中游离CCL11 减少,聚集体增多,趋化效应相应降低。
研究表明,趋化因子受体能够发生自聚形成同源寡聚体,也可以与其他趋化因子受体结合形成异源寡聚体),或与其他的非趋化因子受体相互作用[32],趋化因子受体寡聚体的形成对其功能具有诸多影响。CCR5 的同源聚集被认为可以减少HIV感染,而CCL5 作为CCR5 的激动剂,可使受体CCR5二聚体更稳定[33-34]。Hauser等[35]研究表明,CCR7二聚体和其他高阶低聚物形成了一个稳定复合体,能够整合G蛋白和Src依赖的信号通路,从而有效地实现细胞迁移。趋化因子受体CXCR4 被认为是通过形成二聚体以获得适当的生物活性[36]。实验室前期的研究及本实验均发现,CCR3 以单体、二聚体和寡聚体的混合状态存在于细胞膜上,CCR3 的寡聚体状态可以由其结合配体CCL11 调节。同时活细胞单分子实验表明,GAGs的加入会抑制CCL11 诱导的CCR3-EGFP 聚集效应,随着硫酸软骨素长度的增加,抑制能力随之增强。这与上述趋化实验结果相符,随着硫酸软骨素链长的增加,其与CCL11 相互作用增强,在相同浓度下游离的CCL11 单体比例减少,从而大幅降低了对CCR3-EGFP聚集的诱导作用。
基于以上实验结果推测,炎症反应释放的趋化因子CCL11最初被细胞表面的GAGs所捕获,通过CCL11与GAGs的相互作用,可以调控CCL11的聚集,从而保证趋化因子在血流剪切力存在的条件下能够在某一个部位形成浓度梯度,并牵引白细胞逆趋化因子浓度梯度到达炎症部位(图6)。此外,GAGs 密度也较为关键,过高的GAGs 密度会导致趋化因子从GAGs 上解离下来后又再次与GAGs 结合,不易于趋化因子释放到血液中。“云”模型[37-38]认为,趋化因子可以被细胞表面的GAGs所捕获,然后再以可溶性单体形式释放并与白细胞上的受体结合,GAGs的主要作用是将趋化因子集中在某一位置,这些相互作用是动态的,趋化因子经历多轮结合、分离,再重新结合到GAGs上,形成一个趋化因子“云”[37]。趋化因子的可逆结合动力学将使它们在从GAGs链释放时易于获得,以便与白细胞上的受体相互作用,并且在“云”内多次与GAG 再结合可防止它们因血液剪切力而扩散。值得注意的是,体内趋化因子CCL11-GAGs-CCR3相互作用机制将会是一个更为复杂的过程,该过程中还可能会有其他趋化因子、GAGs及趋化因子受体的聚集等因素参与,对该过程的深入研究以及该信号转导过程中下游cAMP、钙流及受体磷酸化等系列级联反应的阐明,将为深入理解趋化因子-GAGs-趋化因子受体之间的相互作用关系及其作用机制提供重要的理论和实验基础(图6)。

Fig.6 Schematic diagram of chemokine(CC)-GAGS-chemokine receptor interaction
4 结 论
本文利用基于TIRF 的单分子荧光技术及活细胞趋化实验系统探究了三者之间的相互作用关系,主要发现 GAGs 的类型及数量均对CCL11 聚集及其与CCR3 的相互作用产生重要影响,GAGs 可以通过调控CCL11的聚集程度,影响CCL11与CCR3的相互作用及其引起的细胞趋化作用,从而在炎症发生过程中的细胞生理反应起到重要的参与调控作用。
附件见本文网络版(http://www.pibb.ac.cn或http://www.cnki.net):
PIBB_20220312_File S1.pdf
