乌头内生细菌JY-3-1R的鉴定及其生防和促生能力研究
2023-11-23邹兰王茜李慕仪叶坤浩黄晶
邹兰 王茜 李慕仪 叶坤浩 黄晶
(1. 西南科技大学生命科学与工程学院,绵阳 621010;2. 绵阳市农业科学研究院中药材研究所,绵阳 621023)
乌头(Aconitum carmichaelii Debx.)是毛茛科(Ranunculaceae)乌头属(Aconitum)多年生草本药用植物,其主根(母根)称乌头,子根称泥附子[1]。乌头常用入药部位为其子根加工品,又称附子。附子具补火助阳、回阳救逆、散寒止痛等药理作用,被誉为回阳救逆第一品[2]。四川江油是乌头道地产区[3],其产品除满足国内需求,还远销英国、日本、韩国等国家,国际国内对乌头产品需求量仍逐年增加[2]。生产上,乌头采用块根无性繁种,种植过程中受白绢病等土传真菌病害的严重威胁。如在道地产区,白绢病可使乌头减产30%-60%,严重时可达70%-80%,甚至绝产[4]。由于抗病品种缺乏,化学农药施用是药农防治乌头白绢病的主要措施,由此带来环境污染、农残及重金属超标以及病原菌耐药性等系列问题。乌头白绢病病原菌为齐整小核菌(Sclerotium rolfsii),有性态为罗氏阿太菌(Athelia rolfsii),但有性态在自然界极为少见[5]。S. rolfsii可以侵染超过600种植物,导致白绢病、枯萎病、腐烂病的发生,对作物生产造成严重经济损失[6]。菌核是S. rolfsii存在和传播的主要方式,可以在土壤中存活很长时间,且对极端环境耐受性极强,因而化学农药对该菌的防治效果不佳[6]。因此,乌头土传病害亟需高效、安全、绿色可持续防治方法。
生物防治,利用有益微生物拮抗、捕食、竞争或激发植物系统性抗性等方式抑制病原菌生长或侵染植物,经济、安全且高效,是土传病害防治的研究热点[7]。生防菌的筛选是生物防治的关键。植物内生菌因其生活周期的全部或部分定殖在植物体内,与植物协同进化,其可通过分泌酶类、抗菌素、挥发性气体等次生代谢产物、与病原菌竞争营养物质和生态位点或者激发植物系统性抗性等方式保障植物健康,是生防菌的重要资源库[8]。部分内生菌可随植物纵向遗传,这对抗病植物育种具有重要意义[9]。乌头内生菌的研究集中在其多样性[10]、分泌生物碱[11-12]等方面,以乌头内生细菌为生防材料防治土传病害的研究比较匮乏。因此本研究从健康乌头植株分离内生细菌,筛选具有高效抑菌能力的菌株,结合室内试验和大田试验研究其生防和促生潜力,并探究其作用机制,旨在为乌头土传病害生物防治提供优良菌种资源。
1 材料与方法
1.1 材料
1.1.1 供试材料 乌头植物:健康乌头植株采自乌头道地产区四川省江油市三合镇(31°49′44′ N,104°47′04′ E,海拔550 m)。乌头品种为绵附1号,由绵阳农业科学研究院选育和保存。用铁锹沿着植物根部方向挖出整株植物,注意不要造成物理性伤口,抖掉根部土壤。植株装入无菌塑料袋,24 h内带回实验室进行处理。
供试病原真菌:乌头白绢病病原菌Sclerotium rolfsii‑1由西北农林科技大学分离鉴定和提供,S.rolfsii‑2由云南农业大学提供。乌头根腐病病原菌Fusarium oxysporum‑1和F. oxysporum‑2由云南农业大学提供。
1.1.2 培养基 LB(Luria‑Bertani)琼脂培养基(g/L):蛋白胨10,酵母粉5,NaCl 10,琼脂12,pH 7.0-7.2;LB液体培养基为LB琼脂培养基不加琼脂。PDA(potato dextrose agar)培养基(g/L):马铃薯200,葡萄糖20,琼脂12。羧甲基纤维素(carboxymcthyl cellulose, CMC)培养基(g/L):羧甲基纤维素钠10,蛋白胨10,NaCl 10,酵母粉5,琼脂粉12,pH 7.0-7.2;蛋白质培养基(g/L):胰蛋白胨5,酵母粉2.5,葡萄糖1,脱脂牛奶7%,琼脂粉12,pH 7.0-7.2;葡聚糖培养基(g/L):K2HPO41,酵母粉5,蛋白胨10,葡聚糖5,MgSO4·7H2O 0.1,刚果红0.4,琼脂粉12,pH 7.0-7.2。
1.2 方法
1.2.1 乌头内生细菌的分离 将乌头植株用自来水冲洗掉沙土和尘埃,将植株不同组织(根、茎、叶)切成1 cm左右大小,并进行表面消毒。先用75%的酒精浸泡5 min,用无菌水清洗3次;接着用2%次氯酸钠(有效氯含量)浸泡8 min,用无菌水清洗5次。吸取最后一次清洗液(100 μL)涂布于LB琼脂培养基,28℃恒温培养7 d,无菌落产生则表示表面消毒彻底,样品用于内生菌的分离。将样品在无菌粉碎机中粉碎,挑取样品匀浆或粉末均匀接种在LB琼脂培养基,28℃恒温培养7 d,选取生长在样品附近的菌落于新的LB琼脂培养基进行纯化(至少3次)直至获得纯菌株。
1.2.2 菌株拮抗病原菌能力测定
1.2.2.1 平板对峙试验 候选细菌菌株接种在LB琼脂培养基,28℃恒温培养直至出现单菌落,挑取单菌落于无菌水中制成菌悬液。供试病原菌接种至PDA培养基,25℃恒温培养至菌丝长满培养基备用。将病原菌菌饼(直径2 mm)接种至新的PDA培养基中央,在距菌饼2 cm处沿4个方向点接种候选细菌菌悬液(10 μL),于25℃恒温培养7 d后测定病原菌菌落直径大小。以病原菌同时接种无菌水为对照。
1.2.2.2 乌头切片对峙试验 选取新鲜健康无物理性伤口的乌头或其子根,切成1 cm厚的薄片并进行表面消毒处理(同1.2.1)。将切片放置在无菌培养皿的无菌湿润滤纸上,将供试细菌菌悬液(同1.2.2.1)接种至切片中间,干燥后接种病原菌菌饼。培养皿用parafilm封口,于25℃恒温培养7 d后测定病原菌菌落直径大小。以病原菌同时接种无菌水为对照。菌株对病原菌的抑制率采用以下公式进行计算: 抑菌率(%)=(对照组病原菌菌落直径-处理组病原菌菌落直径)/对照组病原菌菌落直径 × 100%
1.2.3 菌株分类地位鉴定 挑取供试菌株单菌落接种至LB液体培养基,28℃恒温培养至对数生长期。采用细菌DNA提取试剂盒(Rapid Bacterial Genomic DNA Isolation Kit)提取菌株总DNA,用1%琼脂糖凝胶电泳检测总DNA质量。对4个持家基因16S rRNA、atpD、gyrA和rpoB进行PCR扩增。PCR扩增体系为:2 × Mix 12.5 μL,10 μmol/mL的Primers F 1 μL,10 μmol/mL的Primers R 1 μL,模板DNA 1 μL,ddH2O 9.5 μL。扩增用引物和程序如表1所示。扩增PCR片段采用1%琼脂糖凝胶电泳检测,并用DNA回收试剂盒进行纯化,纯化后的DNA片段送至北京擎科生物公司进行测序。所得序列在NCBI数据库进行序列比对并选取参比菌株(若参比菌株已知全基因组信息,则从中选择目标基因序列用于后续建树分析)。采用Mega X Cluster W对供试菌株序列和参比菌株序列进行单基因和多基因序列比对,采用Neighbor‑Joining法构建单基因和多基因联合系统发育树。
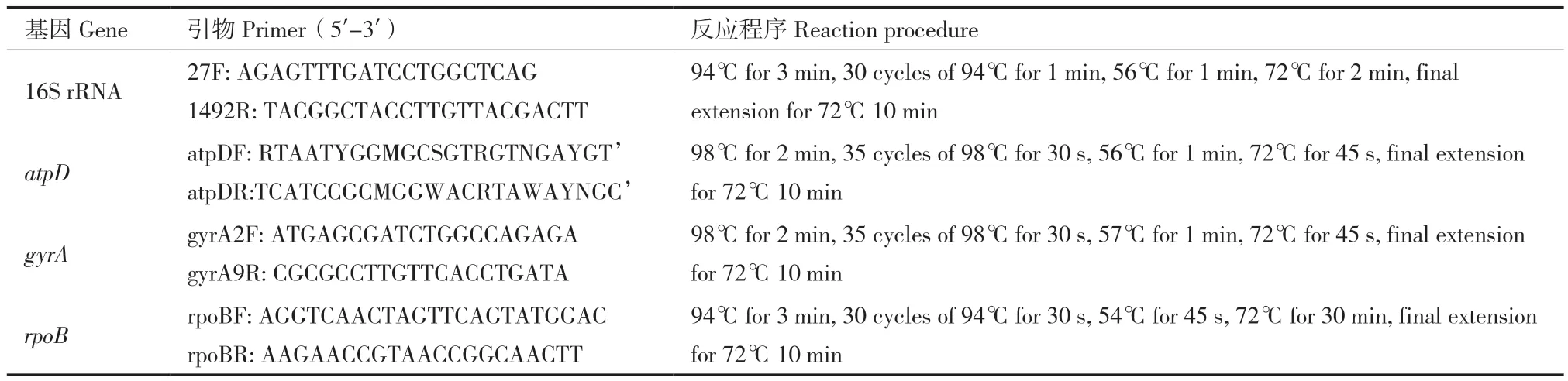
表1 持家基因扩增用引物及反应程序Table 1 Primers and reaction procedure for housekeeping genes
1.2.4 菌株对病原菌的拮抗机理
1.2.4.1 菌株无细胞发酵滤液对病原菌菌丝生长、菌核形成和萌发的影响 将白绢病病原菌S. rolfsii‑1接种至PDA培养基,25℃恒温培养9 d直至获得成熟菌核,搜集菌核备用。将供试菌株接种至LB固体培养基,28℃恒温培养直至出现单菌落,挑取单菌落于100 mL LB液体培养基培养3 d。采用一次性微孔滤膜(直径0.22 μm)将菌株发酵液进行过滤除菌获得无细胞发酵滤液。将无细胞发酵滤液与温热的无菌PDA培养基混合(V∶V=1∶4)并制作平板,获得含无细胞发酵滤液的PDA混合培养基。以含无菌LB液体培养的PDA混合培养基为对照。将病原菌菌饼或菌核(12个/皿)接种至混合培养基,28℃恒温培养9 d,观察病原菌菌丝生长、菌核形成数量以及菌核萌发数量。
1.2.4.2 菌株功能基因PCR扩增 选取脂态(lipopeptides)、二肽类(dipeptide)和聚酮类化合物(polyketides)相关功能基因进行PCR扩增,包括ituC、fenB、fenD、srfAA、bmyB、bacA、baeA和mnlA。PCR扩增用体系、引物和程序参照Ben Khedher等[13]方法。PCR产物用1%琼脂糖凝胶电泳进行检测。
1.2.5 菌株促生能力测定
1.2.5.1 菌株产IAA能力测定 采用Salkowski比色法测定菌株产吲哚乙酸(indoleacetic acid, IAA)的能力[14]。挑取菌株单菌落接种至含1 mL L‑色氨酸(2.5 mg/mL)的LB液体培养基(5 mL),28℃恒温培养2 d,离心取上清液(2 mL)加入4 mL Salkowski比色液[1 mL 0.5 mol/L FeCl3, 49 mL HClO4(35%, V∶V)],室温暗处理30 min后在530 nm波长下测定吸光值。配置不同浓度的IAA标准样品(0,5,10,20,40,60 mg/L),遵照上述方法测定吸光度值并绘制标准曲线,计算候选菌株产IAA的含量。
1.2.5.2 菌株分泌铁载体能力测定 CAS染色液配置:将溶于10 mL双蒸水中的0.012 g铬天青与FeCl3·6H2O溶液(2 mL 1 mmol/L)混合均匀获得溶液a;0.015 g十六烷基三甲基溴化铵溶于8 mL双蒸水,获得溶液b;在不停搅拌的情况下将a液缓慢加到b液中,混合均匀,115℃灭菌20 min,即获得CAS染色液。配置10 × MM9溶液:Na2HPO430 g,KH2PO41.5 g,NaCl 2.5 g,NH4Cl 5 g,双蒸水补足500 mL。CAS培养基:100 mL 10 × MM9溶液,1 mL CaCl2(1 mmol/L), 20 mL MgSO4(1 mmol/L),10 mL葡萄糖(20%),30 mL酪蛋白氨基酸溶液(10%),100 mL CAS染色液,琼脂粉12 g,去离子双蒸水补足1 000 mL,pH 6.8-7.0。挑取供试菌株单菌落于1 mL无菌水制成菌悬液,点接种(10 μL)在CAS培养基,28℃恒温培养3 d,每个处理3次重复,观察是否产生橙色透明圈。
1.2.5.3 菌株产酶能力测定 挑取供试菌株单菌落于1 mL无菌水制成菌悬液,分别点接种(10 μL)在CMC培养基、蛋白质培养基和葡聚糖培养基,每个处理3次重复,28℃恒温培养3 d,观察是否有透明圈存在。CMC培养基用刚果红(1%)溶液染色,观察是否有透明圈存在。
1.2.6 大田试验 大田试验在西南科技大学试验基地进行(31°32′01′ N,104°41′43′ E,海拔470 m),该基地已经连续3年种植乌头,土壤类型为水稻土,乌头品种为绵附1号。采用随机区组试验,每个小区(2.0 m × 3.7 m=3.7 m2)种植200株植物,株距15 cm, 行距25 cm。挑取供试菌株单菌落接种于1 L LB液体培养基,28℃,150 r/min培养至对数生长期获得发酵液。乌头修根时(4月下旬),采用无菌注射器接种发酵液(10 mL, 1 × 109CFU/mL)于乌头根部伤口处,并覆土。无菌LB液体培养基作为阴性对照,接种时间、接种量和方法同菌株发酵液处理。每个处理接种100株,3次重复。接种菌株发酵液后每7 d调查统计白绢病发病植株数量。发病乌头植株表现为地上部萎焉、枯萎甚至死亡,地下部及其周围土壤存在白色病原菌菌丝、白色或黑色菌核。乌头收获时(6月初),每个小区每个处理随机选取5株健康植株,测定乌头、子根、茎鲜重和干重。乌头白绢病田间发病率和菌株生防效率采用以下公式进行计算:
白绢病发病率(%)=发病植株数量/调查总植株数 × 100%
生防率(%)=(对照组发病率-处理组发病率)/对照组发病率 × 100%
1.2.7 数据处理 数据采用单因素方差分析,应用t检验法进行差异显著性检验,P<0.05时表示差异显著。采用Excel 2016和SPSS 25.0进行数据统计和分析,采用Origin 2022制图。16S rRNA、atpD、rpoB和gyrA基因序列已上传至GenBank数据库,序列号分别为:OQ940466, OQ954435, OQ954437和OQ954430。
2 结果
2.1 拮抗菌株的分离筛选
从健康乌头植株分离获得内生细菌111株。采用平板对峙和乌头切片对峙筛选到1株显著抑制白绢病病原菌和根腐病病原菌的乌头内生细菌JY‑3‑1R(图1)。如表2所示,在PDA平板上,JY‑3‑1R对S.rolfsii的抑制率高达53.13%,对F. oxysporum的抑制率高达52.07%。在乌头切片上,JY‑3‑1R对S. rolfsii的抑制率高达49.68%,对F. oxysporum的抑制率高达46.30%(表2)。因此,JY‑3‑1R作为后续试验供试材料,探究其分类地位、促生和生防潜力。
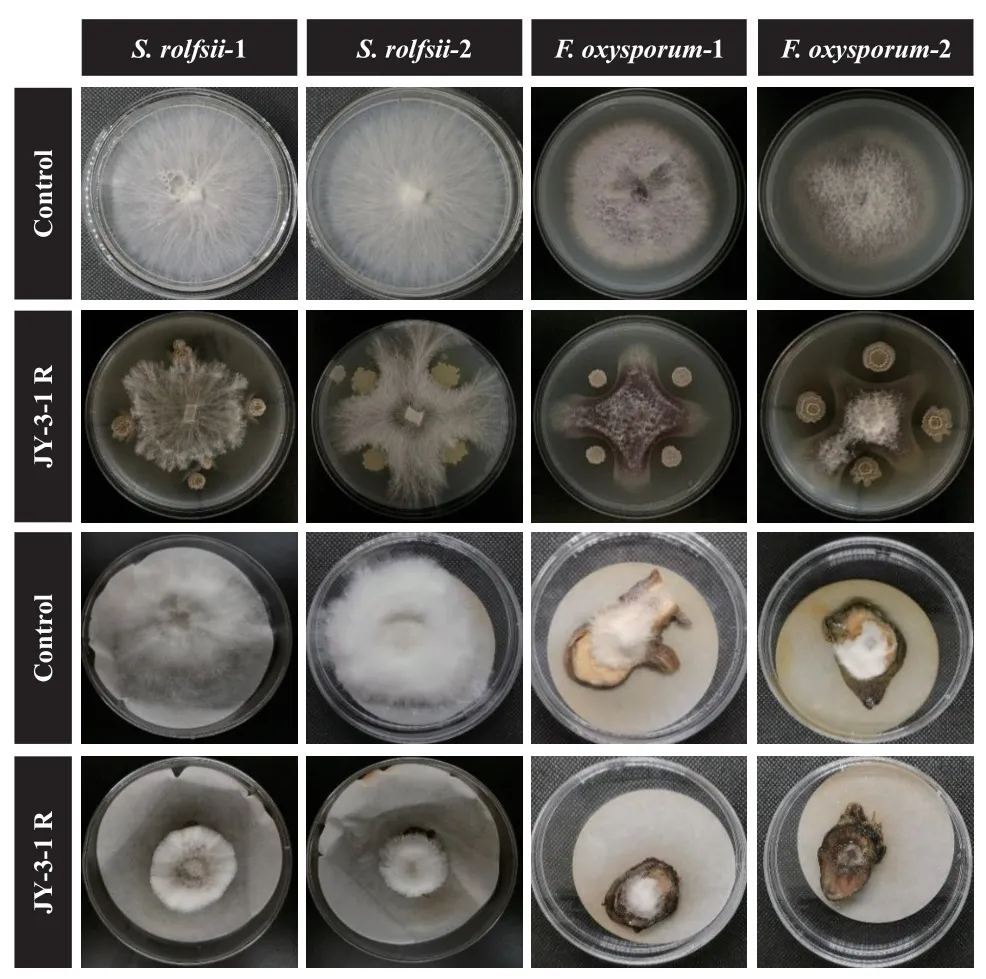
图1 JY-3-1R对病原真菌的抑制效果Fig. 1 Inhibition effects of JY-3-1R against pathogenic fungi

表2 JY-3-1R对病原真菌的抑制效果Table 2 Inhibition effects of JY-3-1R against pathogenic fungi
2.2 JY‑3‑1R分类地位鉴定
对JY‑3‑1R 16S rRNA、atpD、gyrA和rpoB基因进行PCR扩增,分别获得一条1 500 bp、600 bp、750 bp、560 bp的目标条带。基于16S rRNA基因的系统发育结果表明,JY‑3‑1R与芽孢杆菌聚为一个分支(图2‑A),相似度为99.72%。基于atpD‑gyrA‑rpoB的联合系统发育树结果表明,JY‑3‑1R与解淀粉芽孢杆菌聚为一个分支(图2‑B),相似度达98.05%。因此,JY‑3‑1R鉴定为解淀粉芽孢杆菌。

图2 JY-3-1R基于16S rRNA(A)和gyrA-rpoB-atpD多位点持家基因(B)的系统发育研究Fig. 2 Phylogenetic analysis of JY-3-1R based on 16S rRNA gene(A)and multi-locus sequence analysis of gyrA, rpoB and atpD genes(B)
2.3 JY‑3‑1R对S. rolfsii的拮抗机理
2.3.1 JY‑3‑1R无细胞发酵滤液对S. rolfsii生长、菌核形成和萌发的影响 如图3‑A所示,对照处理的S. rolfsii菌丝在72 h时几乎长满整个培养基,在120 h左右开始出现白色菌丝球,在192 h左右形成褐色成熟菌核。JY‑3‑1R无细胞发酵滤液在216 h内均完全抑制S. rolfsii的生长(抑制率100%)。对照处理的S.rolfsii菌核在48 h内开始萌发,72 h菌核萌发形成肉眼可见菌丝体。而JY‑3‑1R无细胞发酵滤液处理的S. rolfsii菌核在120 h仍不萌发,对菌核萌发抑制率为100%(图3‑B)。
图3 JY-3-1R无细胞发酵滤液对齐整小核菌菌丝生长和菌核萌发的影响Fig. 3 Effects of cell-free culture filtrate of JY-3-1R on the hyphal growth and sclerotia germination of S. rolfsii
2.3.2 JY‑3‑1R抑病相关功能基因扩增 以JY‑3‑1R基因组DNA为模板,成功扩增到8个功能基因包括ituC(594 bp)、fenB(670 bp)、fenD(269 bp)、srfAA(201 bp)、bmyB(370 bp)、bacA(500 bp)、baeA(688 bp)、mnlA(668 bp)(图4)。
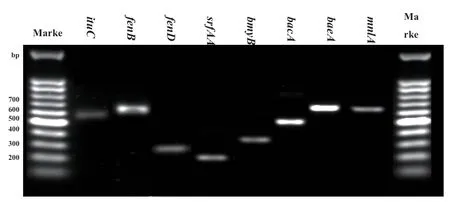
图4 JY-3-1R功能基因PCR产物凝胶电泳Fig. 4 Gel electrophoresis of JY-3-1R functional genes by PCR amplification
2.4 JY‑3‑1R产IAA、铁载体和分泌酶能力
Salkowski比色检测结果表明,JY‑3‑1R能分泌IAA,其分泌量为2.86 mg/L。接种JY‑3‑1R菌悬液至CAS培养基后在菌落附近检测到橙黄色透明圈,说明JY‑3‑1R具分泌铁载体的能力。利用底物降解平板培养法,JY‑3‑1R具分泌蛋白酶、纤维素酶和葡聚糖酶的能力(图5)。
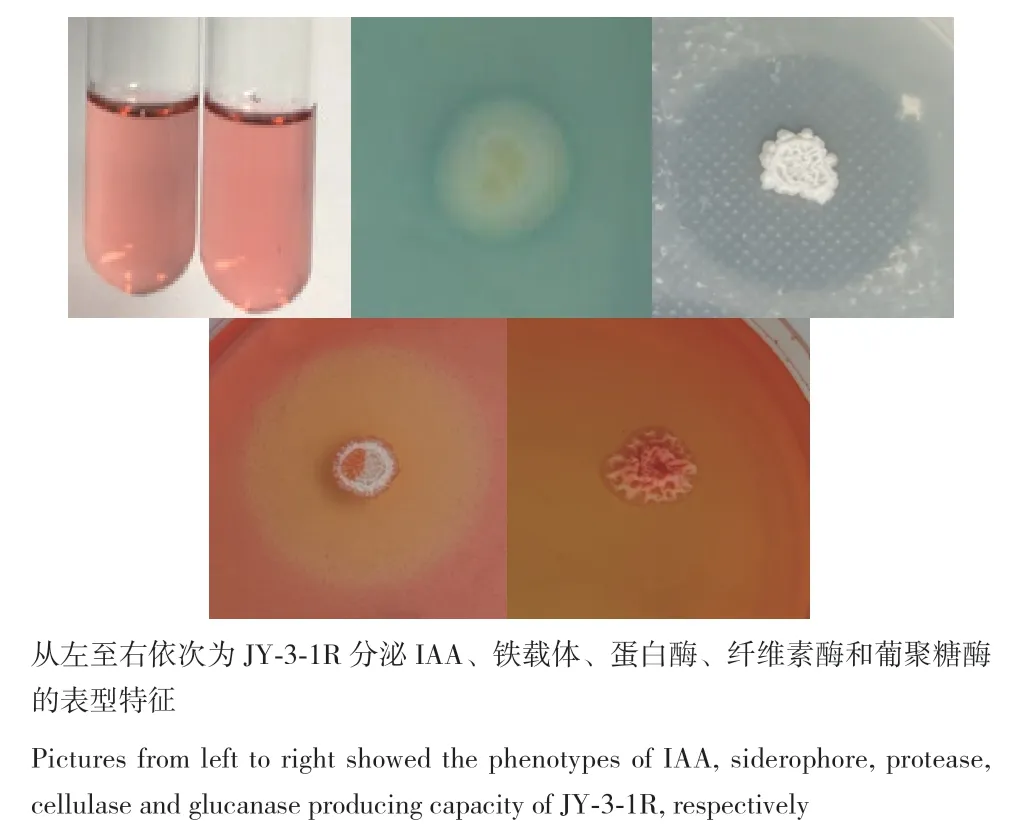
图5 JY-3-1R产IAA、铁载体和分泌酶类能力Fig. 5 Abilities of JY-3-1R producing IAA, siderophore,and secretases
2.5 JY‑3‑1R对乌头白绢病的田间防治效果评价
随着时间增加,不接菌处理(对照组)乌头植株白绢病发病率持续增加,在第7天、14天、21天和30天的白绢病发病率分别为10.83%、25.83%、32.50%和54.17%。JY‑3‑1R发酵液接种后第7天、14天、21天和30天后的乌头植株的白绢病发病率分别为1.67%、5.00%、12.50%和15.83%。从第14天开始,JY‑3‑1R接种处理的乌头白绢病发病率显著低于对照组处理(图6)。JY‑3‑1R对乌头白绢病的生防效率为61.53%-84.61%。
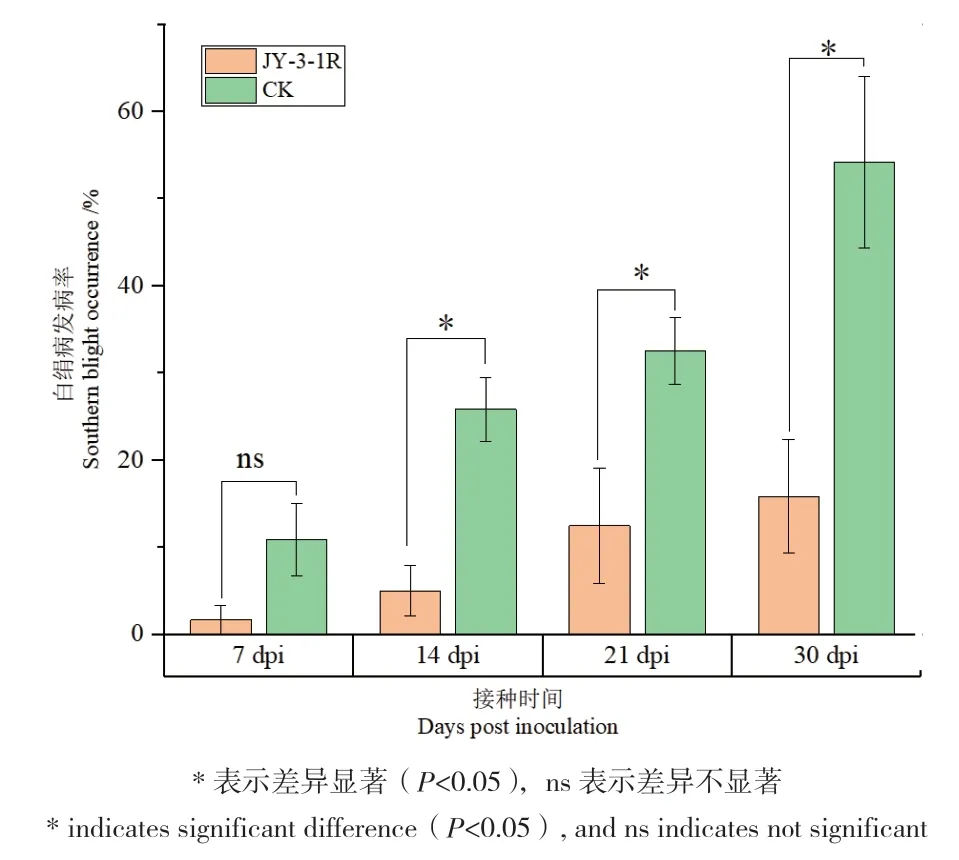
图6 JY-3-1R对乌头白绢病的田间防病效果Fig. 6 Biocontrol potential of JY-3-1R against southern blight by field experiment
2.6 JY‑3‑1R对乌头生长的影响
乌头收获后,测定乌头植株茎、主根(乌头)及子根鲜重和干重,比较分析JY‑3‑1R对乌头生长的影响。结果表明,JY‑3‑1R接种处理的植株茎和乌头的鲜重和干重分别为37.68、9.35、28.43和5.77 g/株,显著高于对照组乌头(表3),分别比对照组增加34.67%、34.34%、46.24%、82.59%。JY‑3‑1R接种处理子根鲜重为77.17 g/株,比对照组处理(48.54 g/株)增加58.98%。JY‑3‑1R处理子根干重为20.01 g/株,比对照组(12.82 g/株)高出56.08%。
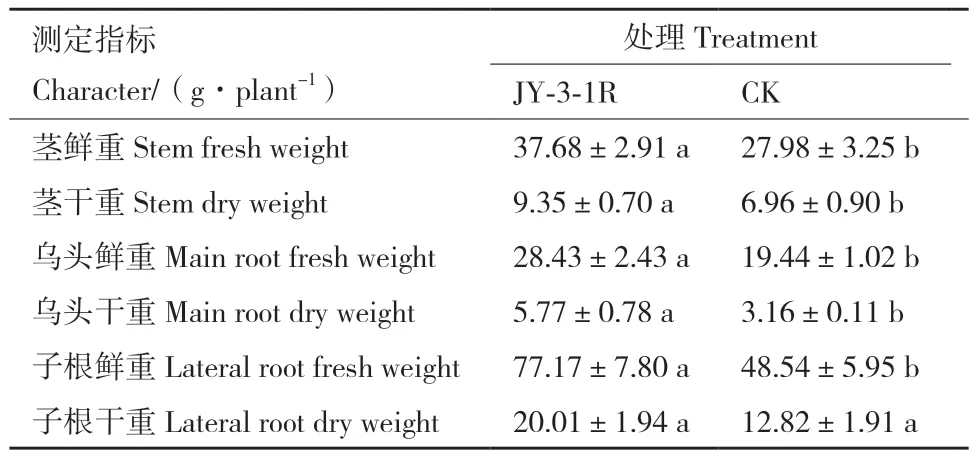
表3 JY-3-1R对乌头生长的影响Table 3 Plant growth promoting effect of JY-3-1R on A.carmichaelii
3 讨论
利用有益微生物防治作物土传病害已成为农业绿色可持续发展的重要手段。常用来防治土传白绢病的有益微生物包括木霉菌、假单胞菌、芽孢杆菌等,已在大豆、花生、甜菜等经济作物相继报道[15-17]。分离自草莓根际土的灰黄青霉菌(Penici‑llium griseofulvum)、密旋链霉菌(Streptomyces pact‑um)和娄彻氏链霉菌(S. rochei)对陕西地区乌头根腐病和白绢病有一定的抑制作用[5,18]。然而利用乌头内生菌防治土传白绢病的研究仍比较匮乏。因此,本研究从乌头道地产区采集健康植株,分离乌头内生细菌,筛选到一株显著抑制白绢病病原菌S.rolfsii和根腐病病原菌F. oxysporum的菌株JY‑3‑1R。基于16S rRNA和多位点持家基因(atpD、rpoB和gyrA)联合系统发育树的结果表明JY‑3‑1R为解淀粉芽孢杆菌(B. amyloliquefaciens)。研究指出,解淀粉芽孢杆菌在植物病害防治方面有着巨大潜力,如分离自人参根际土的B. amyloiuquefaciens FG14 对人参锈蚀根腐病病原菌Ilyonectria robusta的抑制率高达90%[19];B. amyloliquefaciens YZU‑SG146对棉花黄萎病病原菌Verticillium dahliae具有显著抑制效果,盆栽试验中对该病的生防效率达84.2%,同时对Sclerotium、Alternaria、Rhizoctonia、Fusarium等多种病原菌具有抑制作用[20]。
菌核是S. rolfsii传播和侵染植物的主要形式,菌核在适宜条件下萌发成菌丝并侵染植物,因而高效生防菌的筛选应考虑其对S. rolfsii菌核萌发的抑制作用。灰黄青霉菌P. griseofulvum CF‑3无细胞发酵滤液在48 h 内对S. rolfsii菌核萌发的抑制率为44.2%,但在96 h时,该抑制率下降至8.3%[5]。分离自枣椰树的B. velezensis NC318对S. rolfsii有显著抑制作用,其细胞发酵滤液对S. rolfsii菌丝生长抑制率高达97%,对S. rolfsii菌核萌发的抑制率为46.78%,该抑制效果可持续10 d[21]。B.amyloliquefaciens JY‑3‑1R及其无细胞发酵滤液对S.rolfsii菌丝生长和菌核萌发菌有显著的抑制作用,特别是该菌的无细胞发酵滤液对病原菌菌丝和菌核萌发的抑制作用达到100%,该抑制作用可持续至少120 h。对比结果表明JY‑3‑1R对S. rolfsii表现出较强的抑制作用,具有较好的生防潜力。
B. amyloliquefaciens对病原菌的拮抗机制包括分泌具抑菌活性的次生代谢产物、与病原菌竞争营养物质或生态位点以及激发植物系统性抗性[22]。其中,分泌抑菌代谢物质拮抗病原菌是生防菌防治土传病害的重要作用机制,该机制常作为室内生防菌初步筛选的重要指标,抑菌产物的分离和鉴定对生防菌肥的研制和使用也具有重要意义[23-25]。JY‑3‑1R无细胞发酵滤液完全抑制S. rolfsii菌丝生长和菌核萌发(抑制率100%),说明该菌分泌了具较强抑菌活性的代谢产物。为进一步挖掘JY‑3‑1R可能分泌的抑菌代谢产物,本研究对其抑菌相关功能基因进行了扩增。结果表明,JY‑3‑1R基因组包含ituC、fenB、fenD、srfAA、bmyB、bacA、baeA和mnlA相关功能基因。其中ituC基因参与伊枯草菌素(iturin)的合成,fenB和fenD基因参与丰原素(fengyin)的合成,srfAA参与表面活性素(surfactin)的合成,bmyB参与芽孢菌霉素(bacillomycin)的合成,以上物质归属于环状脂态(cyclic lipopeptides),对病原真菌和细菌具有很强的拮抗作用[13,22]。bacA基因参与杆菌溶素(bacilysin)的合成,baeA参与杆菌烯(bacillaene)的合成,而mnlA参与大环内酯(macrolactin)的合成,这些物质归属于聚酮类化合物,对病原真菌和细菌具有较强的抑制作用[13,22]。因而我们推测JY‑3‑1R不仅能抑制真菌性病原菌,对病原细菌也具有一定的抑制作用。此外,本研究证实JY‑3‑1R可以分泌蛋白酶、葡聚糖酶和纤维素酶,这些酶类可以直接作用于病原真菌的细胞壁,破坏细胞壁结构,使细胞内含物流失,进而杀死病原菌[26-27]。研究指出生防菌可通过分泌铁载体与病原菌竞争土壤中的铁元素,进而抑制病原菌生长[28]。本研究发现,JY‑3‑1R具分泌铁载体的能力,其也可能通过分泌铁载体在土壤环境抑制病原菌的生长,但其分泌铁载体的种类及其作用机制有待进一步研究。综上所述,JY‑3‑1R对S. rolfsii的拮抗机理主要为其分泌了具抑菌活性的次生代谢产物,包括环状脂态和聚酮类化合物、酶类、铁载体等物质,以上代谢产物的鉴定和作用机制的解析将有利于探究JY‑3‑1R对S. rolfsii的抑制机理和新型生防材料的挖掘。
由于JY‑3‑1R对病原菌表现出较强的抑制作用,本研究进一步探究了JY‑3‑1R在大田条件下对乌头白绢病的生防和促生效果。大田条件往往比室内和温室环境更为复杂,特别是环境中数量和种类繁多的土著微生物往往会抑制生防菌生长,因而有些在室内具有抑菌作用的菌株在田间往往效果不理想[7,29]。然而JY‑3‑1R在大田条件下对白绢病具有显著的防治效果,生防率为61.53%-84.61%,生防能力可以持续30 d,相对于对照处理,JY‑3‑1R接菌处理可降低白绢病发病率近40%。研究指出,在陕西地区,P. griseofulvum CF3和放线菌菌丝粉末施用土壤后,降低约20%的乌头白绢病发病率[5,18]。虽然陕西和四川江油生态环境可能存在差异,但JY‑3‑1R在乌头道地产区表现出较好的生防潜力。此外,该菌还显著提高了乌头植株茎、主根和子根的生物量,表现出较强的促生能力。其促生能力可能由于该菌可以分泌IAA和铁载体。IAA为植物生长激素,促进细胞分裂和扩增,是植物生长的重要调控因子[30]。铁元素是植物生长的重要元素,但土壤中有效铁的含量往往较低[28,31]。微生物可以通过分泌铁载体吸收土壤中的铁元素,进而促进植物生长[31]。
4 结论
本研究从健康乌头植株分离到1株内生细菌JY‑3‑1R,该菌对白绢病和根腐病病原菌具有显著抑制作用,大田试验证实该菌可以显著降低乌头白绢病发病率并提高乌头植株生物量,表现出较好的生防和促生潜能,其潜在作用机制包括分泌酶类、环酯类化合物、聚酮类化合物、铁载体及IAA。JY‑3‑1R被鉴定为解淀粉芽孢杆菌,具有开发为促进乌头生长和防治乌头白绢病的生物肥料和生防材料的潜力。
