超声引导下国产纳秒刀消融治疗甲状腺微小乳头状癌
2023-11-23岳文文任志刚张雨昂
岳文文,董 刚*,任志刚,张雨昂
(1.郑州大学第一附属医院超声科,2.感染科,河南 郑州 450052)
甲状腺乳头状癌(papillary thyroid carcinoma,PTC)在甲状腺恶性肿瘤中约占80%~90%,多为直径<10 mm 的微小乳头状癌(papillary thyroid microcarcinoma, PTMC)[1]。 不 可 逆 电 穿 孔(irreversible electroporation, IRE)技术为治疗PTMC的新兴手段,但进口设备价格高昂,难以临床普及。我国研发的纳秒脉冲消融系统名为“纳秒刀”,利用万伏高压直流电诱导肿瘤细胞凋亡,现已陆续用于肝脏、胰腺及前列腺肿瘤,均获得较满意的疗效[2-3]。本研究观察超声引导下国产纳秒刀消融治疗PTMC 的效果及其安全性。
1 资料与方法
1.1 一般资料 前瞻性纳入2022 年6 月—2023 年6月12 例于郑州大学第一附属医院就诊的单发PTMC患者,男5 例、女7 例,年龄22~68 岁、平均(36.6±11.5)岁;病灶位于甲状腺左叶6 例、右叶6 例,其中3例位于危险部位(邻近喉返神经、颈总动脉及甲状腺上动脉各1 例);病灶体积6.01~297.07 mm3、中位体积54.48 mm3;术前1 例桥本甲状腺炎、甲状腺功能异常,11 例甲状腺功能正常;均于超声引导下行纳秒刀消融治疗。纳入标准:①术前经细针穿刺活检诊断为PTC;②超声显示病灶最大径≤10 mm,且未突破甲状腺包膜;③无淋巴结转移或远处转移;④拒绝保守治疗或外科手术;⑤随访资料完整。排除标准:①既往癫痫病史;②6个月内心肌梗死;③体内植入心脏起搏器或金属支架;④严重凝血功能障碍或有明显出血倾向;⑤严重器官衰竭或预计生存期<1 年;⑥造影剂过敏。本研究经医院伦理委员会批准(L2022-Q017-004),患者及家属均签署知情同意书。
1.2 仪器与方法 采用Siemens ACUSON Sequoia彩色多普勒超声诊断仪、频率5.5~18.0 MHz 18L6 探头;纳秒刀(杭州睿迪生物科技有限公司),主机NPALC01,消融电极针(直径1 mm,外露长度6/8/10 mm)。超声造影剂为声诺维,每次经肘静脉团注混悬液2.0 ml(图1A)。
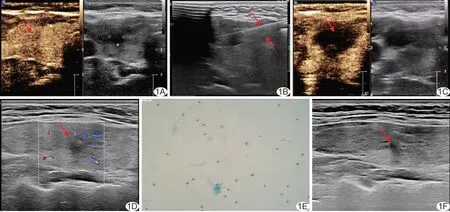
图1 患者女,25 岁,甲状腺右叶PTMC,行超声引导下纳秒刀消融治疗 A.术前CEUS 图示甲状腺右叶6.9 mm×5.7 mm×5.8 mm 低回声结节(箭); B.于超声引导下分别将2 支消融电极针(箭)平行置入病灶两侧深部; C.术后即刻CEUS 图示靶区无明显造影剂充填,提示消融完全(箭); D.术后1 个月甲状腺超声示消融灶4.2 mm×5.5 mm×6.6 mm(箭); E.术后1 个月病理图示滤泡细胞及少许炎细胞,未见肿瘤细胞(巴氏染色,×100); F.术后6 个月甲状腺超声示消融灶横切面不可见,纵切面裂隙样回声(箭)
嘱患者平卧,充分暴露颈部,联合应用阿芬太尼、环泊酚、依托咪酯、米库氯铵进行麻醉诱导,放置喉罩,并以环泊酚及瑞芬太尼静脉维持麻醉;之后常规消毒、铺巾,依据超声所示结节位置、大小及拟进针切面适当选择消融电极针,设置2~5 组脉冲,每组发射200~400 个脉冲。于超声引导下将2 支消融电极针平行置入病灶两侧深部(图1B)后启动消融,参数:脉冲宽度300 ns、电压15 kV、发送模式120 PPM(放电120 次/分),期间以超声观察病灶回声变化,并及时调整主机参数,消融至低回声完全覆盖靶区。即刻行超声造影(contrast enhanced ultrasound, CEUS)观察消融效果(图1C),若仍见造影剂进入靶区,则予以追加消融,直至靶区无造影剂充填后拔除电极针。术后严密监测患者生命体征,观察有无局部疼痛、肿胀及呼吸困难等。
1.3 观察指标 分别于消融术前日、手术次日及术后1 个月检测三碘甲腺原氨酸(triiodothyronine, T3)、甲状腺素(thyroxine, T4)、促甲状腺激素(thyroidstimulating hormone, TSH)、游离T3(free T3, FT3)及游离T4(free T4, FT4)。于消融术后第1、3、6 个月复查超声(图1D、1F),观察有无复发、转移,测量消融后病灶最大径,计算病灶体积、病灶体积缩小率(volume reduction ratio, VRR)及消融灶VRR:V=上下径×前后径×左右径×π/6; VRR病灶=(V消融前病灶-V随访病灶)/V消融前病灶×100%; VRR消融灶=(V消融后即刻病灶-V随访病灶)/V消融后即刻病灶×100%;靶病灶完全消失或仅见线状、点状、瘢痕及钙化时,判定VRR 为100%。于消融后第1、3、6 个月随机抽取不同数量病例行超声引导下细针穿刺活检,观察并记录消融灶病理结果及有无复发、转移等(图1E),以消融灶内出现新发病灶为局部复发,消融灶外出现新发病灶为区域性复发。
1.4 统计学分析 采用SPSS 26.0 统计分析软件。以±s表示符合正态分布的计量资料,组间行t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 有效性 12 例PTMC 均一次完全消融成功。术后随访1 个月~1 年,中位随访时间4.5 个月。消融后第1、3、6 个月12 例超声均未见复发、转移,中位VRR病灶分别为-14.43%、81.79% 及100%,中位VRR消融灶分别为92.46%、98.56% 及100%,见表1。术后1、3、6 个月分别对4、1、1 例行超声引导下细针穿刺活检,病理结果均未见PTC 细胞。

表1 12 例PTMC 消融治疗前、后病灶VRR 和消融灶VRR
2.2 安全性 术后1 例颈部疼痛,3 天后自行缓解。12 例均未见出血、喉返神经损伤及心律失常等严重并发症。11 例术前甲状腺功能正常患者中,7 例(7/11,63.64%)手术次日检出甲状腺功能异常,其消融前日与次日T3、T4、TSH、FT3及FT4差异均有统计学意义(P均<0.05),而术后1 个月复查均恢复正常,消融前日与术后1 个月TSH 差异有统计学意义(P<0.05),见表2;其余4 例甲状腺功能未见异常。
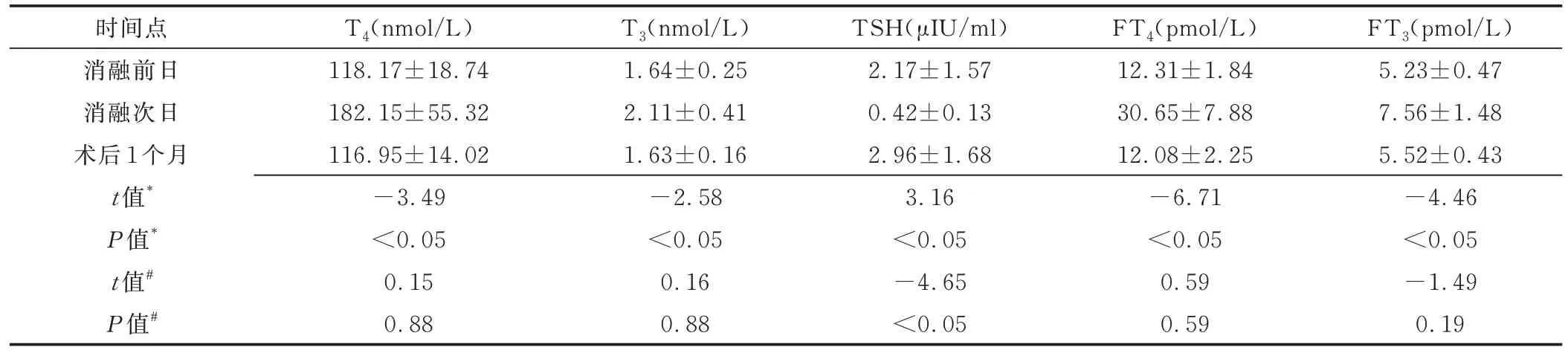
表2 7 例PTMC 消融治疗前、后甲状腺功能比较
3 讨论
随着超声设备分辨率的提高及弹性成像、超声引导下细针穿刺活检等技术的普及,PTMC 检出率逐渐升高。手术及射频、微波和激光消融等热消融技术均可用于治疗PTMC[4]。与热消融致肿瘤细胞坏死不同,IRE 技术通过诱导肿瘤细胞凋亡而灭活肿瘤,治疗更为精准,对周围组织损伤更小,尤其适用于毗邻血管、神经等危险部位的实体肿瘤。IRE 技术最初用于消融实体肿瘤,所用电场强度为1 500 V/cm、脉宽为微秒级别,穿孔孔径为3 nm。国产纳秒刀可实现万伏级高压电场及纳秒级超短脉冲,电场强度高达30 000 V/cm,穿孔孔径小至1 nm,对肿瘤细胞细胞膜、细胞核及线粒体等均可产生穿孔效应[5-6]。多项国外研究[7-9]报道,以IRE 技术消融治疗肝癌、胰腺癌、肾癌及前列腺癌均安全、有效;国内也已陆续开展了纳秒刀消融治疗实体肿瘤的动物实验和临床试验[10-11]。
既往研究[12-13]报道,以射频或微波消融治疗单发PTMC 后,消融灶吸收往往需要6~18 个月。本研究发现,纳秒刀消融术后第1 个月为消融灶快速吸收期,VRR消融灶为75.50%~99.00%,术后3 个月中位VRR消融灶达98.56%,提示纳秒刀术后消融灶缩小速度显著优于射频及微波消融[12-13];本组部分VRR病灶呈负值,系术中消融范围过大所致,提示有必要进一步调整消融参数。本组7 例(7/11,63.64%)手术次日出现甲状腺功能异常,1 个月后均恢复正常,与其他消融技术结果相似[14];术后1 个月TSH 水平稍高于术前,考虑与激素一过性释放有关。此外,本组对3 例位于危险部位的PTMC 均一次完全消融且未出现并发症,提示其安全性较好。
国产纳秒刀消融治疗PTMC 的优势:①消融过程中通过2 支固定消融电极针间的应电场精准把控消融范围,可在均匀消融的同时有效降低肿瘤针道种植的风险;②消融后周围组织肿胀较轻[15],消融灶吸收速度较快,用于治疗位置较表浅如峡部、靠近包膜等处病变不致引发颈部长期肿胀;③不会对血管、神经产生热损伤,有助于减少围手术期出血、喉返神经损伤等并发症;④避免热消融过程中热沉降效应所致消融不彻底[16-17]。国产纳秒刀消融治疗PTMC 的不足:需在全身麻醉状态下进行,对患者条件要求较高。
综上所述,超声引导下国产纳秒刀消融治疗PTMC 有效且安全。但本研究样本量小,随访时间短,有待进一步观察。
