急支糖浆HPLC 特征图谱建立及7 种成分测定
2023-11-23李丽敏周如洁毛秀红
李丽敏,周如洁,李 康,3,胡 青,毛秀红,季 申*
(1.上海市食品药品检验研究院,上海 201203; 2.国家药品监督管理局中药质量控制重点实验室,上海 201203; 3.上海中医药大学中药学院,上海 201203)
急支糖浆收载于2020 年版《中国药典》 一部[1],由四季青、鱼腥草、金荞麦、紫菀、前胡、麻黄、枳壳、甘草8 味中药组成[2],方中金荞麦、四季青为君药[3],可清热治痰; 前胡、紫菀为臣药,可疏风散结、温肺下气; 枳壳可下气消痞,辅佐治痰理气; 麻黄、甘草为止咳经典药对,可清热解毒、宣肺平喘,临床上用于治疗外感风寒所致的咳嗽、急慢性支气管炎等呼吸系统疾病[4-6]。该制剂现行质量标准中仅收载了盐酸麻黄碱、柚皮苷、原儿茶酸、阿魏酸TLC 鉴别及柚皮苷含量测定项,故研究人员陆续开发了其HPLC 指纹图谱、多成分含量测定方法[7-10],但前者未考虑不同成分的紫外吸收特征差异大,可能会造成一些药味表征不明显。
质量标志物(Q-marker) 是与中药功能属性密切相关的成分,可作为反映其质量有效性、安全性的物质[11-13]。本实验建立急支糖浆HPLC 特征图谱,并测定原儿茶酸、原儿茶醛、绿原酸、柚皮苷、新橙皮苷、甘草酸铵、白花前胡甲素的含量,以期为该制剂质量控制提供参考。
1 材料
1.1 仪器 Agilent 1260 高效液相色谱仪,配置四元泵、脱气机、自动进样器、柱温箱、二极管阵列检测器(美国Agilent 公司); Waters 2695-2489 型高效液相色谱仪 (美国Waters 公司); Milli-Q Gradient A10 纯水仪 (美国 Millipore 公司);CP225D 电子天平(万分之一)、CP211D 电子天平(十万分之一) (德国赛多利斯公司)。
1.2 试剂与药物 11 批急支糖浆及相关药材饮片、阴性样品均由太极集团重庆涪陵有限公司提供,其中药材饮片经上海市食品药品检验研究院中药天然药物研究所杨新华主管药师鉴定为正品。原儿茶酸、原儿茶醛、绿原酸、柚皮苷、新橙皮苷、甘草酸铵、白花前胡甲素对照品均购自中国食品药品检定研究院。甲醇、乙腈、冰乙酸为色谱纯(德国Merck 公司); 水为去离子水。
2 方法与结果
2.1 色谱条件 Waters Xbridge C18色谱柱(4.6 mm×250 mm,5 μm); 流动相乙腈(A) -2%冰乙酸(B),梯度洗脱,程序见表1; 柱温25 ℃;检测波长0 ~24 min 280 nm (原儿茶醛、原儿茶酸),24 ~45 min 325 nm (绿原酸),45 ~65 min 280 nm (柚皮苷、新橙皮苷),65 ~72 min 254 nm(甘草酸铵),72 ~80 min 325 nm (白花前胡甲素)。
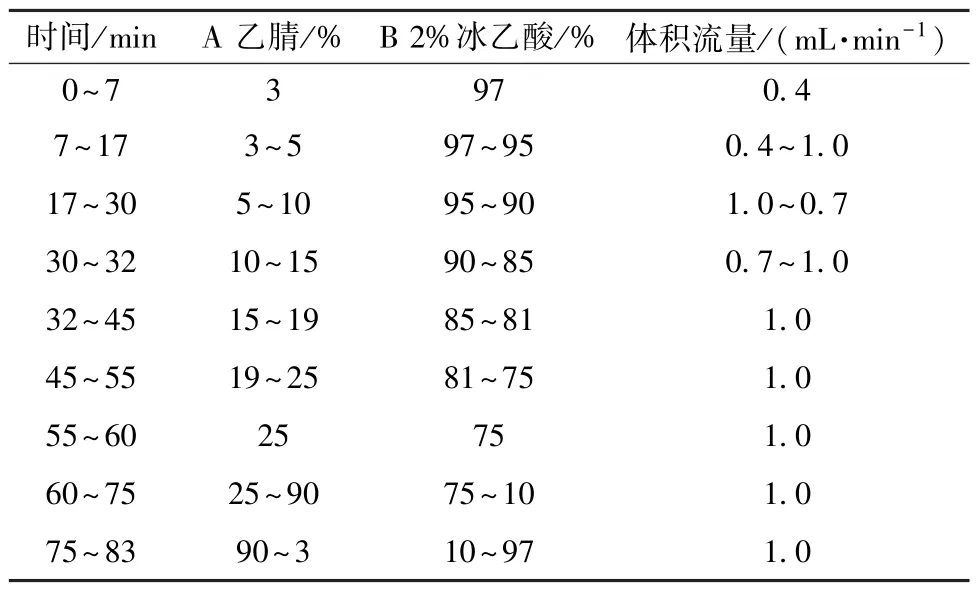
表1 梯度洗脱程序Tab.1 Gradient elution programs
2.2 溶液制备
2.2.1 供试品溶液 精密称取本品5 g,置于25 mL 量瓶中,70% 甲醇定容至刻度,摇匀,10 000 r/min离心5 min,取上清液,即得。
2.2.2 对照品溶液 精密称取原儿茶酸、原儿茶醛、绿原酸、柚皮苷、新橙皮苷、甘草酸铵、白花前胡甲素对照品适量,70% 甲醇定容至刻度,即得。
2.3 HPLC 特征图谱建立
2.3.1 Q-marker 确定 本实验根据相关文献中各药材所含功效成分结合11 批样品中稳定存在的有效成分,确定11 个共有峰作为Q-marker 特征峰,其中原儿茶酸、原儿茶醛、绿原酸、柚皮苷、新橙皮苷、甘草酸铵、白花前胡甲素已进行确认,见图1。

图1 急支糖浆HPLC 特征图谱Fig.1 Characteristic HPLC chromatograms of Jizhi Syrup
再以相应阴性空白进行专属性考察,发现除峰8 外其余特征峰均无干扰; 峰1 ~6 来源于四季青、鱼腥草、紫菀、金荞麦等药材,与文献报道上述药材均含有机酚酸类成分一致,其中峰2、4、5 分别为原儿茶酸、原儿茶醛、绿原酸,峰7、9 为枳壳有效成分,峰10 来源于甘草,峰11 来源于前胡;峰8 与橙皮苷对照品保留时间一致,阴性空白确认此处有来自四季青等药材的干扰,但该峰在11 批样品中均稳定存在,可能是药材提取过程中共同作用的成分,故选择其作为Q-marker 监控指标,见图2。

图2 急支糖浆HPLC 特征图谱专属性验证图Fig.2 Specificity verification diagram for characteristic HPLC chromatograms of Jizhi Syrup
2.3.2 相对保留时间确定 比较8 根不同品牌、长度的常规C18色谱柱(5 μm×4.6 mm),发现特征峰保留时间差异较大。以特征峰与参比峰(S峰) 相对保留时间比值(fTr) 进行鉴别,发现后者差异与前者密切相关,(1) 选择峰2 作为S 峰,在其保留时间相近梯度区域的峰1、3、6 在不同色谱柱上的相对保留时间RSD 均小于5%,但与峰2洗脱梯度差异较大的峰8、9、11 相对保留时间RSD 较大(5% ~13%),表明其偏差与洗脱顺序呈正相关; (2) 峰8、9、11 以峰7 (柚皮苷) 为参比S2 时,在不同色谱柱上的fTr精密度大大改善,RSD 分别为0.5%、0.7%、4.5%; (3) 以就近原则选择同洗脱梯度阶段甘草酸铵色谱峰作为参比S3 时,峰11 在不同色谱柱上的fTr进一步改善(RSD=1.0%)。
在3 个梯度洗脱阶段选择参比S 峰计算fTr,其中峰1、3、6 选择原儿茶酸作为S1 峰,峰8 选择柚皮苷作为S2 峰,峰11 选择甘草酸铵作为S3 峰,以不同色谱柱上的fTr平均值确定判定标准分别为0.68 (峰1)、1.18 (峰3)、1.90 (峰6)、1.03(峰8)、1.09 (峰11),并选择其±10%范围作为特征峰鉴定条件,见表2。

表2 不同色谱柱上相对保留时间Tab.2 Relative retention time in different columns
2.3.3 重复性、稳定性、中间精密度试验
2.3.3.1 重复性试验 取同一份本品 (批号13090998),按“2.2.2” 项下方法平行制备6 份供试品溶液,在“2.1” 项色谱条件下进样测定,测得特征峰1、3、6、8、11fTr均在规定范围内,RSD 均小于0.5%,表明该方法重复性良好。
2.3.3.2 稳定性试验 取“2.3.3.1” 项下第1 份供试品溶液,于0、1、15、25、96 h 在“2.1” 项色谱条件下进样测定,发现各成分特征峰fTr均在规定范围内,RSD 均小于0.7%,表明溶液在96 h内稳定性良好。
2.3.3.3 中间精密度试验 由不同人员分别采用不同仪器、色谱柱进行分析,发现各成分特征峰fTrRSD 在0.65% ~2.46%范围内,表明该方法精密度良好。
2.4 各成分含量测定
2.4.1 专属性试验 图1 显示,各成分均无干扰,表明该方法专属性良好。
2.4.2 线性关系考察 精密吸取“2.2.2” 项下对照品溶液适量,在“2.1” 项色谱条件下进样测定。以对照品峰面积(Y) 对其进样量(X) 进行回归,结果见表3,可知各成分在各自范围内线性关系良好。

表3 各成分线性关系Tab.3 Linear relationships of various constituents
2.4.3 重复性、稳定性试验及检测限、定量限测定
2.4.3.1 重复性试验 取本品(批号13090998)适量,按“2.2.1” 项下方法平行制备6 份供试品溶液,在“2.1” 项色谱条件下进样测定,测得原儿茶酸、原儿茶醛、绿原酸、柚皮苷、新橙皮苷、甘草酸铵、白花前胡甲素含量RSD 分别为1.8%、1.1%、1.0%、1.0%、1.6%、1.3%、0.9%,表明该方法重复性良好。
2.4.3.2 稳定性试验 取“2.4.3.1” 项下第1 份供试品溶液,于0、6、15、25、96 h 在“2.1” 项色谱条件下进样测定,测得原儿茶酸、原儿茶醛、绿原酸、柚皮苷、新橙皮苷、甘草酸铵、白花前胡甲素峰面积RSD 分别为0.6%、1.0%、0.7%、1.3%、2.8%、0.5%、0.5%,表明溶液在96 h 内稳定性良好。
2.4.3.3 检测限、定量限测定 以回归方程第1点的色谱峰响应计算各成分信噪比,选择3 倍信噪比作为检测限,10 倍信噪比作为定量限(取样量5 g,定容体积25 mL),测得前者在0.001 ~0.035 mg/g 范围内,后者在0.004~0.114 mg/g 范围内。
2.4.4 加样回收率试验 精密吸取含原儿茶酸1.516 mg、原儿茶醛0.160 2 mg、绿原酸0.441 mg、柚皮苷1.557 mg、新橙皮苷0.811 mg、甘草酸铵0.177 6 mg、白花前胡甲素0.060 1 mg 的对照品溶液0.8、1.0、1.2 mL,每个体积3 份,置于25 mL量瓶中,再精密称取“2.4.3.1” 项下本品2.5 g,置于上述量瓶中,按“2.2.1” 项下方法制备供试品溶液,在“2.1” 项色谱条件下进样测定,计算回收率。结果,原儿茶酸、原儿茶醛、绿原酸、柚皮苷、新橙皮苷、甘草酸铵、白花前胡甲素平均加样回收率分别为98.6%、96.2%、97.6%、97.7%、100.3%、100.4%、98.6%,RSD 分别为 2.6%、2.3%、2.6%、1.3%、1.4%、2.7%、1.4%。
2.4.5 样品含量测定 取 11 批样品,按“2.2.1” 项下方法制备供试品溶液,在“2.1” 项色谱条件下进样测定,计算含量,结果见表4。由此可知,各成分含量依次为柚皮苷>原儿茶酸≈新橙皮苷>甘草酸>绿原酸>白花前胡甲素,其中绿原酸、原儿茶酸批次间变异系数较大,其次为甘草酸、原儿茶醛、白花前胡甲素,而柚皮苷、新橙皮苷较稳定。
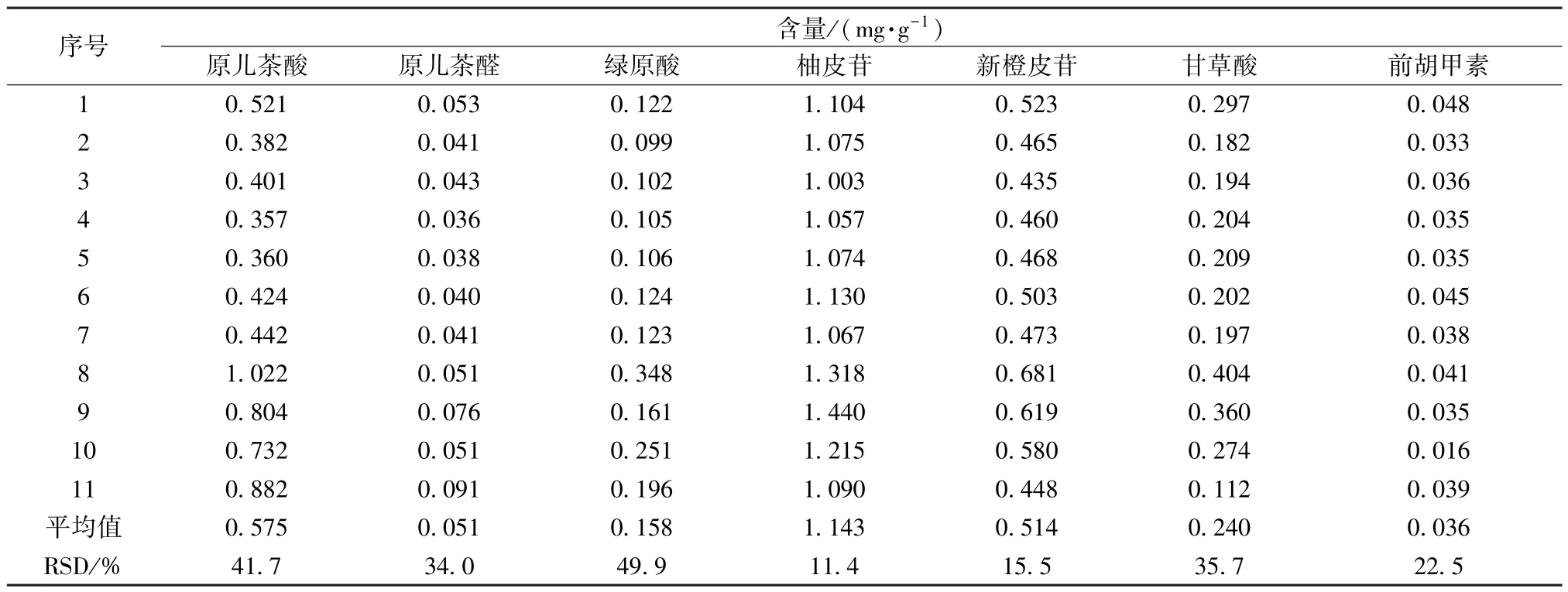
表4 各成分含量测定结果Tab.4 Results of content determination of various constituents
3 讨论
3.1 色谱条件考察 本实验考察了不同体积分数甲酸、冰醋酸,发现2% 冰醋酸(pH 约为2.15)作为水相时各成分色谱峰分离度更理想,故选择耐酸型色谱柱。另外,色谱柱柱长为25 cm 时对原儿茶酸等有机酸类成分的分离度优于15 cm 时。
DAD 光谱表明,原儿茶酸在254、288 nm 处具有吸收峰,但在254 nm 处有干扰; 原儿茶醛在280、325 nm 处具有吸收峰; 绿原酸在325 nm 处具有最大吸收峰; 柚皮苷、新橙皮苷在280 nm 处具有吸收峰,甘草酸铵在254 nm 处具有最大吸收峰,白花前胡甲素在322 nm 处具有最大吸收峰。综合特征吸收、干扰情况,选择254、280、325 nm 波长切换方式进行检测,此时各成分色谱峰信息丰富、无干扰,可确保低含量成分响应最高。
3.2 Q-marker 选择 本实验基于文献[14-21] 报道的药材物质基础,结合单味药材模拟提取工艺,发现四季青、金荞麦、鱼腥草、紫菀均含有原儿茶酸、原儿茶醛、绿原酸等成分,以四季青提取液中有机酸种类最丰富,含量最高; 枳壳提取液中除了柚皮苷、新橙皮苷外,还含有少量橙皮苷,其保留时间与HPLC 特征图谱中的峰8 一致,尽管其他成分对该色谱峰有干扰,但它在每批样品中均稳定,故作为特征峰用于鉴别; 甘草提取液中除了甘草酸铵外,还检出少量甘草苷,但因干扰严重而未列入; 前胡提取液中检出白花前胡甲素、白花前胡乙素,但后者因含量极低而未列入。
3.3 HPLC 特征图谱标准制定 本实验以相对保留时间(fTr) 为鉴别特征,参照物选择与其关系密切者,发现在梯度洗脱条件下特征峰保留行为与梯度洗脱阶段的相关性强,故采用多段参比模式,最终确定3 个S 峰来计算fTr,可大大提升方法耐用性,从而为复杂色谱条件特征图谱指标的选择提供了参考。同时,考察了阿魏酸、盐酸麻黄碱等文献报道的成分,但发现其干扰均较严重,并且阿魏酸表征专属性难度大,故当前急支糖浆公示稿已删除该鉴别项,本实验也未纳入该成分[22]; 麻黄碱、盐酸伪麻黄碱为麻黄特征成分,鉴于该类生物碱的提取、除杂方法及分析条件与有机酸、黄酮差异较大,本实验未测定其含量,今后将另行建立专属性的质量控制方法。
