桔皮素固体脂质纳米粒制备及其体内药动学研究
2023-11-23杨丽萍李伟宏
杨丽萍,李伟宏
(河南应用技术职业学院,河南 郑州 450042)
桔皮素属于天然多甲氧基黄酮类化合物,在柑橘属植物果皮及枳实、青皮、陈皮等中药中均可提取得到[1-2],具有抗炎、抗肿瘤、降血糖、保护神经、保护皮肤、护肝、改善记忆等活性[1,3],并且毒性极小[4],可应用于临床,但该成分饱和溶解度仅为(15.12±0.18) μg/mL,导致其溶出度极低; 油水分配系数logP值为3.5[5],表明其脂溶性良好。文献[6] 报道,桔皮素容易受胃肠道pH值影响而发生降解,并且该成分也是P-糖蛋白底物[7],口服绝对生物利用度仅为6.02%[8]。目前,桔皮素制剂有自微乳[7]、淀粉纳米粒[9]等类型。
固体脂质纳米粒可提高药物溶解度、溶出度,增加被包载药物体内吸收[10-12]。辛酸癸酸聚乙二醇甘油酯(Labrasol) 是一种非离子型表面活性剂,可通过减少体内代谢、抑制P-糖蛋白外排等作用来提高药物生物利用度[13-14]。本实验制备桔皮素固体脂质纳米粒,并考察该制剂体内药动学,以期为相关制剂开发提供参考。
1 材料
JC-TP3/B 型电子分析天平(青岛精诚仪器仪表有限公司); Agilent 1200 型高效液相色谱仪(美国Agilent 公司); DJ-1A 型实验室数显恒温磁力搅拌器(佛山轻子精密测控技术有限公司);Master-sizer 型粒度分析仪(英国马尔文仪器有限公司); TMX-22R 型高速离心机(美国Beckman 公司); PS-30 型超声仪(深圳市得康科技有限公司); MDS-2008DS 型溶出试验仪(宁波新芝生物科技股份有限公司); TK-201 型X 射线粉末衍射仪(北京泰坤工业设备有限公司); DSC-3 型差示扫描量热仪(梅特勒托利多科技有限公司); YTST-24 型水浴氮吹仪(南京晓晓仪器设备有限公司)。
桔皮素原料药(批号20200222,纯度97.6%,成都格利普生物科技有限公司); 桔皮素对照品(批号K177866,西安开来生物工程有限公司)。单硬脂酸甘油酯(批号201025,北京凤礼精求医药股份有限公司); 辛酸癸酸聚乙二醇甘油酯(Labrasol,批号20210158,上海嘉法狮贸易有限公司); 泊洛沙姆188 (批号20191025,上海运宏化工制剂辅料技术有限公司)。
SD 大鼠,雌雄兼具,体质量200 ~240 g,购自河南省动物实验中心,实验动物生产许可证号SCXK (豫) 2020-0001。
2 方法与结果
2.1 桔皮素含量测定 采用HPLC 法。
2.1.1 色谱条件 Agilent SB-C18色谱柱(250 mm×4.6 mm,5 μm); 流动相甲醇-水(70 ∶30); 体积流量1.0 mL/min; 柱温30 ℃; 检测波长375 nm;进样量10 μL。
2.1.2 线性关系考察 精密称取桔皮素对照品26.80 mg,置于100 mL 量瓶中,甲醇超声溶解,静置至室温后甲醇稀释定容,得到268 μg/mL 贮备液,密封保存,流动相依次稀释至13.4、6.7、1.34、0.67、0.335、0.067 μg/mL,在 “2.1.1”项色谱条件下进样测定。以对照品峰面积(Y) 对其质量浓度 (X) 进行回归,得方程为Y=20.155 7X+0.163 8 (r=0.999 8),在0.067~13.4 μg/mL 范围内线性关系良好。
2.1.3 供试品溶液制备 精密吸取固体脂质纳米粒混悬液1 mL,转移至50 mL 量瓶中,加30 mL甲醇超声(功率250 W) 处理3 min,甲醇稀释定容并摇匀,0.45 μm 微孔滤膜过滤,取5 mL 续滤液,流动相稀释至2 倍,即得。
2.1.4 方法学考察 取同一份供试品溶液,在“2.1.1” 项色谱条件下进样测定6 次,测得桔皮素含量RSD 为1.04%,表明仪器精密度良好。取同一份固体脂质纳米粒,按“2.1.3” 项下方法制备6 份供试品溶液,在“2.1.1” 项色谱条件下进样测定,测得桔皮素含量RSD 为1.77%,表明该方法重复性良好。取“2.1.3” 项下供试品溶液适量,于0、2、4、8、12、24 h 在“2.1.1” 项色谱条件下进样测定,测得桔皮素含量RSD 为0.89%,表明溶液在24 h 内稳定性良好。取9 份固体脂质纳米粒混悬液,每份0.5 mL,转移至50 mL 量瓶中,分为低、中、高3 组,每组3 份,分别加入“2.1.2” 项下贮备液0.8、1.2、1.6 mL,按“2.1.3” 项下方法制备供试品溶液,在“2.1.1”项色谱条件下进样测定,测得桔皮素平均加样回收率分别为99.48%、100.94%、101.42%,RSD 分别为0.62%、0.34%、0.58%。
2.2 固体脂质纳米粒制备 采用熔融-高压均质法。称取桔皮素原料药30 mg,置于圆底烧瓶中,加入处方量固态脂质,65 ℃水浴搅拌(800 r/min)至熔融状态; 配制一定质量浓度的Labrasol、泊洛沙姆188 溶液各50 mL,搅拌至相同温度,作为水相,将水相加到熔融液中,搅拌10 min 后高压均质,置于-20 ℃冰箱中冷却8 min,取出,0.45 μm微孔滤膜过滤,补加蒸馏水至50 mL,摇匀,即得。
2.3 包封率、载药量、粒径、Zeta 电位测定 精密吸取固体脂质纳米粒混悬液1 mL,按“2.1.3”项下方法制备供试品溶液,测定桔皮素总量m总;另精密吸取1 mL,置于超滤管中(截留分子量10 kDa),12 000 r/min 离心20 min,取续滤液,测定游离桔皮素量m游离,计算包封率、载药量,公式分别为包封率= [(m总-m游离) /m总] ×100%、载药量= [(m总-m游离) /m] ×100%,其中m为药物、载体总量。再取固体脂质纳米粒混悬液适量,蒸馏水稀释至40 倍,摇匀,取适量至比色皿中,测定粒径、Zeta 电位,平行3 次。
2.4 处方优化 采用单因素试验。
2.4.1 固态脂质种类 参考文献[15-16] 报道,取单硬脂酸甘油酯、双硬脂酸甘油酯、硬脂酸各1 g,加热至高于熔融点10 ℃,加入2 mg 桔皮素原料药,搅拌溶解,测定溶解量,结果见表1。由此可知,单硬脂酸甘油酯对桔皮素的溶解量最大,故选择其作为固态脂质,并确定加热温度为65 ℃。
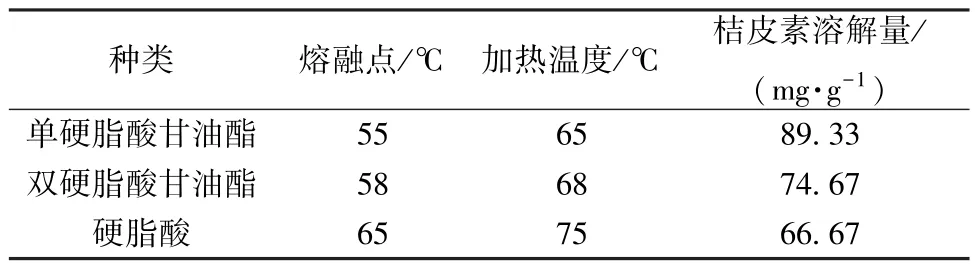
表1 固态脂质种类对桔皮素溶解量的影响(n=3)Tab.1 Effects of solid lipid kind on the dissolution amount of tangeretin (n=3)
2.4.2 脂药比 固定桔皮素用量30 mg,Labrasol用量0.16%,泊洛沙姆188 用量1.2%,固液脂质比5 ∶1,均质压力80 MPa,均质次数8 次,考察脂药比对包封率、载药量的影响,结果见图1。由此可知,随着脂质用量增加包封率先升高后趋稳,而载药量先升高后降低,当脂药比大于15 ∶1 后包封率基本不再增加,但载药量逐渐降低,最终确定为15 ∶1。
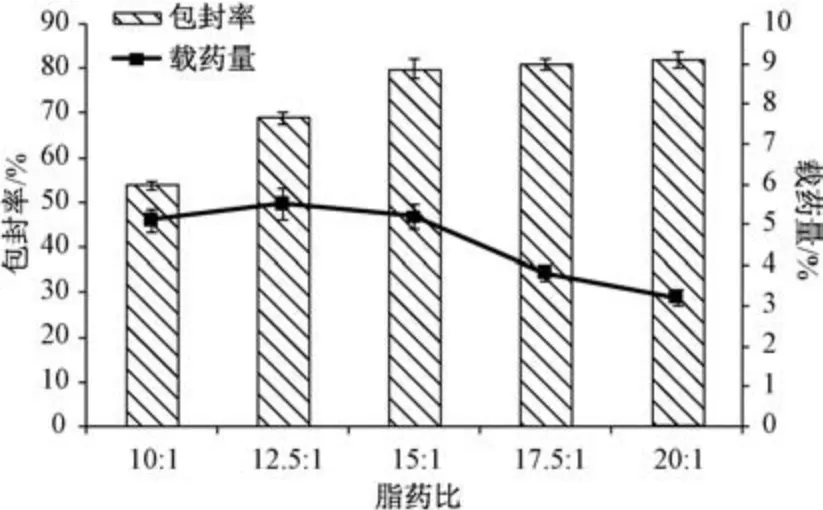
图1 脂药比对包封率、载药量的影响(n=3)Fig.1 Effects of lipid-drug ratio on encapsulation efficiency and drug loading (n=3)
2.4.3 泊洛沙姆188 用量 固定桔皮素用量30 mg,脂药比15 ∶1,Labrasol 用量0.16%,均质压力80 MPa,均质次数8 次,考察泊洛沙姆188用量对包封率、载药量的影响,结果见图2。由此可知,随着泊洛沙姆188 用量增加包封率、载药量先升高后降低,前者用量为1.0%、1.2%时后两者接近,为了降低成本,最终确定为1.0%。

图2 泊洛沙姆188 用量对包封率、载药量的影响(n=3)Fig.2 Effects of poloxamer 188 consumption on encapsulation efficiency and drug loading (n=3)
2.4.4 Labrasol 用量 固定桔皮素用量30 mg,脂药比15 ∶1,泊洛沙姆188 用量1.0%,均质压力80 MPa,均质次数8 次,考察Labrasol 用量对包封率、载药量的影响,结果见图3。由此可知,Labrasol 用量大于0.16% 时包封率、载药量降低,这可能与其增溶作用有关,最终确定为0.16%。
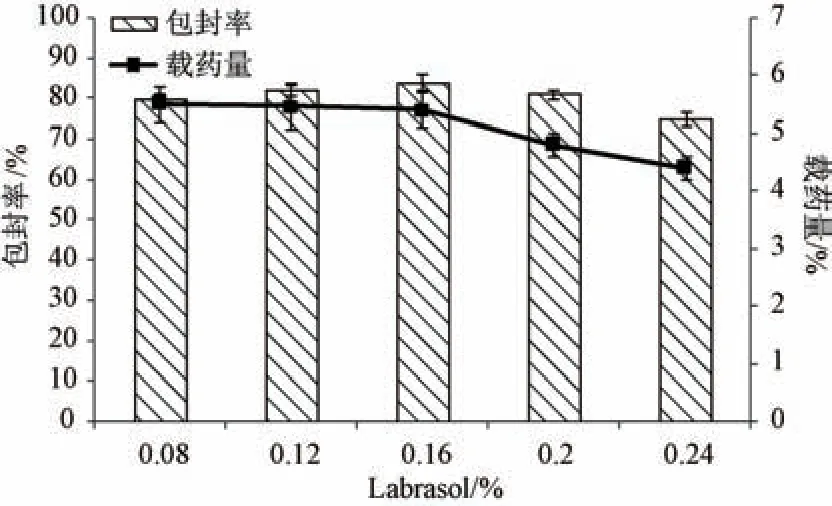
图3 Labrasol 用量对包封率、载药量的影响(n=3)Fig.3 Effects of Labrasol consumption on encapsulation efficiency and drug loading (n=3)
2.4.5 均质压力 固定桔皮素用量30 mg,脂药比15 ∶1,Labrasol 用量0.16%,泊洛沙姆188 用量1.0%,均质次数8 次,考察均质压力对包封率、载药量的影响,结果见图4。由此可知,均质压力小于80 MPa 时对包封率、载药量的影响较小,而大于90 MPa 时两者降低,表明压力过大时会对固体脂质纳米粒产生破坏作用,由于适度压力有利于形成较小粒径[13],最终确定为80 MPa。

图4 均质压力对包封率、载药量的影响(n=3)Fig.4 Effects of homogeneous pressure on encapsulation efficiency and drug loading (n=3)
2.4.6 均质次数 固定桔皮素用量30 mg,脂药比15 ∶1,Labrasol 用量0.16%,泊洛沙姆188 用量1.0%,均质压力80 MPa,考察均质次数对包封率、载药量的影响,结果见图5。由此可知,均质8 次时包封率、载药量降低,为减少过度均质对固体脂质纳米粒的影响,最终确定为6 次。

图5 均质次数对包封率、载药量的影响(n=3)Fig.5 Effects of homogeneous fequency on encapsulation efficiency and drug loading (n=3)
2.5 验证试验 根据“2.4” 项下结果,确定最优处方为桔皮素用量30 mg,脂药比15 ∶ 1,Labrasol 用量0.16%,泊洛沙姆188 用量1.0%,均质压力80 MPa,均质次数6 次。按上述优化处方平行制备3 批样品,按“2.3” 项下方法测得平均包封率为(90.16±1.67)%,载药量为(5.66±0.24)%,粒径为 (189.76±8.92) nm (图6),Zeta 电位为- (36.08±1.72) mV (图7)。

图6 桔皮素固体脂质纳米粒粒径分布Fig.6 Particle size distribution of tangeretin solid lipid nanoparticles

图7 桔皮素固体脂质纳米粒Zeta 电位Fig.7 Zeta potential of tangeretin solid lipid nanoparticles
2.6 形态观察 吸取“2.3” 项下固体脂质纳米粒混悬液 (测定粒径用) 适量,滴到铜网上,1.0%钨酸钠溶液染色,置于30 ℃真空干燥箱中25 min,取出,在透射电镜下观察形态,发现该制剂呈椭圆形或球形,见图8。

图8 桔皮素固体脂质纳米粒透射电镜图Fig.8 Transmission electron microscopy image of tangeretin solid lipid nanoparticles
2.7 冻干粉制备 取固体脂质纳米粒混悬液50 mL,加入4% 乳糖,振荡溶解,由西林瓶底部缓慢加入混悬液 (液面高度约为1.0 cm),在-40 ℃下预冻2 d,立即置于冷冻干燥机中(冷阱温度-35 ℃,真空度0.1 MPa),冷冻干燥2 d,即得,测得其质量分数为0.98%。蒸馏水复溶冻干粉,测得其平均包封率为(81.52±1.28)%,粒径为(214.16±10.56) nm,Zeta 电位为(-33.25±1.89) mV。
2.8 溶解度测定 取过量桔皮素、物理混合物(药物与辅料比例同固体脂质纳米粒冻干粉)、桔皮素固体脂质纳米粒冻干粉适量,置于三角瓶中,加入模拟胃液(含胃蛋白酶),此时底部有药物沉淀,置于37 ℃恒温振荡器中振荡2 d,取上层混悬液,12 500 r/min 离心25 min,取上清液,测定溶解度,同法测定在模拟肠液中的溶解度,结果见表2。由此可知,物理混合物、固体脂质纳米粒冻干粉均可提高原料药溶解度,但后者程度明显大于前者。
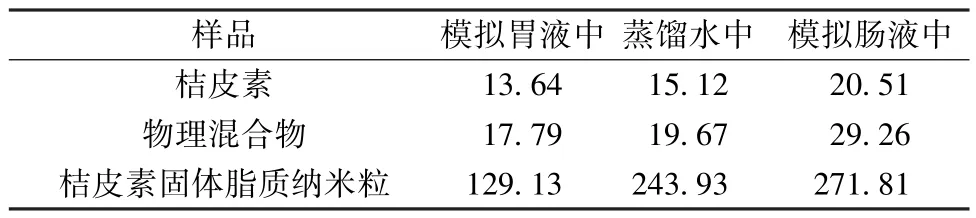
表2 桔皮素溶解度测定结果(μg/mL,n=3)Tab.2 Results of solubility determination of tangeretin(μg/mL,n=3)
2.9 体外释药研究 取桔皮素及其固体脂质纳米粒冻干粉适量(桔皮素含量均为10 mg),加入模拟胃液5 mL (含胃蛋白酶),置于透析袋中(截留分子量10 kDa),两端扎紧,设定转速为75 r/min,介质温度为 (37±1)℃,释放介质为1 000 mL 模拟胃液(含胃蛋白酶),于0、15、30、45、60、75、90、120 min 各取样5 mL,并补加5 mL模拟胃液,0.45 μm 微孔滤膜过滤,测定累积释放度,同法测定在模拟肠液(含胰蛋白酶) 中的累积释放度,取样点调整为0、0.5、1、1.5、2、4、6、8、12 h,结果见图9 ~10。由此可知,原料药在模拟胃液(120 min 内)、模拟肠液(12 h内) 中的累积释放度分别为12.43%、25.17%,而固体脂质纳米粒分别提高至39.79%、74.56%。

图9 模拟胃液中桔皮素体外释药曲线(n=6)Fig.9 In vitro drug release curves for tangeretin in simulated gastric juice (n=6)

图10 模拟肠液中桔皮素体外释药曲线(n=6)Fig.10 In vitro drug release curves for tangeretin in simulated intestinal juice (n=6)
2.10 晶型分析 取桔皮素、空白辅料、物理混合物(原料药与辅料比例同固体脂质纳米粒)、桔皮素固体脂质纳米粒冻干粉适量,置于样品槽中,以氧化铝 (Al2O3) 为参比物,设定升温速度为10 ℃/min,升温范围为30 ~300 ℃,结果见图11。由此可知,原料药在152.1 ℃处出现较大的熔点峰; 物理混合物中该熔点峰提前至138.3 ℃,可能是由于单硬脂酸甘油酯等辅料熔点较低,随着仪器逐渐升温可能溶解原料药,从而对熔点产生影响[17]; 固体脂质纳米粒图谱中仅发现空白辅料,未出现原料药熔点峰,表明它以无定形状态存在。

图11 各样品差示扫描量热图Fig.11 Differential scanning calorimetry patterns for various samples
2.11 稳定性研究 取桔皮素、空白脂质、物理混合物(药物与脂质比例同固体脂质纳米粒)、熔融脂质(含桔皮素)、桔皮素固体脂质纳米粒冻干粉适量,放置0、3、6 个月(温度25 ℃,相对湿度65%) 后进行X 射线粉末衍射分析,结果见图12。由此可知,原料药在6.9、9.4、12.1、14.6、18.8、24.0、27.8、29.5°等处出现特征晶型峰;物理混合物图谱中仍可见上述特征晶型峰; 熔融脂质(含桔皮素) 中未见上述特征晶型峰,表明原料药转变为无定形物质; 固体脂质纳米粒冻干粉在6 个月后仍未见上述特征晶型峰,表明冻干过程未改变原料药无定形状态,稳定性良好。

图12 各样品X 射线粉末衍射图Fig.12 X-ray powder diffraction patterns for various samples
2.12 固体脂质纳米粒(不含Labrasol) 制备 不加Labrasol,按“2.5” 项下最优处方制备,即得,再按 “2.3” 项下方法测得其平均包封率为(92.12±0.96)%,载药量为(5.74±0.22)%,粒径为(263.75±9.11) nm,Zeta 电位为- (33.80±1.14) mV,并按“2.7” 项下方法制成冻干粉。
2.13 体内药动学研究
2.13.1 分组、给药与采血 取桔皮素、物理混合物、桔皮素固体脂质纳米粒(不含Labrasol) 冻干粉、Labrasol+桔皮素固体脂质纳米粒冻干粉、桔皮素固体脂质纳米粒 (含Labrasol) 冻干粉适量,0.5%CMC-Na 溶液制成药液(桔皮素质量浓度均为6 mg/mL)。取30 只大鼠,抛币法随机分为5组,按50 mg/kg 剂量灌胃给药,于0.5、1、2、3、4、5、6、8、12 h 尾静脉取血各约250 μL,滴入含肝素的离心管中,混匀,3 000 r/min 离心3 min,取上层血浆冷冻保存。
2.13.2 血浆样品处理 参考文献[7] 报道,取反式-1,2-二苯乙烯对照品适量,甲醇制成质量浓度为1 800 ng/mL 的内标溶液。取血浆样品100 μL、内标溶液50 μL、乙腈0.5 mL,置于离心管中,涡旋1 min,5 000 r/min 离心10 min,收集上清液,45 ℃水浴中氮气缓慢吹干,100 μL 乙腈复溶。
2.13.3 线性关系考察 取2 μg/mL 对照品溶液适量,甲醇依次稀释至1 000、500、250、100、50 ng/mL,分别取100 μL 至空白离心管中,按“2.13.2” 项下方法处理,加入空白血浆100 μL,涡旋复溶,作为血浆对照品溶液,在“2.1.1” 项色谱条件下进样测定。以对照品质量浓度为横坐标(X),对照品、内标峰面积比值为纵坐标(Y) 进行回归,得方程为Y=0.001 7X+0.249 7 (r=0.996 5),在50 ~2 000 ng/mL 范围内线性关系良好。
2.13.4 方法学考察 取低 (50 ng/mL)、中(1 000 ng/mL)、高(2 000 ng/mL) 质量浓度血浆对照品溶液适量,同一天内在“2.1.1” 项色谱条件下进样测定6 次,测得桔皮素、内标峰面积比值RSD 分别为9.56%、5.78%、8.16%,表明该方法日内精密度良好; 同法连续测定6 d,每天1 次,测得两者峰面积比值RSD 分别为6.28%、4.32%、5.07% (n=6),表明该方法日间精密度良好。取血浆样品适量,室温下于0、2、4、8、12、24 h在“2.1.1” 项色谱条件下进样测定,测得桔皮素、内标峰面积比值RSD 为7.08%,表明样品在24 h 内稳定性良好。空白血浆配制低(50 ng/mL)、中(1 000 ng/mL)、高(2 000 ng/mL) 质量浓度血浆样品,加入内标溶液,按“2.13.2” 项下方法处理,在“2.1.1” 项色谱条件下进样测定,测得桔皮素平均加样回收率分别为 92.77%、96.04%、95.18%,RSD 分别为4.17%、5.06%、4.89% (n=3)。
2.13.5 结果分析 血药浓度-时间曲线见图13,再采用DAS 2.0 软件计算主要药动学参数,结果见表3。由此可知,与原料药比较,物理混合物Cmax、AUC0~t、AUC0~∞升高(P<0.05),可能与Labrasol、泊洛沙姆188 等辅料促吸收作用有关;固体脂质纳米粒(不含Labrasol)、Labrasol+固体脂质纳米粒、固体脂质纳米粒(含Labrasol)tmax、t1/2延长(P<0.05),Cmax、AUC0~t、AUC0~∞升高(P<0.05,P<0.01),其中AUC0~t、AUC0~∞以固体脂质纳米粒(含Labrasol) 更明显(P<0.05),相对生物利用度分别增加至3.13、3.41、4.10 倍,表明在固体脂质纳米粒中引入Labrasol 是必要的。

图13 桔皮素血药浓度-时间曲线(n=6)Fig.13 Plasma concentration-time curves for tangeretin (n=6)
表3 桔皮素主要药动学参数(±s,n=6)Tab.3 Main pharmacokinetic parameters for tangeretin (±s,n=6)

表3 桔皮素主要药动学参数(±s,n=6)Tab.3 Main pharmacokinetic parameters for tangeretin (±s,n=6)
注: 与桔皮素比较,*P<0.05,**P<0.01; 与桔皮素固体脂质纳米粒(不含Labrasol) 比较,#P<0.05; 与Labrasol+桔皮素固体脂质纳米粒比较,△P<0.05。
参数单位桔皮素物理混合物桔皮素固体脂质纳米粒(不含Labrasol)Labrasol+桔皮素固体脂质纳米粒固体脂质纳米粒(含Labrasol)tmaxh2.07±0.352.21±0.452.97±0.68*3.12±0.71*3.09±0.62*t1/2h3.72±0.603.88±0.724.94±0.76*5.04±0.91*5.32±0.89*Cmaxng·mL-1569.74±87.12762.71±107.83* 1 307.45±284.77*1 449.80±302.56**1 653.30±323.18**AUC0~tng·mL-1·h 1 898.43±361.77 2 680.06±436.91* 5 943.61±860.13**6 467.14±965.81**7 788.14±1 024.97**#△AUC0~∞ng·mL-1·h 1 978.24±378.81 2 744.62±487.73* 6 134.29±903.74**6 628.31±999.03**7 926.58±1 106.48**#△
3 讨论
本实验对冷却后含桔皮素的脂质熔融液进行X射线粉末衍射分析,发现药物以无定形状态存在,即并未析出。溶解度实验结果显示,物理混合物在一定程度上提高了桔皮素在模拟胃肠液中的溶解度,可能与Labrasol、泊洛沙姆188 等辅料增溶作用有关; 固体脂质纳米粒冻干粉溶解度提高程度大于物理混合物,可能与原料药粒径大幅减小、转变为无定形状态等因素有关[11,18]。体内药动学研究结果表明,桔皮素固体脂质纳米粒tmax延长,可能是由于原料药在酸性条件下容易发生降解[6],固体脂质纳米粒保护作用、Labrasol 抑制药物降解作用使其入血量增加; 固体脂质纳米粒相对生物利用度升高,可能是由于原料药溶解度、溶出度改善,有利于其吸收[18-20]。
前期报道,Labrasol 辅料可抑制药物降解作用、促吸收作用,有利于增加后者吸收[21]; 无定形药物比结晶型药物更易吸收[19]。本实验发现,Labrasol+桔皮素固体脂质纳米粒生物利用度提高程度低于桔皮素固体脂质纳米粒(含Labrasol),可能是由于Labrasol 是一种表面活性剂,引入固体脂质纳米粒后可使后者粒径更小,更有利于其口服吸收,同时它可更有效地附着在固体脂质纳米粒表面,从而抑制原料药降解[22],增加其口服吸收量。今后,将对桔皮素固体脂质纳米粒(含Labrasol)药效学、毒理学等方面进行评价,以期进一步开发利用该制剂。
