丛枝菌根真菌对红花石蒜植株及根际土壤养分影响
2023-11-22蔡军火姜雪茹魏绪英萨日娜钟良涛
温 婷,吴 靖,蔡军火*,王 琼,姜雪茹,魏绪英,萨日娜,钟良涛
(1.江西农业大学 园林与艺术学院,江西 南昌 330045;2.江西财经大学 艺术学院,江西 南昌 330032)
【研究意义】红花石蒜(Lycoris radiata(L’Herit.)Herb)为石蒜科石蒜属多年生球根花卉,又名彼岸花、龙爪花等,素有“中国的郁金香”之美誉[1-2],具自发的“夏眠”特性[3],观赏价值极高[4],同时还是国际市场紧俏的药用植物[5]。因其花期难以有效调控,在世界切花产业中至今“默默无闻”[6]。【前人研究进展】氮、磷、钾等大量元素虽是石蒜等药用植物生长发育的必需元素[7],但近年来研究人员对石蒜属植物进行的人工施肥(N、P、K 等)效益均不明显[8-11]。丛枝菌根真菌(AMF)是一类广泛分布于陆地生态系统土壤中的有益微生物,能够与世界上80%~90%的被子植物形成一种最典型的内生菌根,从而形成互惠共生体[12]。接种丛枝菌根真菌(AMF)可以改善土壤肥力,被称之为“生物肥料”[13],可促进宿主植物对土壤中矿质元素的吸收并提高其对土壤中氮、磷、钾元素的利用率,以促进其生长发育[14-16]。【本研究切入点】目前,有关红花石蒜接种丛枝菌根真菌方面的研究鲜见报道。本文以红花石蒜为研究对象,采用AMF 的单接和混合双接两种方式,重点关注接种AMF 后红花石蒜根际土壤内的养分变化及植株不同器官对N、P、K 的吸收情况。【拟解决的关键问题】旨在为红花石蒜的人工培育筛选适宜的有益共生菌,为其产业化生产提供新的思路和方法。
1 材料与方法
1.1 供试植物及菌种
本试验供试的红花石蒜种球(直径(2.6±0.2)cm,种球健康无病,大小均匀一致)采集于江西农业大学花卉盆景实训基地(28°76′N,115°83′E),所用菌剂摩西斗管囊霉(Funneliformis mosseae)和根内根孢囊霉(Rhizophagus intraradices)均购于长江大学根系生物学研究所。石蒜种植前,取健康无病、大小均一的红花石蒜种球,去除其褐色外表皮,用50%多菌灵可湿性粉剂800 倍液浸泡15 min,用超纯水冲洗晾干备用。
2021 年5 月中旬接种,先在种植容器中添加灭菌基质至其体积的2∕3 处,接菌组每盆接种30 g 菌剂(约600 个孢子量),其中FM+RI 组中每菌种孢子量各约为300 个,CK 组等量加入经灭菌处理的接种剂,再栽入红花石蒜植株1株,使根系与菌种充分接触,后覆盖上3~5 cm的灭菌基质。
1.2 供试基质及容器
栽培基质为典型的红壤土(采集后风干、碾粹后过2 mm 筛)、新鲜河沙(水洗后过2 mm 筛)、泥炭土按体积1∶1∶1 比例混合,经高温高压(121 ℃、0.1 MPa)蒸汽灭菌2 h,自然冷却后备用。该基质的有机质含量为61.32 g∕kg,pH 为5.46,全N、全P、全K 含量为1.40,0.58,2.88 mg∕g。盆栽容器规格(口径×底径×高)为130 mm×95 mm×200 mm,使用前用体积分数为75%酒精消毒。
1.3 试验设计
采用单因素试验设计,设3 个接菌处理组(摩西斗管囊霉处理组“FM”、根内根孢囊霉处理组“RI”和混合双接菌种处理组“FM+RI”)和1 个对照组(CK),共计4 个处理组,每个处理设20 个重复(即20 株,1株∕盆),每个重复种植红花石蒜1株(即1粒种球∕盆),共计80株。
盆栽试验于2021年5月中旬至次年2月中旬在人工气候箱中进行。气候箱的温度设置为25 ℃(昼)∕20 ℃(夜),光照强度为10 000 lx(昼)∕0 lx(夜),昼夜间隔12 h,相对湿度为40%~80%,生长期间按常规管理。
分别于8月16日(展叶期)、9月11日(叶旺长期)、11月16日(叶成熟期)和2月15日(叶黄枯期)收获根际土壤和植株的鲜根、叶片、鳞茎和根系,其中根际土经自然风干后研磨过筛(0.149 mm),用于测定养分含量;叶片、鳞茎和根系用烘箱80 ℃烘干备用,鲜根用超纯水洗净擦拭后保存于-80 ℃冰箱,用于根系侵染率的测定。
1.4 测定项目与方法
1.4.1 AMF侵染率 根系菌根侵染率采用改良后的醋酸墨水法染色和十字交叉法镜检。
1.4.2 植物和根际土壤营养成分的测定 全N、全P 和全K 的测定参照《土壤农化分析》[17]的常规方法进行测定。
1.5 数据处理与分析
利用Excel 2016 进行数据整理,采用SPSS26.0 对测定的数据进行统计分析,对结果进行单因素方差多重比较分析(Duncan 检验),对根际土壤及植株各部位养分含量等指标进行主成分分析,用Origin2021 绘图。
2 结果与分析
2.1 不同接种处理不同时期红花石蒜根系AMF侵染的比较
在显微镜下观察不同接菌处理后的红花石蒜真菌根系侵染情况(图1a~f)。结果表明,3种不同AMF接种处理后,在红花石蒜根系均能明显观察到AMF 的菌丝和泡囊结构。说明以上3 种外源AMF 接种处理,根系真菌发育均较好,够与红花石蒜根系形成菌根共生体。
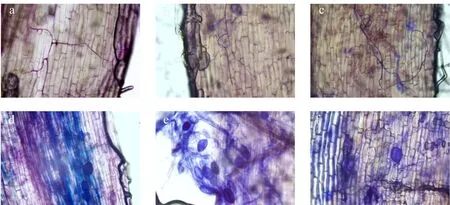
图1 展叶期丛枝菌根真菌侵染红花石蒜情况Fig.1 Infection of arbuscular mycorrhizal fungi to Lycoris radiata during leaf expansion
由图2 可知,加入了灭菌接种物的CK 组的红花石蒜根系在4 个不同生长时期的真菌感染率均为0,说明其未被侵染;而3 个AMF 处理组的根系在各个时期均有一定程度的真菌侵染(前期侵染率可达50%,后期则保持在80%以上),其根系侵染率均显著高于CK。其中在生长前期(展叶期)的根系侵染率以RI 组最高,显著高于FM 和FM+RI 组;至生长后期(叶黄枯期),RI 组和FM+RI 组无显著差异,但二者均显著高于FM 组。这表明,从侵染速度和最终侵染率看,以RI 接菌组对红花石蒜根系的真菌侵染效率最高。
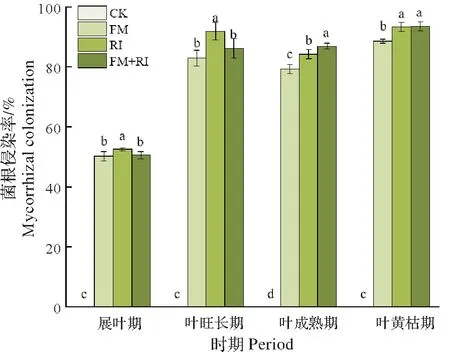
图2 不同接种方式下红花石蒜的根系侵染率比较Fig.2 Root infection rate of Lycoris radiata under different inoculation methods
2.2 不同接种处理不同时期红花石蒜根际土壤养分的比较
2.2.1 不同接种处理红花石蒜根际土壤全N 含量的比较 由图3 可知,CK 组的根际土壤中全N 含量在红花石蒜的叶片生长过程中呈持续下降趋势,至叶黄枯期降幅更大。与CK 相比,FM 组的土壤全N 含量却在叶旺长期有显著增加,RI 组与FM+RI 组的土壤全N 含量也均在叶成熟期显著增加。尽管在展叶期和叶黄枯期,3个AMF 处理组的根际土壤全N 含量均明显高于CK,但差异不显著。由此可见,接种AMF真菌可以在一定程度上提高红花石蒜根系的土壤全N 含量,其中在叶旺长期以FM 处理的效果最佳(P<0.05),而在展叶期、叶成熟期和叶黄枯期均以FM+RI组的效果更好。

图3 不同接种方式下红花石蒜根际土壤全N含量Fig.3 Total nitrogen content in rhizosphere soil of Lycoris radiata under different inoculation methods
2.2.2 不同接种处理红花石蒜根际土壤全P含量的比较 由图4可知,与CK 相比,3种不同的AMF接种处理对4 个不同生长期红花石蒜的根际土壤的全P 含量的提高均有显著促进效应。其中以FM+RI 组的促进效果最好,根际土壤的全P 含量在展叶期、叶旺长期、叶成熟期和叶黄枯期分别较CK 组增加了19.15%、27.91%、15.22%和20.00%。

图4 不同接种方式下红花石蒜根际土壤全P含量Fig.4 Total phosphorus content in rhizosphere soil of Lycoris radiata under different inoculation methods
2.2.3 不同接种处理红花石蒜根际土壤全K含量的比较 如图5所示,与CK相比,3种不同的AMF接种处理虽在全生长期对红花石蒜的根际土壤全K 含量的提高均有一定促进效应,但仅在展叶期有显著差异。在展叶期和叶旺长期以RI 组的促进效应最佳,在叶成熟期以FM 组的效果最好;在叶黄枯期,则以FM+RI组的促进效果最佳。

图5 不同接种方式下红花石蒜根际土壤全K含量Fig.5 Total potassium content in rhizosphere soil of Lycoris radiata under different inoculation methods
综上所述,接种AMF对红花石蒜的不同生长时期的根际土壤养分含量均有一定的促进影响,总体表现于前期(展叶期)对根际土壤中的“K”、中期对“N”、全生长期对“P”元素的富积有显著促进效应。这表明接种AMF真菌可以改善红花石蒜根际土壤的微环境,促进根际土壤中矿物质的活化,提升红花石蒜根际土壤的养分含量。
2.3 不同接种处理对红花石蒜植株养分含量的影响
2.3.1 不同接种处理对红花石蒜植株全N 含量的影响 由图6 可知,不论接种与否,红花石蒜叶片全N含量在其生长过程中呈持续下降趋势,鳞茎和根系也有同样的表现,各时期不同处理石蒜植株的全N含量平均值分别为74.07(展叶期)、60.42(叶旺长期)、50.55(叶成熟期)及44.43(叶黄枯期),即红花石蒜各部位及植株整体的全氮含量由高到低均表现为展叶期、叶旺长期、叶成熟期、叶黄枯期。接菌对红花石蒜植株全N 含量分布无影响,4 个处理全N 含量在各器官分布由高到低均表现为叶片、根系、鳞茎。接菌处理能显著促进红花石蒜植株全N 含量,对不同部位促进效果不同。
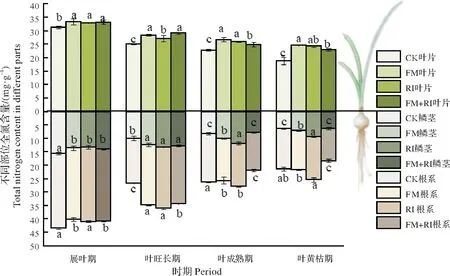
图6 不同接种处理红花石蒜不同部位全N含量的比较Fig.6 Comparison of total nitrogen content in different parts of Lycoris radiata under different inoculation treatments
接种AMF 可以显著提高红花石蒜叶片的全N 含量,且随着生长时期的推移其改善效果更明显(与CK 组差异更大)。其中以FM 组促进效果最好,其叶片全N 含量在展叶期、叶旺长期、叶成熟期以及叶黄枯期分别较CK 增加了6.73%、13.06%、17.45%和30.44%。除展叶期,接菌后的鳞茎全N 含量在各时期均有显著提高,且以RI 组促进效果最好,其鳞茎全N 含量在叶旺长期、叶成熟期以及叶黄枯期分别较CK 增加了32.80%、44.92%和49.92%。AMF 对根系的全N 含量的改善效果也以RI 组最佳,且3 种处理改善效果主要表现在叶旺长期,该时期FM 组、RI 组和FM+RI 组较CK 组提高幅度分别为34.63%、36.36%和28.71%。
2.3.2 不同接种处理对红花石蒜植株全P含量的影响 由图7可知,红花石蒜叶片全P含量在生长过程中呈持续下降趋势,鳞茎和根系也有同样的表现(除AMF处理组鳞茎全P含量在叶旺长期有所上升),各时期不同处理石蒜植株的全P 含量平均值分别为13.15(展叶期)、10.82(叶旺长期)、7.59(叶成熟期)及6.62(叶黄枯期),即红花石蒜各部位及植株整体的全磷含量由高到低表现为展叶期、叶旺长期、叶成熟期、叶黄枯期。接菌对全P在红花石蒜植株体内分布情况无影响,4个处理全P含量在各器官分布由高到低均表现为叶片、根系、鳞茎。接菌处理对红花石蒜植株全P 含量有促进作用,且对不同部位促进效果不同,与其他部位相比,对鳞茎的全P含量改善效果最明显。

图7 不同接种处理红花石蒜不同部位全P含量的比较Fig.7 Comparison of total phosphorus content in different parts of Lycoris radiata under different inoculation treatments
接种AMF可以提高红花石蒜叶片的全P含量,以RI组效果最好,但涨幅不大(与CK相比不超过8.5%)。接种AMF对鳞茎全P含量影响更大,除展叶期,其他时期鳞茎全P含量均有显著提高,整体上也以 RI组改善效果最好,其鳞茎全P 含量在叶旺长期、叶成熟期以及叶黄枯期分别较CK 增加了30.69%、15.97%和35.42%。除叶成熟期,其他时期AMF对根系的全P含量均有改善效果,叶旺长期与叶黄枯期以RI组的效果最好,根系全P含量在展叶期、叶旺长期以及叶黄枯期分别较CK增加了9.01%、8.33%和18.13%。
2.3.3 不同接种处理对红花石蒜植株全K 含量的影响 由图8 可知,在叶片生长过程中,各处理组红花石蒜鳞茎全K 含量呈下降趋势,而叶片和根系的全K 含量在枯黄期有所上升。各时期不同处理石蒜植株的全K 含量平均值分别为33.67(展叶期)、31.60(叶旺长期)、22.64(叶成熟期)及25.32(叶黄枯期),即红花石蒜植株整体的全K 含量由高到低表现为展叶期、叶旺长期、叶黄枯期、叶成熟期。接菌对红花石蒜全K 含量的分布无影响,即无论接菌与否,全K 含量在不同器官中分布由高到低均表现为根系、叶片、鳞茎。接菌处理对红花石蒜植株全K含量有促进作用,且对不同部位促进效果不同。

图8 不同接种处理红花石蒜不同部位全K含量的比较Fig.8 Comparison of total potassium content in different parts of Lycoris radiata under different inoculation treatments
接种AMF 可以在叶旺长期提高红花石蒜叶片的全K 含量,该时期FM 组、RI 组和FM+RI 组较CK 组提高幅度分别为11.75%、15.36%和5.64%,其他时期无明显改善作用。AMF对鳞茎全K的改善效果主要表现在叶旺长期和叶成熟期,且以RI 组的效果最佳,RI 组红花石蒜鳞茎全K 含量在叶旺长期和叶成熟期分别较CK 增加了17.04%和13.53%。AMF 对根系的全K 含量的改善效果主要表现在生长前期(展叶期和叶旺长期),此时3个AMF处理组根系的全K含量较CK均有所提升,而在叶成熟期仅RI组根系全K含量较CK有所增加(增加了12.97%),叶黄枯期AMF处理组根系全K含量均显著低于对照组。
综上,整体上各处理组各营养器官中的养分含量均呈现逐渐下降的趋势,展叶期红花石蒜各营养器官中的全N、全P 和全K 含量均最高,随着叶片的生长,呈现逐渐下降的趋势。AMF 处理组和对照组红花石蒜不同器官对氮磷钾养分的吸收状况不同,但都表现出一致性,由好到差为氮素、钾素、磷素。氮和磷在不同器官的分布由高到低均表现为叶片、根系、鳞茎,而钾由高到低表现为根系、叶片、鳞茎。试验结果表明,接种AMF 能够在一定程度上促进红花石蒜不同部位对氮磷钾养分的吸收,尤其是对氮的吸收,总体表现为在叶片生长前期对根系的作用效果更好,而生长后期对鳞茎的作用效果更好。其中FM 组对叶片全N、全K 含量改善效果最佳;RI 组对叶片全P、鳞茎全N、全P、全K、根系全N、全P 改善效果最佳;FM+RI 组对根系全K 改善效果最佳。综合来看,RI 组对红花石蒜植株体内养分含量影响最大。
2.4 不同接种处理对红花石蒜的作用分析
为客观而全面地反映不同接种处理对红花石蒜植株及根际土壤养分的影响,分别将红花石蒜根际土壤、叶片、鳞茎、根系各部分氮磷钾含量作为自变量,对不同接种处理的红花石蒜养分进行主成分分析,结果见表1。其中提取了3个特征值大于1的主成分,累计方差贡献率达84.18%,能够较为准确的反映红花石蒜对养分的吸收情况。
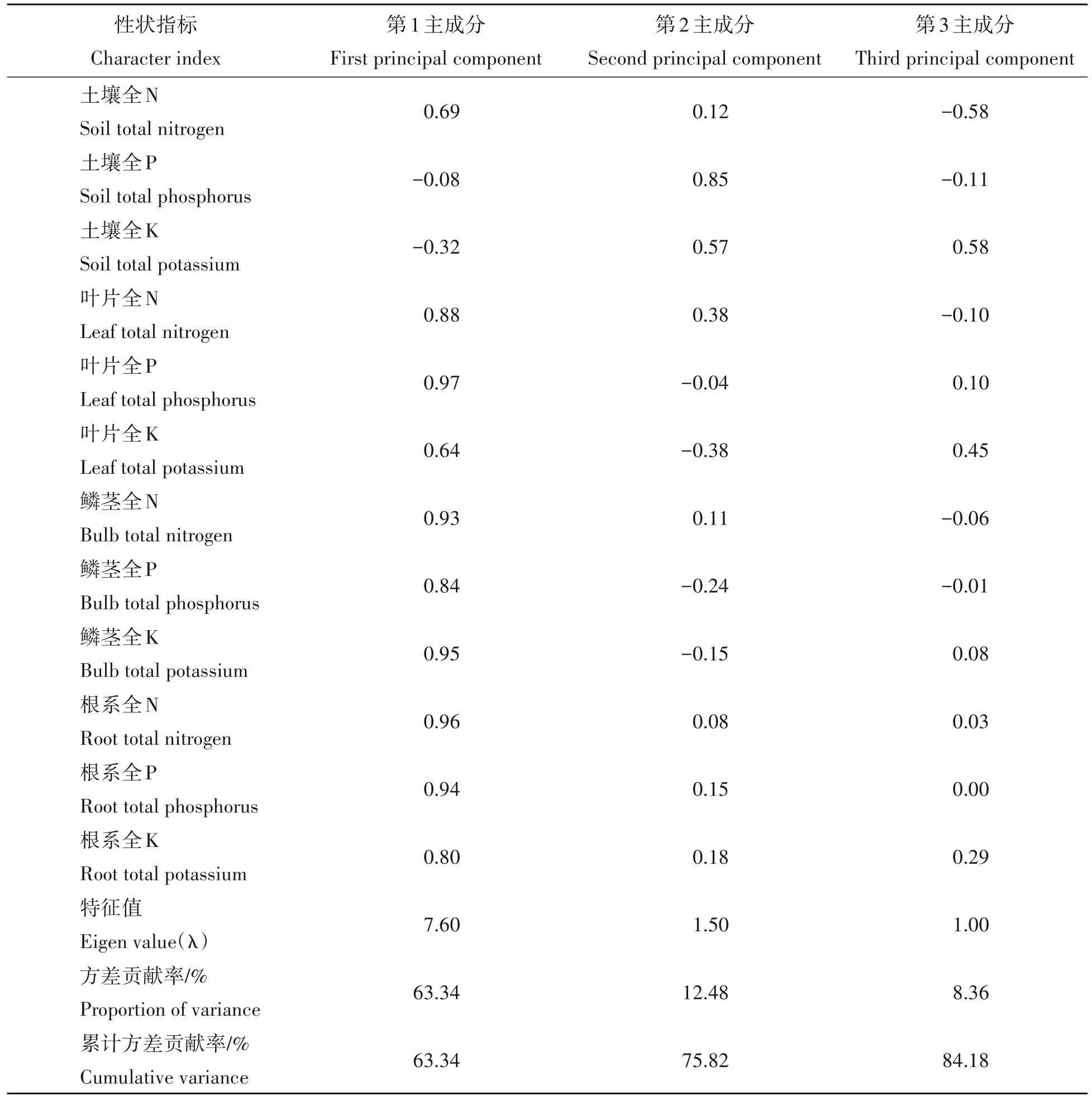
表1 红花石蒜主成分分析Tab.1 Analysis of the main components of Lycoris radiata
将相关的数据标准化,根据3 个主成分的贡献率和隶属函数模型,计算出不同处理养分吸收情况的综合得分并进行排序。综合得分越高,表明红花石蒜植株对养分的吸收效果更好,综合得分排序见表2。结果表明,接菌处理均优于CK 组,其中RI得分最高,对红花石蒜养分吸收促进效果最好,其次为FM,单一接种优于混合接种。
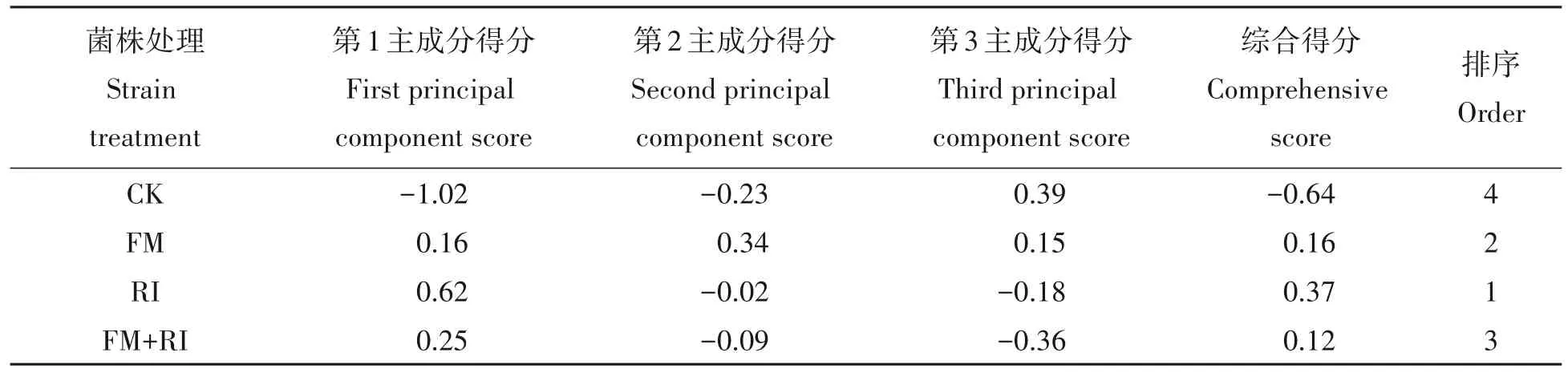
表2 红花石蒜主成分得分及综合得分Tab.2 Principal component score and overall score of Lycoris radiata
3 讨论与结论
3.1 不同接种处理对红花石蒜不同时期根系AMF侵染的影响
菌根侵染率与植物和丛枝菌根真菌的亲和力相关[18]。除展叶期,红花石蒜各生长时期的菌根侵染率都超过70%,说明本试验所选AMF 真菌与红花石蒜之间的亲和程度较高。已有研究表明,不同种类的菌根接种体和植物形成的共生体对土壤的反馈作用是不同的,即不同菌种对植物的亲和力存在差异[19]。本试验结果显示不同菌剂处理下的红花石蒜菌根侵染率各不相同,其中根内根孢囊霉(RI)对红花石蒜根系的侵染率高于摩西斗管囊霉(FM),说明根内根孢囊霉对红花石蒜的亲和力高于摩西斗管囊霉。
3.2 不同接种处理对红花石蒜不同时期根际土壤养分的影响
氮、磷和钾是植物在生长过程中必不可少的 3 大营养元素,其含量是影响土壤质量的重要指标,接种 AMF 对土壤中氮、磷和钾的含量有显著影响,可改善土壤微环境,促进土壤中矿物养分的活化,提高土壤肥力[12-14]。本试验结果显示接种AMF 对红花石蒜叶成熟期的根际土壤养分影响效益最为明显,其中对土壤中全P 含量的影响最大,这与刘欢[20]的研究结果相悖,可能是由于接菌后微生物分泌的有机酸和酶类促进了土壤养分的释放,同时促进了植物的生理代谢及植株的生长发育,蒸腾作用增强,促进了土壤中养分的活化运移和在根际的富集[21],又或是可以考虑由于种植石蒜时未曾进行断根操作,随时间的推移地下部分老根的腐烂凋落导致土壤中营养元素的增加。此外接种不同的AMF 对红花石蒜根际土壤N、P、K 营养元素含量改善效果有所差异,例如在叶成熟期,接种FM 处理,红花石蒜根际土壤全P 和全K 含量显著高于CK 组;接种RI 处理,红花石蒜根际土壤全P 含量显著高于CK 组;接种FM+RI 处理,红花石蒜根际土壤的全N 全P 含量显著高于CK 组。因此,接种AMF 真菌在一定程度上提高了人工栽培红花石蒜土壤的肥力,且总体上FM+RI 混合接菌处理能够更有效调控红花石蒜根际土壤微生态环境。
3.3 不同接种处理对不同时期红花石蒜植株养分含量的影响
丛枝菌根真菌与植物形成菌根共生体后,通过扩大其根系吸收面积,显著影响植物对氮、磷、钾等养分的吸收[22]。本研究发现,不同丛枝菌根接种下的红花石蒜与未接种之间的养分含量差异较大,接菌处理可以显著提高红花石蒜植株在不同时期根系、鳞茎和叶片中的养分含量,这与Ma 等[23]结果一致。
本研究表明,红花石蒜各营养器官中的氮磷钾养分质量分数均在展叶期最高,随着叶片的生长,整体上呈现逐渐下降的趋势,根系中的氮和磷在叶黄枯期质量分数最低,钾在叶成熟期最低;鳞茎中的氮磷钾在叶黄枯期均处于最低水平;叶片中的氮磷钾和根系变化规律基本一致。这一结果与鲍淳松等[24]对长筒石蒜的生物量构成和养分质量分数季节动态的研究结果基本一致。这是因为在展叶期各器官中贮存的氮磷钾养分较充足,含量都最高;同时由于石蒜的内循环机制,鳞茎为“源”,干物质和养分一直减少,进入快速生长期(叶旺长期),叶片的形态建成需要大量养分,随着叶片数量的增加以及伸长生长,叶片所需要的养分远大于根系吸收的养分,因此各部位中氮磷钾元素逐渐稀释,养分含量下降[25]。这符合“源库关系”理论:母球在整个生育期中,一直作为“源”为根系、子球和地上部分等作为库的器官提供养分,尤其是生长初期,养分几乎全部来自于母球供应[26]。
在叶旺长期,不同AMF 接种处理下红花石蒜各部位氮磷钾含量均有所增加,说明AMF 接种处理能促进红花石蒜在叶旺长期对氮磷钾养分的吸收。且在叶旺长期AMF 对红花石蒜吸收养分的促进效果最大,可能是因为叶旺长期正处于地上部分叶片生长速度最快,生物量最大的时候,而地上部分和地下部分的生长节律基本一致[27];随着根系生长,加大对养分的吸收面积,AMF 促进效果更明显。
在叶成熟期和叶黄枯期,AMF处理组红花石蒜根系中的氮磷钾含量与处理组差异不大或更低,而鳞茎与叶片中,尤其是鳞茎中的氮磷钾含量普遍高于对照组。这可能是因为红花石蒜随着光合作用的进行,其叶片逐渐变为“碳源”,多余的养分被鳞茎吸收[24];有研究表明丛枝菌根可以促进植物的光合作用[28-29],猜测接种AMF也能够促进红花石蒜叶片的光合作用,因此经AMF处理后的鳞茎能够吸收到的养分更多。在叶黄枯期除叶片和根系中的全K 含量略微增加外(与叶成熟期相比),不存在其他器官的养分含量的增加,这与落叶期养分转移的生态策略[30],植株落叶时会将器官中的养分转移以供新器官的建成观点相悖,可能是由于在恒温培养条件下叶黄枯期时仍有新叶冒出,叶片枯黄后把营养元素转移到新叶中,故养分仍存在于叶片中供给新叶的形态建成。
此外,通过比较不同试验组红花石蒜不同部位间的养分含量差异,发现接菌与否对各器官中养分分布表现没有明显影响,不同器官对氮磷钾养分的吸收状况虽然不同,但都表现出一致性,即氮素>钾素>磷素。这与夏文通等[31]和Hertogh 等[26]的研究结果一致。王庆仁等[32]研究发现,在酸性条件下,土壤中的铁、铝会与磷之间相互结合形成难溶的物质,从而影响植物对于磷素的吸收。同时磷在土壤中的有效性较低,这可能是本研究中红花石蒜中磷元素含量低的原因。氮和磷在不同器官中分布由高到低均表现为叶片、根系、鳞茎,而钾由高到低表现为根系、叶片、鳞茎。这与骆娟等[33]对5 种滨海沙生植物氮磷钾化学计量特征分析、常双双[34]对5种丛枝菌根真菌对君迀子幼苗生长的影响研究结果一致。鳞茎中的养分含量在各器官中的分布都处于最低水平,这是因为石蒜属植物具有非常发达的内循环机制,其中鳞茎是一个养分、碳和水的存储库,在叶片生长期,鳞茎中的N、P、K 因提供养分和碳“源”而逐渐减少[24]。
3.4 结论
综上所述,AMF 能与红花石蒜形成较好的共生关系,接种AMF 真菌可以提高红花石蒜根际土壤养分含量,增强土壤肥力,改善红花石蒜对营养元素的吸收,从而促进红花石蒜的生长发育,增强其对外界生态环境适应能力。AMF 在不同时期对红花石蒜的作用效果不同,在叶片生长前期,因根系需要从土壤中吸取更多的养分以供应叶片生长,此时表现为AMF 对根系的作用效果更好;而生长后期随着叶片逐渐变为“碳源”,多余的养分被鳞茎吸收,此时表现为AMF 对石蒜鳞茎的作用效果更好。从综合接种效应来看,RI 对红花石蒜的亲和力高于FM,且AMF 组对红花石蒜养分含量的改善效果由好到差依次表现为RI 组>FM 组>FM+RI组,可考虑将RI用于红花石蒜的产业化生产中。
