江西省浙江红山茶及近缘种群体遗传多样性的SSR分析
2023-11-22黄建建汤优令周文才汪雁楠田仟仟舒惠理
黄 彬,黄建建,汤优令,周文才,汪雁楠,田仟仟,龚 春,舒惠理,温 强*
(1.江西省林业科学院 江西省油茶种质资源保护与利用重点实验室,江西 南昌 330013;2.江西省安义县园林技术推广中心,江西 南昌 330500)
【研究意义】浙江红山茶(2n=30)(Camellia chekiangoleosaHu.),亦称为浙江红花油茶、红花油茶。作为茶花和普通油茶的近缘种,浙江红山茶兼具优良的观赏和油用价值[1-2],是我国南方山区特有的油茶树种[3]。江西是浙江红山茶的主要分布区之一[4],境内诸多市县均有该树种的天然分布,其中“中国红花油茶”之乡上饶德兴市种植面积约2 660 hm2,丰富的资源为该树种的品种选育奠定了重要的物质基础。另外,浙江红山茶在江西境内还存在较易混淆的近缘种如厚叶红山茶(C.crassissima)与全缘红山茶(C.subintegra)等,而前者在现行的两套山茶属分类系统[3,5]中能否与浙江红山茶归并为一种尚存争议。混淆种的存在,也给浙江红山茶资源的开发利用造成了一定困扰。群体遗传多样性研究能使人们充分发现和保护群体中各种基因和基因型资源,乃至挖掘重要经济性状的变异并加以科学利用[6]。因此,有针对性的在江西省内开展浙江红山茶及其近缘种的遗传多样性研究,可为该树种资源的保护与利用提供重要的理论基础。【前人研究进展】前人调查发现,浙江红山茶天然分布于浙江南部、安徽南部、江西东北部、湖南南部和福建北部五省交界的海拔600~1 400 m的山地[7],分布狭窄且碎片化,属于狭域种。目前浙江红山茶遗传多样性研究还相对较少。在区域一级层面,仅见宋倩倩等[8]利用相同的标记工具研究了福建省的13 个浙江红山茶群体的遗传多样性;而在较大尺度范围,Xie 等[9]通过ISSR 分子标记对浙江、江西、福建、安徽共7个浙江红山茶群体进行了遗传多样性分析,笔者所在团队近期也完成了浙江、江西、福建、湖南12 个浙江红山茶群体的遗传结构的SSR 分析[10],但后两者的研究均仅在江西采集了2 个代表群体,无法全面反映江西省内的浙江红山茶遗传多样性。【本研究切入点】基于此,作为浙江红山茶的主分布区,在江西全境内开展该物种及近缘种的遗传多样性研究,是全面揭示浙江红山茶遗传多样性的有利补充。【拟解决的关键问题】本研究拟针对江西省内浙江红山茶及其近缘种的资源分布现状,采用共显性SSR 标记研究浙江红山茶及其近缘种的群体遗传结构,为有效的区分浙江红山茶及其近缘种提供分子证据,同时也为在更小尺度下揭示浙江红山茶群体多层次的遗传变异,为合理的开发与利用该树种资源提供理论参考。
1 材料与方法
1.1 试验材料
供试材料来自江西省内现存浙江红山茶、全缘红山茶和厚叶红山茶天然群体,基本覆盖了3 个物种在江西省境内的主要分布区(图1)。样本间按间隔30 m 进行取样,共采集11 个群体(8 个浙江红山茶群体、2 个全缘红山茶群体和1 个厚叶红山茶群体)305 份样本(表1),采摘幼嫩叶片、叶芽或花苞并迅速置于装有硅胶干燥剂(硅胶与样本10∶1,w∕w)的密封袋带回实验室,保存于-80 ℃超低温冰箱。

图1 11个群体样本分布情况Fig.1 Distribution of 11 population samples

表1 11个群体样本采集地点概况Tab.1 Overview of sample collection sites of 11 populations
1.2 DNA的提取及PCR扩增
采用改良CTAB[1]法提取DNA,用10 g∕L 的琼脂糖凝胶电泳检测DNA 质量,Nanodrop2000(Thermo Scientific,USA)检测DNA的浓度和纯度,最后将DNA浓度稀释至100 ng∕µL,于-20 ℃保存备用。
选取19 对SSR 引物(表2)进行SSR-PCR 扩增,10 µL SSR-PCR 扩增体系:10×Buffer 1.0 µL,Mg2+(25 mmol∕L)1.0 µL,dNTPs(10 mmol∕L)1.0 µL,10 µmol∕L 的Primer-F、Primer-R 各0.4 µL,Taq酶(5 U∕µL)0.1 µL,DNA 模板(100 ng∕µL)0.5 µL,加灭菌ddH2O 补齐到10 µL。PCR 扩增程序为:94 ℃预变性5 min;94 ℃变性30 s,57~60 ℃(因不同引物而异)退火30 s,72 ℃延伸30 s,共25 个循环;最后72 ℃延伸1 min,4 ℃保存。PCR 扩增产物用8%变性聚丙烯酰胺凝胶电泳检测,银染显色,并拍照记录。

表2 19对多态性EST-SSR引物信息Tab.2 Information on 19 polymorphic EST-SSR primers
1.3 数据分析
PCR 扩增产物电泳结果按基因型数据进行数据读取,并利用GenAlex 6.4软件[11]进行数据格式转换,同时计算各群体的固定指数(F),绘制基于Nei’s 遗传距离的主成分分析图(PCoA)。采用POPGENE 32软件[12]检测群体的Hardy-Weinberg(HWE)平衡并计算以下遗传多样性参数:平均等位基因数(A)、观察等位基因数(Na)、有效等位基因数(Ne),观察杂合度(Ho)、期望杂合度(He)、Shannon信息指数(I)、基因流(Nm)、近交系数(FIS)和遗传分化系数(FST)等F 统计变量。由Power Marker V3.25 软件[13]计算SSR 标记的多态性信息含量(polymorphism information content,PIC),采用MEGA 5.0软件[14]利用非加权类平均法(unweighted pair-group method using arithemtic average,UPGMA)进行群体聚类分析并生成遗传聚类图。利用Excel软件基于群体遗传分化(Fst)矩阵和地理空间距离矩阵进行Mantel相关性检验。利用Arlequin v3.1 软件[15]对群体内与群体间的遗传变异进行AMOVA 分子方差分析。将厚叶红山茶与浙江红山茶进行种的归并后的9个群体遗传结构分析由STRUCTURE软件[16]完成,设置K得取值范围为2~10,将MCMC(Markov Chain Monie Carfo)以及不作数迭代(length of burn-in period)的值都设为100 000次,重复运行次数为10。最佳K值通过在线网址Structure Harvester[17](http:∕∕taylor0.biology.Ucla.edu∕structharvest∕)计算获得,完成群体遗传结构图的绘制。
2 结果与分析
2.1 SSR位点的遗传多样性
对8 个浙江红山茶和1 个厚叶红山茶群体的19 个SSR 位点进行多样性分析发现(表3):共检测出154 个等位基因,平均每个位点检测到8.105 个等位基因(Na)和4.557 个有效等位基因(Ne),平均多态信息含量(PIC)为0.721;其中,引物CC_eSSR49 的有效等位基因数(6.658)和PIC 值(0.832)均最高,引物CC_eSSR486 的有效等位基因数(1.600)和PIC 值(0.333)为最低。有18 对引物的PIC 值>0.5,占比94.74%,显示绝大部分引物具有中或高多态性。Shannon’s 信息指数(I)在0.707~1.997 变化,平均值为1.650,观察杂合度(Ho)和期望杂合度(He)的取值范围分别是0.307~0.682 和0.375~0.850。
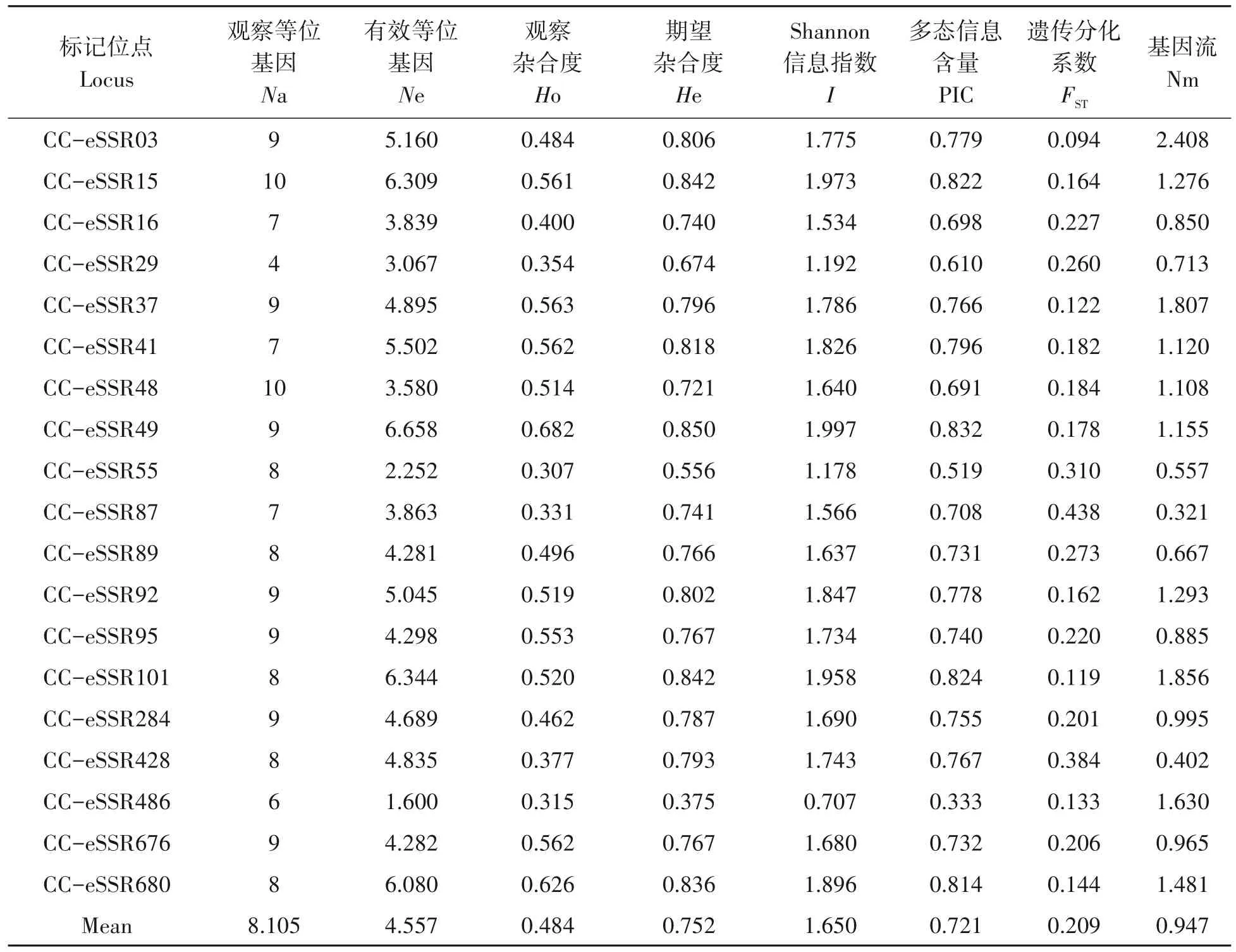
表3 基于9个群体的SSR位点的遗传参数统计Tab.3 Genetic polymorphism of SSR loci in the populations of C.chekiangoleosa
2.2 浙江红山茶及其近缘种的遗传多样性
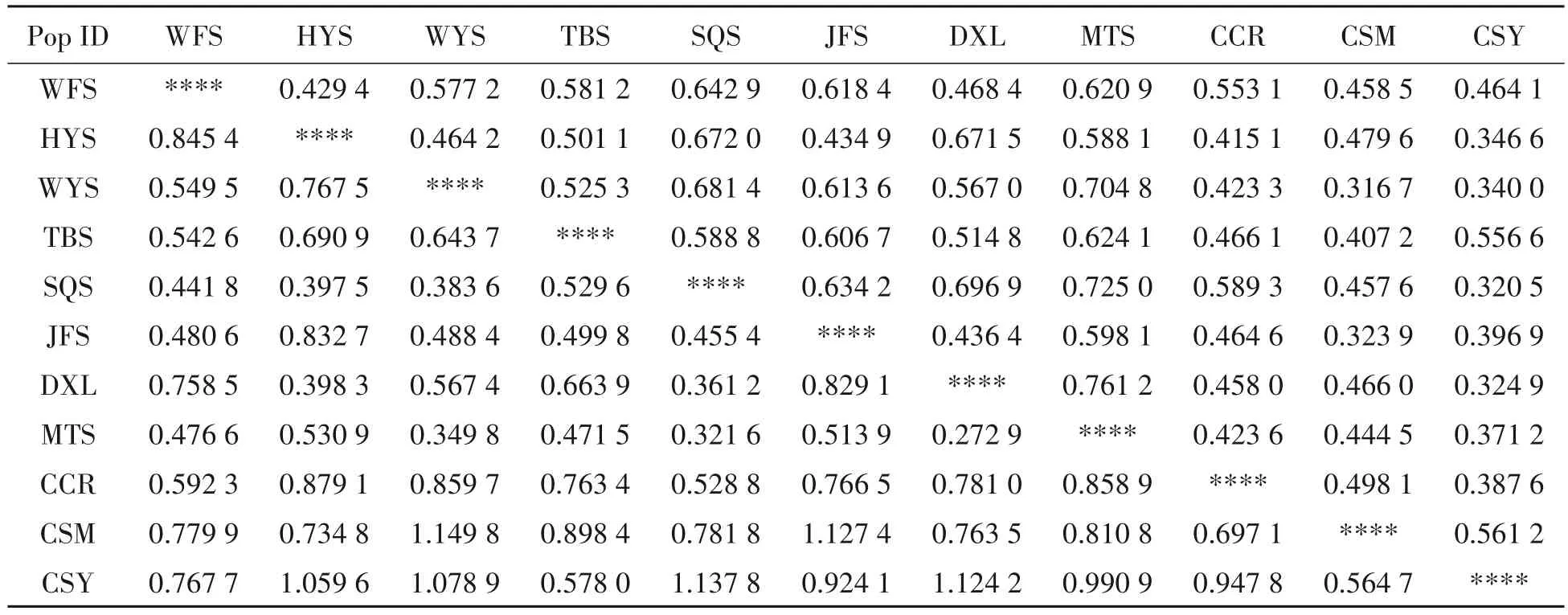
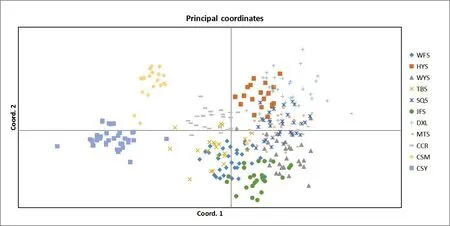
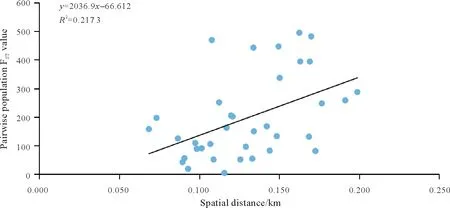
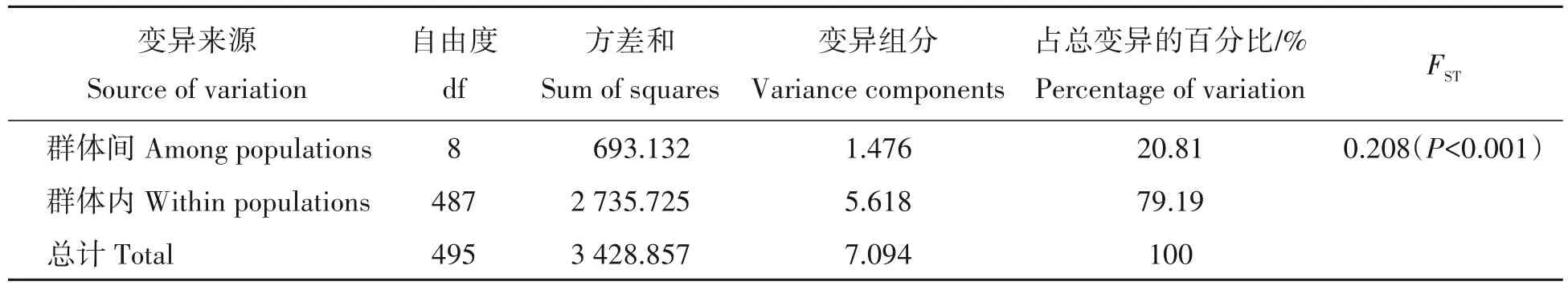
对所有检测的11个群体进行遗传多样性分析表明(表4),各群体的遗传多样性参数有一定的差异。平均等位基因数(A)和有效等位基因数(Ne)最高的是MTS群体(5.158,3.502),最低的是JFS群体(3.526,2.388)。群体的观察杂合度和期望杂合度的变化范围为0.360~0.550 和0.479~0.673。Shannon’s 信息指数(I)介于0.927~1.314,各群体的遗传多样性从小到大依次为CSM 表4 11个群体的遗传多样性Tab.4 Genetic diversity of 11 C.chkiangoleosa populations 通过比较平均值发现,浙江红山茶、厚叶红山茶和全缘红山茶的遗传多样性差异不大(表4)。将厚叶红山茶群体并入浙江红山茶群体得到的平均期望杂合度是0.597。就有效等位基因、期望杂合度和Shannon’s 信息指数而言,厚叶红山茶的遗传多样性水平要高于浙江红山茶,全缘红山茶的遗传多样性水平最低。 遗传距离和遗传相似度体现了群体间的亲缘关系。从表5 中可以得知,全缘红山茶的CSY 群体与CSM群体之间的亲缘关系比较近,遗传距离为0.564 7,且这两个群体与厚叶红山茶和浙江红山茶的群体之间有着相对低的遗传相似度。厚叶红山茶CCR 群体与SQS 群体和WFS 群体的遗传相似度最高,分别为0.589 3和0.553 1,与HYS群体的遗传相似度最低(0.415 1)。在8个浙江红山茶群体中,遗传相似度最高(0.761 2)的两个群体是MTS群体和DXL群体;其次是MTS群体和SQS群体,它们的遗传相似度和遗传距离分别为0.725 0和0.321 6。 表5 11个群体的遗传距离和遗传相似度Tab.5 Nei’s unbiased(1972)measures of genetic identity and genetic distance of 11 populations 基于Nei’s(1983)遗传距离构建的UPGMA聚类图(图2)显示,11个群体被划分为三大类。全缘红山茶的CSY 和CSM 群体聚在一起,组成第Ⅰ大类。厚叶红山茶CCR 群体单独成为第Ⅱ大类并与其他来自浙江红山茶的8 个群体组成的第Ⅲ大类相邻。第Ⅲ大类所有群体又可以分为3 组,WFS 群体和JFS 群体聚在一起,TBS 群体自成一组,WYS、MTS、SQS、DXL 和HYS 群体聚成第3 组。全缘红山茶和浙江红山茶的亲缘关系相对较远,而厚叶群体与浙江红山茶群体的亲缘关系较近。此外,主坐标分析(PCoA)(图3)的结果与UPGMA 聚类分析相吻合。基于305份样本得出的UPGMA 聚类图(图4)中,厚叶红山茶的个体与浙江红山茶没有交集,而有2个个体与全缘红山茶聚在了一起。对厚叶红山茶和浙江红山茶共9个群体进行Mantel 检测,结果表明这9 个群体的遗传分化与地理距离有一定的正相关(R2=0.217,P<0.05),群体间存在一定的地理隔离效应(图5)。 图2 11个群体UPGMA聚类分析Fig.2 UPGMA cluster diagram of 11 populations 图3 11个群体PCoA主成分分析Fig.3 Principal component analysis of PCoA in 11 populations 图4 305份样本UPGMA聚类分析Fig.4 UPGMA cluster diagram of 305 samples 图5 9个群体的Mantel检测Fig.5 Mantel detection of 9 populations 由表3 可知,所有供检测群体的总的遗传分化系数(FST)为0.246;而经物种归并处理后的浙江红山茶9个群体的遗传分化系数(FST)为0.209,基因流(Nm)变异范围在0.321~2.408,均值为0.947。表明将近缘种群体的并入会加剧总检测群体间的遗传分化;而经物种归并后的浙江红山茶9个群体处于显著分化水平且群体间的基因流较小,其中有20.9%的变异来源于群体间,79.1%的变异发生在群体内,这与AMOVA分子方差分析(表6)的结果相近。为了进一步探讨厚叶红山茶群体与浙江红山茶各群体之间的遗传关系,采用STRUCTURE 软件以贝叶斯聚类的方法比较9个群体的遗传结构,将K设为2~10,重复运行10次。结果显示,K=5时获得的最大ΔK值(图6),表明9个群体的248份样本被划分为5个亚群(图7)。WFS群体为第一亚群(绿色区),HYS、SQS和DXL群体组成第二亚群(粉色区),WYS和JFS群体为第三亚群(红色区),TBS 和MTS 群体被划分为第四亚群(蓝色区),CCR 群体单独作为第五亚群(黄色区),这一结果与UPGMA 聚类分析相似。每个亚群之间都存在一定的基因交流,但又有明显的分化,其中,第二亚群的SQS群体遗传组分复杂,与其他几个亚群都有一定的基因渗透。 图6 9个群体的最佳K值Fig.6 Optimal K values for 9 populations 图7 9个群体的遗传结构分析Fig.7 Genetic structure analysis of 9 populations 表6 9个群体的AMOVA分析Tab.6 AMOVA analysis of 9 populations 目前山茶属有张宏达与闵天禄2套分类系统,其中前者认为浙江红山茶、厚叶红山茶、全缘红山茶为3 个独立的种,而后者则将厚叶红山茶与浙江红山茶进行种的归并[3,5]。基于此,本研究采用两种方式探讨浙江红山茶及其近缘种的遗传多样性。其一是将厚叶红山茶群体并入浙江山茶群体(9 个群体)统一为浙江红山茶群体,其二是3 个物种分开合计11 个群体。本研究采用19 个SSR 标记对江西省内浙江红山茶及其近缘种群体进行遗传分析,结果表明,有94.74%的SSR 标记具有中或高多态性,能够有效的评估群体遗传多样性。在9个群体中,SSR 位点的有效等位基因(Ne)为4.557,平均期望杂合(He)为0.752,平均Shannon’s 信息指数(I)为1.650。本研究数据明显高于Xie 等[8]基于ISSR 标记分析浙江红山茶群体的遗传多样性结果(I=0.496 6,h=0.333 1)。数据显示SSR 标记在揭示群体遗传多样性研究中具有比ISSR标记更大的优势。 遗传多样性水平在物种的进化和适应环境过程中起着决定性的作用。在物种水平上,浙江红山茶的基因多样度H为0.752,要高于Huang 等[10]采用SSR 标记分析全国范围内的12 个浙江红山茶群体的基因多样度(0.596)。研究采集的江西浙江红山茶群体(除厚叶红山茶群体)主要集中在武夷山脉和怀玉山脉,而全国范围的研究发现位于武夷山脉和怀玉山脉的群体表现出较高的遗传多样性,可见两者结论可相互印证,而对种群遗传多样性的评估可以揭示物种对不同环境的适应性[10],可见武夷山脉和怀玉山脉是浙江红山茶最适宜生境。同时,与其他的狭域树种相比,如山樱花(Cerasus serrulata)(H=0.634)和蒙古栎(Quercus mongolica)(H=0.624)比浙江红山茶具有更低的基因多样度[18-19]。在山茶属的狭域树种中,陈海玲等[20]利用SSR 标记对薄叶金花茶(C.chrysanthoides)、小花金花茶(C.micrantha)和小瓣金花茶(C.parvipetala)的7 个种群进行了遗传多样性分析,基因多样度平均0.471;Li 等[21]同样利用SSR 标记对金花茶(C.petelotii)及其变种(C.petelotiivar.microcarpa)的天然群体进行了遗传多样性分析,平均基因多样度达到0.546,也均低于本研究结果,显示浙江红山茶是遗传多样性较丰富的物种。此外,本研究中,19 个SSR 位点的观察杂合度(Ho)均低于期望杂合度(He),近交系数F>0群体发生近交,这意味着浙江红山茶群体中的纯合子过剩,这种情况也发生在千年桐(Vernicia montana)和白柳(Salix alba)的群体遗传多样性研究中[22-23],而这一结果暗示浙江红山茶群体内正发生着杂合子缺失的过程,未来浙江红山茶遗传多样性会随之减少。综合11 个群来看,遗传多样性水平厚叶红山茶(H=0.611)与浙江红山茶(H=0.595)相近,全缘红山茶(H=0.501)可能略低于浙江红山茶。 群体的分化程度及遗传结构可用遗传分化系数(FST)来评估,0.05 传统经典分类主要依赖于外观形态进行。但对于自然环境错综复杂,物种形态变异丰富的物种类群,传统分类学处理往往会存在认识分歧。对山茶属分类系统来说,张宏达系统和闵天禄系统两套分类系统分歧较大。其中,山茶属红山茶亚组的物种分类一直存有争议,尤其是厚叶红山茶和浙江红山茶的种归并问题。本研究基于SSR分子标记,从遗传分化和遗传结构方面探讨3个浙江红山茶近缘种的遗传关系。UPGMA 聚类将两个全缘红山茶群体(CSY 和CSM)聚为一类,与厚叶红山茶和浙江红山茶明显区分开来,厚叶红山茶群体(CCR)可以和浙江红山茶群体聚为一类,也可以单独成一类。温强等[27]利用RPB2基因序列得出的浙江红山茶及其近缘种的系统进化树中,结果不支持将厚叶红山茶和浙江红山茶归为一个种,二者之间的遗传距离(0.025)高于物种平均值。Xie等[8]对7个浙江红山茶群体进行聚类时,同样将厚叶红山茶群体(JYX)单独聚为一类。本研究中,9 个群体的STRUCTURE 的遗传结构分析将厚叶红山茶归为一个亚群[8]。前人研究表明厚叶红山茶与浙江红山茶有一定的遗传距离,但由于省内厚叶红山茶仅收集到一个群体,所以是否将两者归并成一个种还待进一步的研究探讨。8 个浙江红山茶群体大体上按怀玉山脉(HYS、SQS 和DXL)和武夷山脉(WYS、JFS)进行聚类,符合笔者全国范围内[10]得出12 个浙江红山茶群体按山脉聚类的结果。 致谢:江西省林业局油茶专项(YCYJZX〔2023〕131,YCYJZX〔2023〕111)、江西省林业局科技创新专项(202228)、江西省林业科学院基础研究与人才科研专项(2023521001)、江西省林业科学院基础研究与人才科研专项(2022511001)和江西省林业科学院科研及成果推广专项博士启动项目(2021521001)同时对本研究给予了资助,谨致谢意!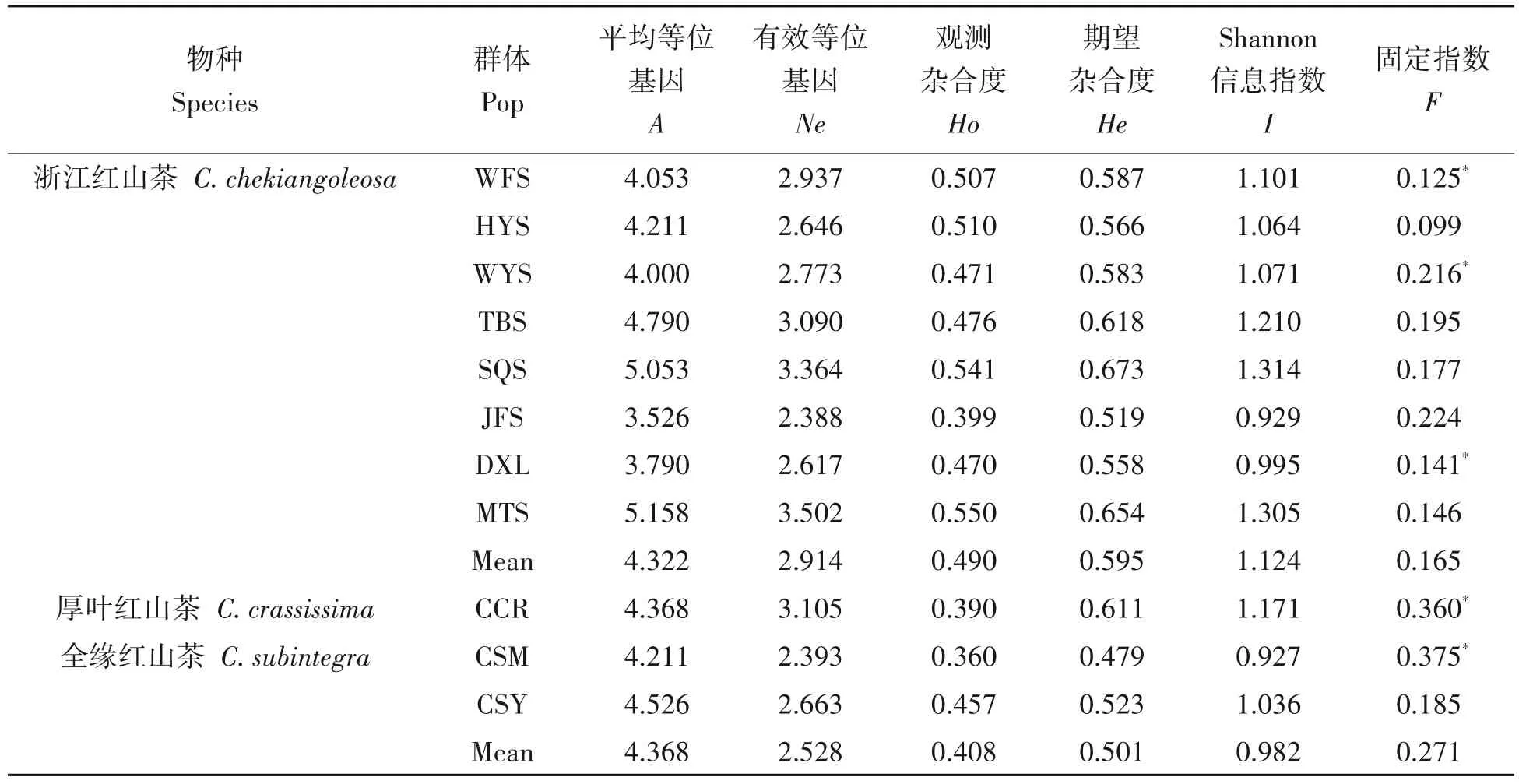
2.3 浙江红山茶及其近缘种群体的遗传聚类分析

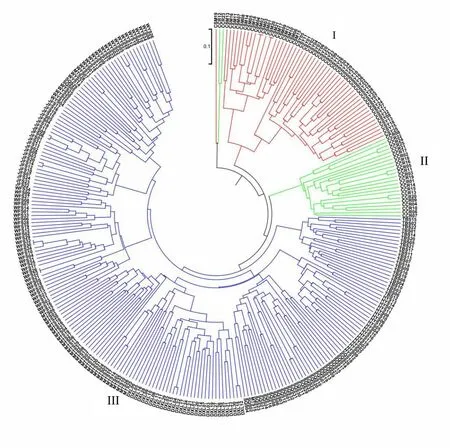
2.4 浙江红山茶群体的遗传分化与遗传结构
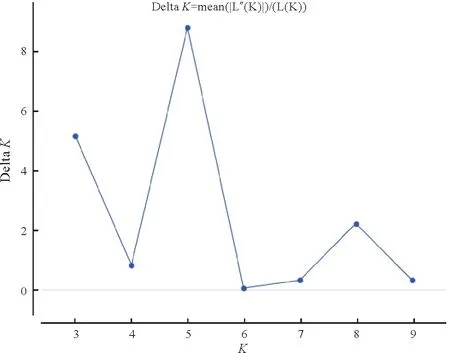
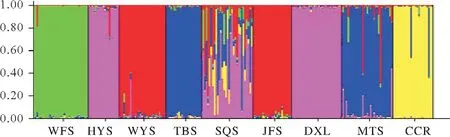
3 结论与讨论
3.1 浙江红山茶遗传多样性分析
3.2 浙江红山茶群体的遗传分化和遗传结构
