高考化学电化学选择题速解法
2023-11-22陈文初
陈文初
随着新能源的兴起和普及,关于电化学的研究越来越受到重视,高考中电化学知识的考查在高考试题中占比也越来越高。2022年广东高考题中出现了两道考查电化学知识的选择题,总分值为6分;2023年更是增加到三道题,总分值达到10分。这显示了在广东高考化学试题中基础性試题和综合性试题都在加强电化学知识的考查。本文通过对近两年广东高考电化学相关选择题的综合分析,总结了该类试题的常考知识点和解题技巧,从而提高学生的解题效率和学习信心。
一、基础性电化学选择题分析及解题策略
【例1】(2022年广东卷第10题) 以熔融盐为电解液,以含Cu、Mg和Si等的铝合金废料为阳极进行电解,实现Al的再生。该过程中()
A.阴极发生的反应为Mg-2e-=Mg2+
B.阴极上Al被氧化
C.在电解槽底部产生含Cu的阳极泥
D.阳极和阴极的质量变化相等
【解析】根据电解原理可知,电解池中阳极发生失电子的氧化反应,阴极发生得电子的还原反应,该题中以熔融盐为电解液,含Cu、Mg和Si等的铝合金废料为阳极进行电解,通过控制一定的条件,从而可使阳极区Mg和Al发生失电子的氧化反应,分别生成Mg2+和Al3+,Cu和Si不参与反应,阴极区Al3+得电子生成Al单质,从而实现Al的再生。A项,阴极应该发生得电子的还原反应,实际上Mg在阳极失电子生成Mg2+,A错误;B项,Al在阳极上被氧化生成Al3+,B错误;C项,阳极材料中Cu和Si不参与氧化反应,在电解槽底部可形成阳极泥,C正确;D项,因为阳极除了铝参与电子转移,镁也参与了电子转移,且还会形成阳极泥,而阴极只有铝离子得电子生成铝单质,根据电子转移数守恒及元素守恒可知,阳极与阴极的质量变化不相等,D错误;故选C。
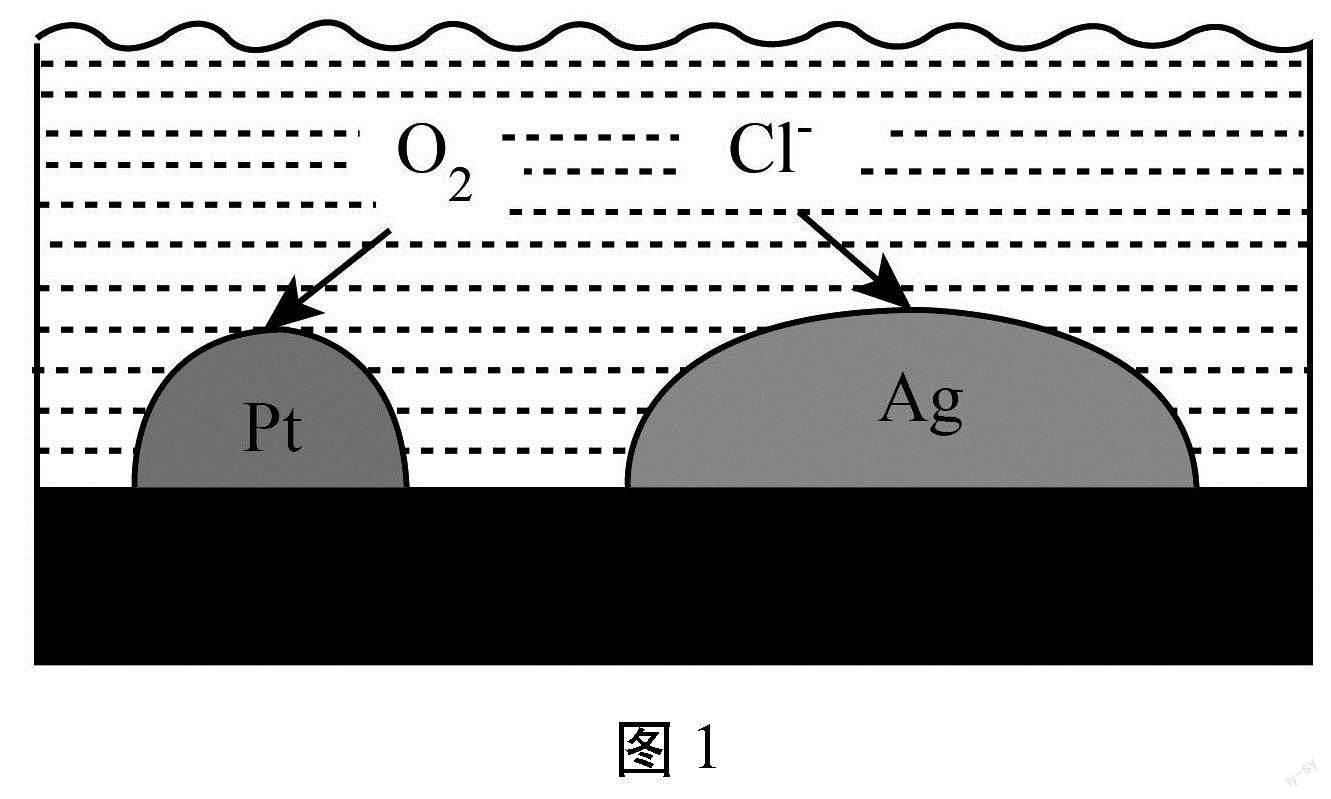
【例2】(2023年广东卷第6题)负载有Pt和Ag的活性炭,可选择性去除Cl-实现废酸的纯化,其工作原理如图1所示。下列说法正确的是()
A.Ag作原电池正极
B. 电子由Ag经活性炭流向Pt
C.Pt表面发生的电极反应:O2+2H2O+4e-=4OH-
D. 每消耗标准状况下112L的O2,最多去除1mol Cl-
【解析】O2在Pt得电子发生还原反应,Pt为正极。根据题意和图示,Cl-在Ag极失去电子发生氧化反应,Ag为负极。A.由分析可知,Cl-在Ag极失去电子发生氧化反应,Ag为负极,A错误;B.电子由负极Ag经活性炭流向正极Pt,B正确;C.溶液为酸性,电极方程式不能出现OH-,Pt表面发生的电极反应应为O2+4H++4e-=2H2O,C错误;D.根据电极反应关系式:4e-~O2~4Cl-,每消耗标准状况下112L即05mol O2,可除2mol Cl-,D错误。故选B。
【解题策略】
1.运用基本的电极方程式书写和离子的放电顺序等知识。
(1)电解电解质水溶液时,阳极放电顺序为:活性金属阳极(Au 、Pt 除外)>S2->I- > Br->Cl->OH->含氧酸根离子 。
如果是熔融盐电解液,阳极含多种金属,则按照金属活动顺序,活泼金属优先放电,较不活泼的金属通常还没来得及放电就已经脱落阳极成为阳极泥。
(2)电解电解质水溶液时,阴极放电顺序为:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+> Mg2+>Na+>Ca2+>K+。
阳离子放电,其顺序大体可参照金属活动顺序来推断。位于金属活动顺序表后面的金属,其对应的阳离子优先得到电子。
2.熟悉运用电化学腐蚀的基本原理。
电化学腐蚀的分类:
(1)析氢腐蚀——腐蚀过程中不断有氢气放出
①条件:潮湿空气中形成的水膜,酸性较强(水膜中溶解有CO2、SO2、H2S等气体)
②电极反应:
负极: Fe-2e-=Fe2+
正极: 2H++2e-=H2↑
总式:Fe+2H+=Fe2++H2↑
(2)吸氧腐蚀——反应过程吸收氧气
①条件:碱性或中性或弱酸性溶液
②电极反应:
负极: 2Fe-4e-=2Fe2+
正极: O2+4e-+2H2O =4OH-
总式:2Fe+O2+2H2O=2Fe(OH)2。
二、综合性电化学选择题分析及解题策略
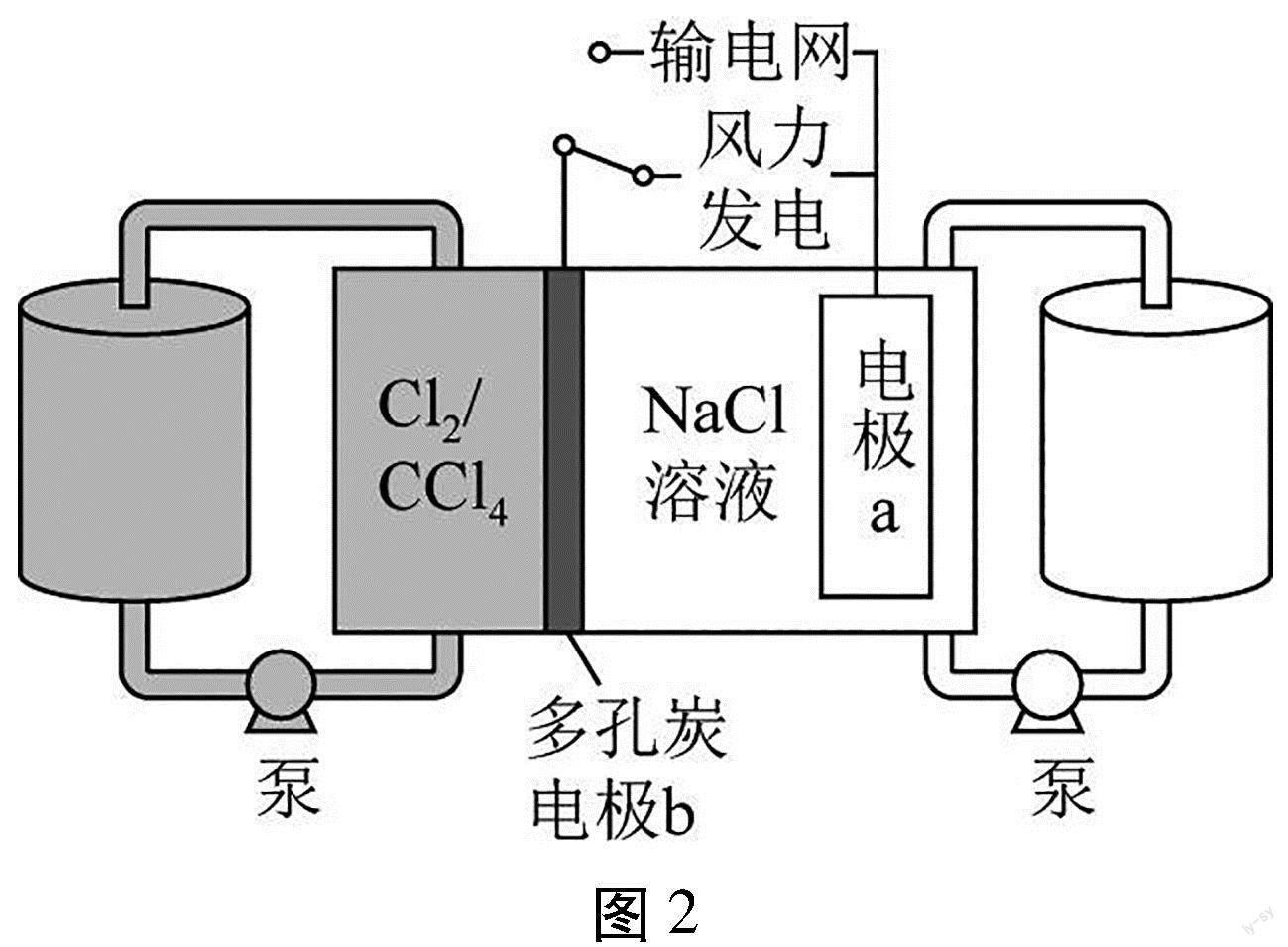
【例3】(2022年广东卷第16题)科学家基于Cl2易溶于CCl4的性质,发展了一种无需离子交换膜的新型氯流电池,可作储能设备(如图2)。充电时电极a的反应为:
NaTi2(PO4)3+2Na++2e-Na3Ti2(PO4)3。下列说法正确的是()
A.充电时电极b是阴极
B.放电时NaCl溶液的pH减小
C.放电时NaCl溶液的浓度增大
D.每生成1molCl2,电极a质量理论上增加23g
【解析】A项,由充电时电极a的反应可知,充电时电极a发生还原反应,所以电极a是阴极,则电极b是阳极,故A错误;B项,放电时电极反应和充电时相反,则由放电时电极a的反应为Na3Ti2(PO4)3-2e-NaTi2(PO4)3+2Na+,正极反应为Cl2+2e-=2Cl-,可知,NaCl溶液的pH不变,故B错误;反应后Na+和Cl-浓度都增大,则放电时NaCl溶液的浓度增大,故C正确;D项,充电时阳极反应为2Cl--2e-=Cl2↑,阴极反应为NaTi2(PO4)3+2Na++2e-Na3Ti2(PO4)3,由得失电子守恒可知,每生成1molCl2,电极a质量理论上增加23g/mol×2mol=46g,D错误;故选C。
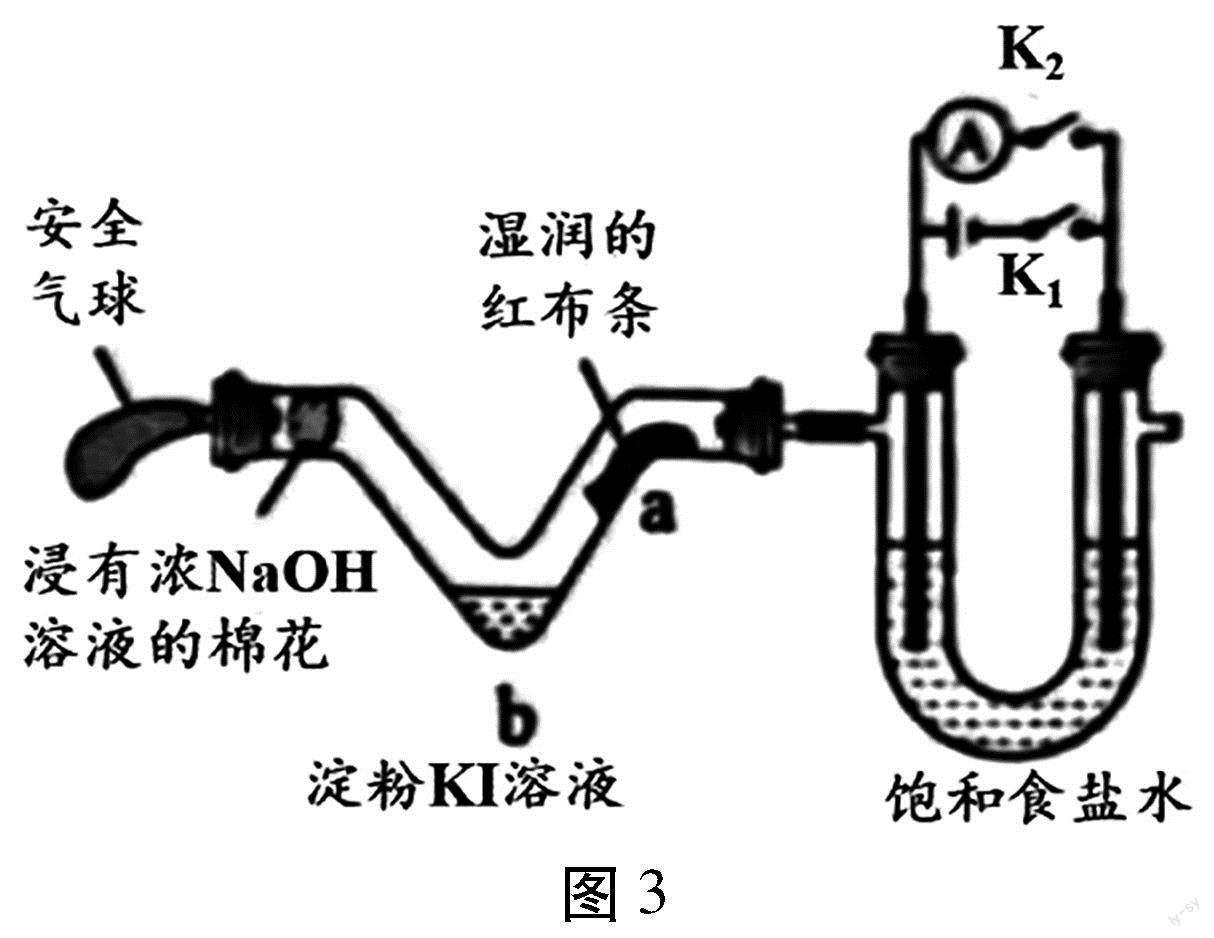
【例4】(2023年广东卷第13题)利用活性石墨电极电解饱和食盐水,进行如图3所示实验。闭合K1,一段时间后()
A.U型管两侧均有气泡冒出,分别是Cl2和O2
B.a处布条褪色,说明Cl2具有漂白性
C.b处出现蓝色,说明还原性:Cl->I-
D.断开K1,立刻闭合K2,电流表发生偏转
【解析】闭合K1,形成电解池,电解饱和食盐水,左侧为阳极,阳极氯离子失去电子生成氯气,电极反应为2Cl--2e-=Cl2↑,右侧为阴极,阴极电极反应为2H2O+2e-H2↑+2OH-,总反应为2NaCl+2H2O电解2NaOH+H2↑+Cl2↑。A.根据分析,U型管两侧均有气泡冒出,分别是Cl2和H2,A错误;B.左侧生成氯气,氯气遇到水生成HClO,具有漂白性,则a处布条褪色,说明HClO具有漂白性,B错误;C.b处出现蓝色,发生Cl2+2KII2+2KCl,说明还原性:I->Cl-,C错误;D.断开K1,立刻闭合K2,此时构成氢氯燃料电池,形成电流,电流表发生偏转,D正确;故选D。
【例5】(2023年广东卷第16题)用一种具有“卯榫”结构的双极膜组装电解池(如图4所示),可实现大电流催化电解KNO3溶液制氨。工作时,H2O在双极膜界面处被催化解离成H+和OH-,有利于电解反应顺利进行。下列说法不正确的是()
A. 电解总反应:KNO3+3H2ONH3·H2O+2O2↑+KOH
B. 每生成1mol NH3·H2O,双极膜处有9 mol的H2O解离
C. 电解过程中,阳极室中KOH的物质的量不因反应而改变
D. 相比于平面结构双极膜,“卯榫”结构可提高氨生成速率
【解析】A.由分析中阴阳极电极方程式可知,电解总反应为KNO3+3H2ONH3·H2O+ 2O2↑+ KOH,故A正确;B.每生成1molNH3·H2O,阴极得8mole-,同时双极膜处有8mol H+进入阴极室,即有8mol的H2O解离,故B错误;C.电解过程中,阳极室每消耗4molOH-,同时有4mol OH-通过双极膜进入阳极室,KOH的物质的量不因反应而改变,故C正确;相比于平面结构双极膜,“卯榫”结构具有更大的膜面积,有利于H2O被催化解离成H+和OH-,可提高氨生成速率,故D正确;故选B。
【解题策略】 近两年的广东高考化学试题均有原电池和电解池结合的综合性电化学题选择题,难度较大。但只要充分运用以下基本的原电池和电解池原理去解答,也可以比较快地准确做出判断。
1.电子、离子的移动方向:首先要明确电子只能在导线或固体电极上传递,而不能从电解质溶液中通过,离子可以通过电解质溶液或者固体电解质(即电子不下水,离子不上岸),电流从电势高的正极流向负极。
(1)电子移动方向:原电池电子从负极沿导线流向正极;电解池电子从直流电源负极流出,流入阴极,再从阳极流出,流入直流电源正极。
(2)离子的移动方向:原电池:正正负负;电解池:阴阳相吸。即原电池带正电的离子(阳离子)移向正极,带负电的离子(阴离子)移向负极;电解池阳离子向阴极移动,阴离子向阳极移动。
2.电极反应的判断:电化学中发生氧化反应(失去电子)的电极为阳极或负极,发生还原反应(得到电子)的电极为阴极或正极。规律:负极、阳极发生氧化反应(失去电子),正极、阴极发生还原反应(得到电子)。
(1)看选项所给正极、阴极反应式是否为“+xe-”;负极、阳极反应式是否为“-xe-”。
(2)判断是充电还是放电;所给反应的反应物是否正确(有时放电反应的题目会给出充电时的反应)。
(3)考虑反应环境对产物的影响,如酸性环境不能生成OH-。
3.可充电电池:充电要求“正接正,负接负”,即充电时电池的负极与电源的负极相连作阴极,电池的正极与电源的正极相连作阳极。电极反应特点:负极与阴极相反,正极与阳极相反。
4.溶液pH(物质)变化:电解质溶液pH的变化与溶液中c(H+) 或c(OH-)的变化有关,在解题中注意分析电极反应或总反应方程式中c( H+)或c(OH-)的变化。电极附近的pH变化要看电极反应,电解质溶液的pH变化要看总反应。一般电解池pH变化:“阴盛阳衰”,即阴极pH增大,阳极pH减小。
5.电极产物的判断及电化学的相关计算: 在电化学中电极产物是与电解质接触的,因此判断电极产物时不要忽略介质(电解质)参与反应,相关量计算时的主要依据为电子守恒, 即在串联电路中,通过每个电极的电子数均相等,相关量计算时遵循电子守恒。
(1)电极产物的判断:反应物得失电子后在电解质溶液中要能稳定存在,即判断电极产物时不要忽略介质。如当KOH溶液为电解质时,CH4燃料电池中碳元素对应产物不是CO2,而是CO32-。
(2)相关量的计算要以电极反应或总反应为依据,遵循电子守恒。熟记常见电子与物质间计算关系式:4e-~O2~2H2~2Cu~2Cl2~4Ag~4H+~4OH-。涉及气体体积,首先要看一下有没有“标准状况”,然后再进行计算。
三、基于选择题的速解策略
实际上,在熟悉掌握原电池和电解池的基本工作原理和规律后,对于大多数选择题,还有更快更高效的解法,堪称“秒杀技巧”。这里另选取几道全国高考电化学试题为例来分析。
【例6】(2022全国甲卷)一种水性电解液Zn-MnO2离子选择双隔膜电池如图5所示(KOH溶液中,Zn2+以Zn(OH)2-4存在)。电池放电时,下列叙述错误的是()
A.Ⅱ区的K+通过隔膜向Ⅲ区迁移
B.Ⅰ区的SO2-4通过隔膜向Ⅱ区迁移
C.MnO2电极反应:MnO2+2e-+4H+=Mn2++2H2O
D.电池总反应:Zn+4OH-+MnO2+4H+=Zn(OH)2-4+Mn2++2H2O
【秒杀技巧】对于原电池,首先判断正负极。右边的Zn为活泼金属,而左边的MnO2为氧化性物质,故可判断左边MnO2为正极,右边的Zn为负极,根据电池中离子移动规律“正向正,负向负”,K+应向左边的Ⅰ区迁移,故A错误,选A。
下列叙述错误的是( )
A.充电时Na+从钠电极向硫电极迁移
B.放电时外电路电子流动的方向是a→b
C.放電时正极反应
D.炭化纤维素纸的作用是增强硫电极导电性能
【秒杀技巧】作为电池,显然活泼金属一极钠电极为负极,充电时变成电解池,负极外接负极做阴极。根据电解池中离子移动规律“阴向阳,阳向阴”,Na+应向阴极钠电极迁移,故A错误,选A。
【速解策略】准确判断出两极,很多问题即可迎刃而解。通过判断电极的正与负、阴与阳,明确装置中微粒的迁移方向,电路中电子的流向,一般就可以确定若干选项的正误。同时,对教材中典型的电化学装置,如铜锌原电池、氢氧燃料电池、电解饱和食盐水模型、铅蓄电池的基本原理要理解透彻。只有在吃透教材中典型电化学装置的基础上,才能很好地构建解题模型,梳理解题思路,完成知识的迁移,才能做到以不变应万变。
