光激化学发光免疫检测探针材料的设计与制备
2023-11-21陈扶犁郭劲宏马星
陈扶犁,郭劲宏,马星*
(1.哈尔滨工业大学(深圳)材料科学与工程学院,广东 深圳 518055; 2.上海交通大学电子信息与电气工程学院,上海 200240)
0 引言
免疫检测是基于抗原-抗体特异性结合的生物医学检测方法,用被标记的抗体与样品孵育,抗体在孵育过程中与待测抗原发生特异性结合,通过检测标记物的化学、光学、电学、磁学等特殊性质,即可测出被测抗原的含量。免疫检测是生物医学检测的一个重要发展方向,其检测对象涉及各种抗原[1-5]、抗体[3,6]、肿瘤标志物[7-8]、炎症标志物[9]、器官损伤标志物[10]、激素[11-12]、酶[13-14]等生物大分子,还包括毒品、毒素等小分子[15-16],以及各种细胞[17]。准确、实时、便捷的生物医学检测是及时诊断和治疗疾病的前提。然而,传统免疫检测还有许多局限性,从而导致检测的准确性、实时性、便捷性受影响。
酶联免疫吸附检测法(ELISA)是常用的免疫检测法之一,涉及两种能与被测物特异性结合的抗体,一种用酶标记,另一种固定在基底上,当含有被测物的样品与酶标抗体、基底孵育时,被测物与抗体发生特异性结合,形成夹心使酶被固定在基底上。检测者在清洗去除未结合的酶标抗体后,加入酶的底物,通过检测酶催化反应产物的某种性质(比如紫外-可见光吸收、荧光、化学发光等),即可测得被测物的浓度。ELISA 的局限性在于清洗操作繁琐,在加入酶的底物前需要反复清洗以去除未结合的酶标抗体,若清洗不彻底留在被测体系中的未结合的酶标抗体也会产生最终的信号,导致结果偏大而影响检测的准确性,反复清洗费时费力且增大了检测成本,影响了检测的实时性和便捷性[18-19]。胶体金标免疫试纸法涉及两种能与被测物特异性结合的抗体,一种用金纳米颗粒标记,另一种固定在试纸条的T 线上,试纸条的C 线上则负载二抗,待测物先与金标抗体结合,层析至T 线时又与固定在T 线上的抗体结合,形成夹心使金纳米颗粒被固定在T 线上,此时T 线显示出金纳米颗粒的深红色,通过观察T线和C 线的颜色来判断样品中是否含有该被测物,该法操作简单、检测速度快,可用于居家自测,但其局限性在于只能用于定性分析,难以定量。荧光免疫检测法也是常用的免疫检测法之一,检测者用荧光剂标记抗体,通过检测与被测物结合的荧光剂的荧光强度测得被测物的含量[8]。荧光免疫检测法的局限性在于生物样品的基质在激发光照射下也会发出荧光,导致检测受到干扰[20]。此外,荧光免疫检测法同样也需要清洗去除未与被测物结合的荧光剂。上转换发光免疫检测与普通的荧光免疫检测类似,唯一区别在于标记物由下转换荧光材料改为上转换发光材料,其优势在于标记物的发射波长短于激发波长,从而免去了背景荧光的干扰[20],然而上转换发光材料的发光效率普遍很低,上转换发光材料在制备过程中要用到对健康和环境威胁较大的氟化物[21],该法安全性不足,而且也需要清洗去除未与被测物结合的上转换发光材料。化学发光免疫检测与荧光免疫检测类似,只是标记物由荧光剂变为了化学发光剂,其优势在于不需要激发光,从而免去了背景荧光的干扰[22],然而化学发光剂种类不多,发光强度也普遍弱于荧光、磷光等其他发光材料,并且大多缺乏与被标记物共价结合的成键基团,因此标记多以物理吸附为主,稳定性差[22]。此外,化学发光免疫检测法同样也需要清洗去除未与被测物结合的化学发光剂。
光激化学发光免疫检测法(AlphaLISA)相对于ELISA、荧光免疫检测法等传统免疫检测而言,具有明显优势:一是均相反应,免去了洗涤步骤;二是发射波长短于激发波长,避免了背景荧光的干扰[23-24]。光激化学发光免疫分析法所用到的纳米探针 包 含 供 体 球(Donor beads,DBs)和 受 体 球(Acceptor beads,ABs)。供体球负载光敏剂,在激光激发下产生单线态氧;受体球负载化学发光剂,当受体球与单线态氧接触时,受体球上的化学发光剂被单线态氧氧化而发光,发光波长短于激发光。将待测抗原的两种不同的单克隆抗体分别修饰受体球和供体球,当含有待测抗原的样品与供体球、受体球在样品池中一起孵育时,形成供体球-抗体1-抗原-抗体2-受体球的夹心复合物,在夹心复合物中供体球产生的单线态氧扩散至受体球,其与受体球作用而发光,发光强度与待测抗原的含量成正比[23-24]。光激化学发光纳米探针的发射波长短于激发波长,因此光激化学发光纳米探针能消除生物基质的背景荧光和散射光对检测的干扰。由于未结合的供、受体球距离超过单线态氧的最大扩散距离(约为200 nm)而不能发光,不需要通过清洗将从体系中未结合的探针去除,也不需要将发光的探针固定在基底上。因此,光激化学发光免疫分析法是一种均相、免洗的检测方法,该法操作简便、节省检测时间[19]。光激化学发光纳米探针非常适合生物医学检测,尤其是POCT(Point-of-care testing),其有广阔的发展应用前景。
从光激化学发光免疫检测的原理可知,光激化学发光免疫检测法对探针材料有以下的要求[23-24]:(1)供体球在激发光的照射下,应能产生大量的单线态氧;(2)受体球能与单线态氧发生反应,并且发光;(3)供体球和受体球中至少一方的尺寸约为200 nm,在供、受体球特异性结合时单线态氧能从供体球扩散至受体球;(4)供体球和受体球的形貌应为球形,并且是规则的球形;(5)供体球和受体球在水中分散性好,不易团聚;(6)供体球和受体球表面都有羧基修饰,用于连接抗体;(7)供体球和受体球之间的非特异性结合较弱,或者外场能打散非特异性结合,但不能打散特异性结合。然而,目前光激化学发光免疫检测探针材料的制备还存在一些难点,现有的商用光激化学发光免疫检测探针材料还存在一些问题,如难以精准控制供体球与受体球的形貌与尺寸,目前的商用供体球、受体球形貌不规则、单分散性差、尺寸不均一,不利于检测;探针材料易团聚、易沉降,探针材料之间、探针材料与生物基质之间的非特异性吸附强烈,干扰检测。
本文采用PVP 调控的共聚法合成均相受体纳米颗粒,成功解决了受体球的形貌不规则、尺寸不均一的问题。同时,采用介孔二氧化硅包覆法,制备核壳结构的磁性纳米颗粒作为供体球。通过磁性分离操作,成功解决了非特异性吸附导致背景干扰光学信号强烈的问题,为均相发光检测试剂的开发提供了基础核心原材料。
1 实验方法
1.1 原料
实验所用原料:2-(4-(N,N-二甲基氨基)苯基)-3-苯基-1,4-硫氧杂-2-环己烯,采购自药明康德;六水合三氯化铁(FeCl3·6H2O),采购自天津百世化工有限公司;三(1,3-二苯基-1,3-丙二酮基)(1,10-菲啰啉)合铕(III)(Eu(DBM)3Phen),由六水合氯化铕(III)(EuCl3·6H2O)、1,3-二苯基-1,3-丙二酮和1,10-菲罗啉制得,均采购自麦克林;无水乙醇和N,N-二甲基甲酰胺(DMF),采购自西陇科学;磷酸盐缓冲溶液(PBS),采购自白鲨生物;苯乙烯、聚乙烯吡咯烷酮(PVP)、偶氮二异丁脒盐酸盐(V-50)、丙烯酸、丙烯酸钠、双(2,4,6-三氯苯基)草酸酯(Bis(2,4,6-trichlorophenyl) oxalate, BTPO)、萎锈灵、二氯甲烷(CH2Cl2)、曲拉通100、聚乙二醇400、乙酸钠、乙二醇、十六烷基三甲基溴化铵(CTAB)、三乙醇胺(TEOA)、正硅酸乙酯(TEOS)、3-氨丙基三乙氧基硅烷(APTES)、Ce6、2-(7-偶氮苯并三氮唑)-N,N,N',N'-四甲基脲六氟磷酸盐(HATU)、二异丙基乙胺(DIPEA)、丁二酸酐、吗啉乙磺酸(MES)、1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(EDC)、N-羟基琥珀酰亚胺(NHS)、牛血清白蛋白(BSA)、乙醇胺,采购自麦克林;兔IgG 和羊抗兔IgG,采购自奥创生物。
1.2 受体球的设计与制备
1.2.1 受体球纳米载体的设计与制备
受体球的本质是化学发光纳米球,其载体是亲水、单分散、规则球形的纳米颗粒,纳米载体上负载化学发光剂。化学发光纳米球用到的基质包括介孔SiO2等无机基质和聚苯乙烯(PS)等聚合物基质。化学发光剂通常是弱极性,其缺乏与基质共价结合的成键基团的物质,介孔SiO2等无机基质难以发挥其优势。聚合物基质中,聚苯乙烯纳米球具有合成简便、表面修饰容易、尺寸均一的优势。因此,本文选择羧基修饰的聚苯乙烯(PS-COOH)纳米球作为受体球的纳米载体,该纳米球可由苯乙烯与丙烯酸或丙烯酸根离子共聚制得。
苯乙烯-丙烯酸共聚法制备PS-COOH 纳米球:首先,将平均分子量为58 000 的PVP 溶于49 mL 的去离子水并移至100 mL 的三口瓶中,在800 r·min-1转速下搅拌并始终保持。然后,加入5.5 mL 的苯乙烯,在N2保护下搅拌回流升温至70 ℃,再通30 min的N2后加入75 mg·mL-1的V-50 水溶液1 mL,停止通N2后迅速用塞子盖住三口瓶和冷凝管,待反应一段时间后一边通N2一边加入丙烯酸,待丙烯酸加完后停止通N2,并且迅速用塞子盖住三口瓶和冷凝管以保持密封,在70 ℃下搅拌继续冷凝回流,从加入V-50 开始计时,共计反应24 h。最后,加入和产物分散液体积相等的无水乙醇,在速度11 000 r·min-1下进行离心,经多次离心直至上清液接近澄清后弃上清液,用无水乙醇洗涤沉淀2 次后将最终产物分散于水中。其中,PVP 和丙烯酸的加入量、丙烯酸的加入时间是可调参数。
苯乙烯-丙烯酸钠共聚法制备PS-COOH 纳米球:将上述方案中的丙烯酸改为等摩尔的丙烯酸钠,其他条件不变。
1.2.2 染料的设计
化学发光分为直接化学发光和间接化学发光。直接化学发光是反应物发生化学反应生成激发态产物,产物跃迁回基态而产生的光辐射。间接化学发光则是反应物发生化学反应生成激发态产物,激发态 产 物 通 过 化 学 发 光 共 振 能 量 转 移(Chemiluminescence resonance energy transfer,CRET)激发荧光分子,荧光分子跃迁回基态所产生的光辐射[25],间接化学发光微纳米颗粒更合适光激化学发光,因为间接化学发光的波长取决于作为CRET 受体的荧光剂,更容易调整[25]。因此,采用间接化学发光纳米球作为受体球,需要将化学发光剂和荧光剂两种染料负载于PS-COOH 纳米载体。
硫氧杂环己烯类化学发光剂具有发光性能优异的特性。2-(4-(N,N-二甲基氨基)苯基)-3-苯基-1,4-硫氧杂-2-环己烯是一种硫氧杂环己烯类化学发光剂,其被称为光能存储单元(Photoenergy cache unit, PCU)[26],能与单线态氧反应生成激发态的氧化产物,可用作受体球的化学发光剂[23-24]。间接化学发光的CRET 效率与CRET 的供受体分子之间的距离6 次方成反比[25],因此光激化学发光受体球要求化学发光剂和荧光剂的浓度尽可能大,然而许多荧光剂在浓度稍高(大多在1×10-5左右)就会发生自淬灭,但铕螯合物(如Eu(DBM)3Phen)自淬灭需要的浓度要高得多[27]。Eu(DBM)3Phen 具有稳定性高、发光强度大、脂溶性好的特点,PCU 能被活性氧物种(ROS)氧化,生成的激发态产物能通过CRET 激发Eu(DBM)3Phen 而使之发光,将H2O2滴加至PCU 与Eu(DBM)3Phen 的混合溶液中,成功测出了强烈的化学发光,且该化学发光的强度远强于另一种常见化学发光剂BTPO 与Eu(DBM)3Phen的混合溶液,也强于另一种硫氧杂环己烯衍生物萎锈灵(Carboxin)与Eu(DBM)3Phen 的混合溶液。因此,本文选择PCU 作为受体球的化学发光剂,选择Eu(DBM)3Phen 作 为 受 体 球 的 荧 光 剂。图2 为PCU-Eu(DBM)3Phen 化学发光体系的发光机制示意图和化学发光谱图。
1.2.3 溶胀法负载染料
溶胀法是一种将染料装载入聚合物纳米球的常用方法[28-29]。采用溶胀法制备负载Eu(DBM)3Phen和PCU 的PS-COOH 纳米球作为受体球。
溶胀法负载染料:按1 mL 的CH2Cl2溶解0.5 g的Eu(DBM)3Phen 和0.1 g 的PCU 配制溶胀剂。将粒径约为200 nm 的PS-COOH 纳米球(由苯乙烯-丙烯酸钠共聚法制得)分散于曲拉通100 的水溶液中,该分散液中PS 浓度为20 mg·mL-1,曲拉通100 浓度为 5 mg·mL-1。在10 mL 的棕色小瓶中取4 mL 的分散液,在转速800 r·min-1下搅拌,同时滴加0.1 mL 的溶胀剂,再盖上瓶盖并用封口膜封住,在800 r·min-1转速下持续搅拌24 h,再开盖继续搅拌24 h,以便挥发掉CH2Cl2。在转数11 000 r·min-1下离心30 min,用去离子水洗涤沉淀,最终获得受体球,将受体球分散于水中保存。
残留染料的去除:在原方法的基础上新增一个步骤,即在溶胀完成后CH2Cl2挥发前,在转速5 000 r·min-1下离心2 min,保留上层液体,舍弃沉淀和下层液体。
1.3 供体球的设计与制备
1.3.1 供体球纳米载体的设计与制备
供体球是光敏纳米球,即负载光敏剂的纳米球,能在光照下产生单线态氧。现有的光激化学发光免疫探针还存在许多不足,如纳米材料比表面积大、表面能高,所以纳米材料存在自发的团聚和沉降倾向,此外纳米材料在生物样品中还会非特异地吸附基质中的蛋白而形成蛋白冠[30],这些因素都会导致供、受体球发生非特异性结合,造成探针在没有待测物的情况下也有明显的发光信号。
磁性微纳米颗粒易于从介质中分离,可免去离心、透析、过滤等复杂操作,磁性微纳米颗粒的运动可以精确操控,在生物医学领域中有很高的价值。磁性微纳米颗粒在磁场作用下能打散非特异性结合而不会打散特异性结合,可基本消除非特异性结合的 干扰[17,31]。Fe3O4纳米球是最常用的磁性纳米材料,其制备方法简便。介孔SiO2具有稳定性高、在水溶液中易分散、比表面积大、比孔容大、易于制备和修饰及能以共价键结合的方式负载染料的优势,而且介孔SiO2很容易包覆在Fe3O4、MgFe2O4等磁性纳 米 颗 粒 上 而 形 成 核 壳 结 构[32]。 因 此,选 择Fe3O4@mSiO2纳米球作为供体球的纳米载体。
溶剂热法制备Fe3O4纳米球:将1.62 g 的FeCl3·6H2O、0.5 g 的PEG400、1.8 g 的乙酸钠搅拌分散于30 mL 的乙二醇中,然后将该分散液转移至100 mL 的水热反应釜中,在200 ℃下溶剂热反应6 h,待冷却后打开反应釜用磁铁分离产物,再用乙醇和水清洗,即得Fe3O4纳米球。
制备Fe3O4@mSiO2纳米球:在平底筒形三口瓶中,将200 mg 的Fe3O4纳米球分散于100 mL 溶有1 g 的TEOA 和0.5 g 的CTAB 的去离子水中,充分超声后在400 r·min-1的机械搅拌下滴加0.5 mL 的TEOS,继续以该转速室温下搅拌24 h 后用磁铁分离产物,并用乙醇和水洗涤。按上述流程步骤再次将产物包覆一次,然后将产物分散于30 mL 浓度为10 g·L-1的NaCl 的甲醇溶液中,超声抽提30 min 后磁分离,重复该抽提过程3 次,以去除CTAB,最终制得Fe3O4@mSiO2纳米球,将最终产物分散于去离子水中。
1.3.2 共价结合法负载光敏剂
卟啉类和酞菁类是常用的光敏剂,具有化学性质稳定、吸光度大、光敏效率高、激发波长较长的优势。Ce6 是一种卟啉类光敏剂,每个Ce6 分子上有3个羧基,可通过酰胺键与纳米载体和抗体结合。因此,选择Ce6 作为供体球的光敏剂。Ce6 可通过酰胺键与Fe3O4@mSiO2纳米球结合,酰胺键作为共价键非常稳定,Ce6 难以从纳米载体脱附。因此,先制备氨基修饰的Fe3O4@mSiO2纳米球,然后通过酰胺键负载Ce6,最终制得供体球。
Fe3O4@mSiO2-NH2纳米球的制备:取3 支50 mL 的离心试管,在每支离心试管中分别加入30 mL的乙醇并将60 mg 的Fe3O4@mSiO2纳米球分散于其中,然后滴加30 μL 的APTES,室温下在转盘上以60 r·min-1的转速转24 h,然后混合3 支试管中的分散液并用磁铁分离产物,用乙醇和水洗涤,即制得Fe3O4@mSiO2-NH2纳米球。
酰胺缩合法制备Fe3O4@mSiO2-Ce6 纳米球作为供体球:在50 mL 离心试管中加入25 mL 的DMF并将50 mg 的Fe3O4@mSiO2-NH2纳米球分散于其中,再加入19 mg 的HATU、30 mg 的Ce6、53 μL 的DIPEA,室温下在转盘上以60 r·min-1的转速转24 h,然后用磁铁分离产物,并用DMF 和水各洗涤3次,即得供体球。
制备对照Fe3O4@mSiO2-COOH 纳米球:在50 mL 离心试管中加入20 mL 的DMF 并将100 mg 的Fe3O4@mSiO2-NH2纳米球分散于其中,再加入100 mg 的丁二酸酐和128 μL 的DIPEA,室温下在转盘上以60 r·min-1的转速转24 h,然后用磁铁分离产物,并用DMF 和水各洗涤3 次,即得Fe3O4@mSiO2-COOH 纳米球。
1.4 光激化学发光的检测
为检测上述方法制得的供体球与受体球的光激化学发光性能,用兔IgG 和羊抗兔IgG 作为模型抗原与抗体,检测兔IgG 修饰供体球和羊抗兔IgG 修饰的供体球之间的光激化学发光。
受体球标记:在15 mL 的离心试管中加入5 mL的pH = 6.5、浓度为50 mmol·L-1的MES 缓冲溶液并将5 mg 受体球分散于其中,再加入1 mg 的NHS和0.5 mg 的EDC,在转盘上以60 r·min-1的转速转20 min 后,再以13 000 r·min-1的速度离心20 min,弃上清液,沉淀分散于5 mL 的PBS 中,然后加入0.5 g的羊抗兔IgG,在转盘上以60 r·min-1的转速转2 h,再加入浓度为0.1 mol·L-1的乙醇胺溶液0.5 mL 和10 mg 的BSA,在转盘上以60 r·min-1的转速继续转1 h 后,再以13 000 r·min-1的速度离心20 min,弃上清液,沉淀分散于5 mL 的PBS 中,即制得羊抗兔IgG 修饰的受体球。将上述方法中的羊抗兔IgG 改为BSA,制得BSA 修饰的受体球。
供体球标记:在15 mL 离心试管中,将5 mg 供体球分散于5 mL 的pH = 6.5、浓度为50 mmol·L-1的MES 缓冲溶液中,再加入1 mg 的NHS 和0.5 mg的EDC,在转盘上以60 r·min-1的转速转20 min,用磁铁分离供体球,弃上清液,沉淀分散于5 mL 的PBS 中,然后加入0.5 g 的兔IgG,在转盘上以60 r·min-1的转速转2 h,再加入浓度0.1 mol·L-1的乙醇胺溶液0.5 mL 和10 mg 的BSA,继续在转盘上以60 r·min-1的转速转1 h,用磁铁分离供体球,弃上清液,沉淀分散于5 mL 的PBS 中,即制得兔IgG 修饰的供体球。将上述方法中的兔IgG 改为BSA,制得BSA 修饰的供体球。
孵育与测试:兔IgG 修饰的供体球和羊抗兔IgG 修饰的受体球各取2 mg 在15 mL 离心试管中混合孵育,分散液总体积为4 mL,作为阳性样品。BSA 修饰的供体球和BSA 修饰的受体球各取2 mg在15 mL 的离心试管中混合孵育,分散液总体积为4 mL,作为阴性样品。孵育时间为4 h,孵育方式为在转盘上以60 r·min-1的转速转动。利用成都爱兴生物科技有限公司的均相化学发光免疫分析仪分别检测阳性样品和阴性的样品在磁分离前后的光激化学发光。磁分离操作,孵育完成后将永磁体(N52 型钕铁硼磁铁)置于离心试管侧壁,磁吸30 s 后倒出上清液,加入PBS 定容至4 mL,振荡使之重新分散。测试条件,总体积200 μL,供体球浓度0.1 mg·mL-1,磁分离前受体球浓度0.1 mg·mL-1,激发波长为 680 nm,发射波长为 615 nm。
2 结果与分析
2.1 受体球
2.1.1 受体球纳米载体
为制得形貌呈规则球形、尺寸均一的PS 纳米球,并在PS 纳米球上修饰尽可能多的羧基,探究了丙烯酸加入时间与加入量对产物形貌与尺寸的影响。
图3 为不同条件下制得的PS-COOH 纳米球的SEM 图像。从图3 可见:开始反应3 h 后加入丙烯酸,所得的产物形貌不佳,尤其是丙烯酸加入量达到0.4 mL 时产物形貌不规则且尺寸不均一;开始反应6 h 后加入丙烯酸,所得的PS-COOH 纳米球形貌最好;开始反应9 h 后加入丙烯酸,所得产物形貌也不如开始反应6 h 后加入丙烯酸的。结果表明,丙烯酸会干扰苯乙烯的聚合反应,所以过早或过多加入丙烯酸会影响产物的最终形貌。开始反应3 h 后就加入丙烯酸,此时体系中的纳米球生长时间太短,后续的生长被干扰,导致形貌不佳;开始反应6 h 后加入丙烯酸,此时PS 成核已经完成,体系中已形成大量尺寸均一的纳米球,丙烯酸加入后只影响后续生成的壳层,对整体形貌影响不大;开始反应9 h 后才加入丙烯酸,此时体系中剩余的苯乙烯不多,单体混合物中丙烯酸占比更高,更容易干扰反应,导致形貌略差。由此可确定,丙烯酸的最佳加入时间为开始反应6 h 后,最佳加入量为0.2 mL。从图3 还可见,为制得粒径约为200 nm 的PS-COOH 纳米球,PVP 加入量对产物形貌及尺寸有影响。随着PVP 浓度增大,产物尺寸减小,当PVP 加入量为380 mg 时产物粒径满足要求约为200 nm。该结果与理论预期一致,这是因为PVP 作为表面活性剂降低了PS 和水相之间的界面能,使得成核的能垒更低而导致成核更多,所以PVP 的加入量越多,产物尺寸越小。
图4 为用丙烯酸和丙烯酸钠制得的PS-COOH纳米球的SEM 图。从图4 可见,用丙烯酸(0.2 mL(2.9 mmol))制得的PS-COOH 纳米球在较高浓度下团聚严重,用丙烯酸钠(0.274 g(2.9 mmol))代替丙烯酸,成功制备了新的PS-COOH 纳米球,该纳米球分散性明显改善,未见团聚现象。结果表明,丙烯酸根离子代替丙烯酸分子与苯乙烯共聚,产物分散性更好。经多次清洗后,用丙烯酸钠组纳米球分散液中的Na+大部分被洗出,两种产物的表面羧基相同,因此丙烯酸组纳米球的团聚发生在制备过程中而非制备完成后。V-50 是阳离子引发剂,在加入丙烯酸或丙烯酸钠之前,纳米球表面带正电,加入丙烯酸或丙烯酸钠后,随着丙烯酸或丙烯酸根离子与苯乙烯共聚,纳米球表面电荷开始由正转负。丙烯酸是弱酸,在水溶液中不能完全电离,因此丙烯酸组纳米球表面电荷由正转负需要很长的时间,在表面电荷过零期间,由于没有足够的静电斥力维持胶体稳定性,纳米球极易团聚;而丙烯酸钠是强电解质,以离子的形式参与反应,因此丙烯酸钠组纳米球的表面电荷快速过零,纳米球在团聚发生前就已被负电荷排斥开。
综上所述可知,制备受体球纳米载体的最佳参数为PVP 加入量380 mg,开始反应6 h 后加入0.274 g 的丙烯酸钠。按此参数成功制得了形貌呈规则球形、尺寸均一、在水中分散性好、不易团聚的PS-COOH 纳米球,该纳米球作为受体球纳米载体。
2.1.2 负载染料后的受体球
图5 为未去除残留染料和去除残留染料后的受体球的SEM 图。从图5 可见:未离心去除残留染料的样品,其中有大量未进入纳米球内的残留染料固体颗粒;离心去除残留染料后的样品,受体球分散液中未进入纳米球内的残留染料已被成功去除。这是由 于CH2Cl2的 密 度(1.325 g·cm-3)明 显 大 于PS(1.05 g·cm-3),染料固体的粒度远大于PS-COOH纳米球,所以离心能将CH2Cl2和残留染料去除。由于PS-COOH 纳米球密度仅略大于水,且粒径只有200 nm,需要11 000 r·min-1的转速离心30 min 方可从水相中分离,因此5 000 r·min-1的转速离心2 min对PS-COOH 纳米球无明显影响。
图6 为受体球的SEM 和TEM 图。从图6 可见,溶胀前后纳米球的形貌无明显变化,受体球呈规则的球形且尺寸均一,粒径约为200 nm,分散性好,未见团聚,解决了现有的商用光激化学发光受体球形貌差、单分散性差的问题。溶胀法负载染料,本质是萃取,固态的聚合物纳米载体与溶胀剂接触而体积膨胀使分子间空隙增大,染料分子得以进入聚合物纳米载体内部,即染料被固态的纳米载体从液相中萃取而形成固溶体。受体球作为固溶体,溶剂是PS,溶质是Eu(DBM)3Phen 和PCU,要得到这样的固溶体,需要PS 与溶有Eu(DBM)3Phen 和PCU 的CH2Cl2接触,但是PS 易溶于CH2Cl2,持续接触会造成PS 被部分溶解使纳米载体变形,因此本文采用三相体系,溶有染料的CH2Cl2分散在水中形成两个液相,再加上PS 共三相,溶胀过程中PS 断断续续与溶胀剂接触,避免了变形,保持了规则的球形和均一的尺寸。
图7 为受体球的紫外-可见光吸收谱和荧光发射光谱。从图7 可见,在光谱中存在Eu(DBM)3Phen的特征峰,表明体系中存在Eu(DBM)3Phen。
通过紫外-可见光吸收谱和荧光发射谱无法证明Eu(DBM)3Phen 作为固溶体的溶质均匀分散在PS-COOH 纳米载体中,也无法证明PCU 的存在,因此还需要进一步表征。由于PCU 含有硫元素,Eu(DBM)3Phen 含有铕元素,而PS-COOH 不含这两种元素,因此用EDS 能谱表征受体球。图8 为PS-COOH 纳米球和受体球的EDS 能谱图。从图8可见,与空白PS-COOH 相比,受体球可见均匀分布的硫元素和铕元素的信号,表明硫氧杂环己烯衍生物PCU 和铕螯合物Eu(DBM)3Phen 负载成功,两种染料作为固溶体的溶质均匀分散在PS-COOH 纳米载体中。表明,受体球制备成功。
2.2 供体球
2.2.1 供体球纳米载体
对供球体进行表征,其结果如图9—11 所示。
2.2.1 .1 Fe3O4纳米球的表征
用马尔文粒度仪测出Fe3O4纳米球的Zeta 电位为+20.8 mV(见图9(a)),Fe3O4作为弱碱性物质,在没有阴离子配体修饰的情况下在水中应带正电,因此该结果与理论预期相符。FTIR 吸收光谱显示,Fe3O4纳米球在588 cm-1处有一个强吸收峰,这是Fe—O 键的特征吸收峰(见图9(b))。SEM 图像(见图10(a))和TEM 图像(见图10(b)(c))显示,Fe3O4纳米球呈规则的球形,平均粒径约为700 nm,Fe3O4纳米球是由许多小晶粒团聚而成的多晶。EDS 能谱图显示,产物含有大量Fe 元素和O 元素(见图11(a))。综上可知,Fe3O4纳米球制备成功。

图1 酶联免疫吸附检测法和光激化学发光免疫检测法原理示意图Figure 1 Schematic illustration of ELISA and AlphaLISA
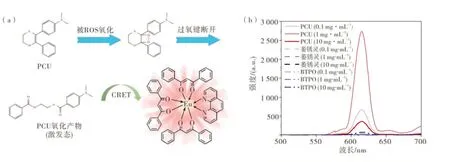
图2 PCU-Eu(DBM)3Phen 化学发光体系的发光机制示意图和化学发光谱图Figure 2 Schematic illustration and spectrum of PCU-Eu(DBM)3Phen chemiluminescent system

图3 不同条件下制得的PS-COOH 纳米球的SEM 图像Figure 3 SEM images of PS-COOH nanospheres prepared at different conditions

图4 用丙烯酸和丙烯酸钠制得的PS-COOH 纳米球的SEM 图像Figure 4 SEM images of PS-COOH nanospheres prepared by acrylic acid and sodium acrylate respectively

图6 受体球的SEM 与TEM 图像Figure 6 SEM and TEM images of ABs
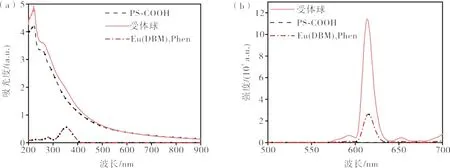
图7 受体球的紫外-可见光吸收谱和荧光发射谱Figure 7 UV-Vis absorption spectrum and fluorescence emission spectrum of ABs

图8 PS-COOH 纳米球和受体球的EDS 能谱图Figure 8 EDS of PS-COOH nanospheres and ABs
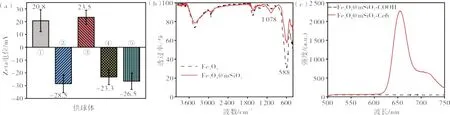
图9 供体球的Zeta 电位、红外光谱及荧光发射谱图Figure 9 Zeta potential values, IR spectrum and fluorescence emission spectrum of DBs

图10 Fe3O4纳米球和Fe3O4@mSiO2纳米球的SEM 与TEM 图像Figure 10 SEM and TEM images of Fe3O4 nanospheres and Fe3O4@mSiO2 nanospheres

图11 Fe3O4纳米球Fe3O4@mSiO2纳米球的EDS 能谱图Figure 11 EDS of Fe3O4 nanospheres and Fe3O4@mSiO2 nanospheres
2.2.1 .2 Fe3O4@mSiO2纳米球的表征
用马尔文粒度仪测出Fe3O4@mSiO2纳米球的zeta 电位为-28.5 mV(见图9(a)),SiO2作为弱酸性物质,在水中应带负电,因此该结果与理论预期相符,表明SiO2壳层包覆成功。FTIR 吸收光谱显示,Fe3O4@mSiO2纳米球在1078 cm-1处有一个吸收峰,这是Si—O—Si 的非对称伸缩振动吸收峰(见图9(b))。SEM 图像(见图10(d))和TEM 图像(见图10(e)(f))显示,Fe3O4@mSiO2纳米球呈规则的球形,分散性好,不易团聚。 TEM 图像显示,Fe3O4@mSiO2纳米球有明显的介孔SiO2壳层(见图10(e)(f))。EDS 能谱图显示,产物含有Si 元素,Si元素的分布呈明显的壳层状,包覆在Fe3O4表面(见图11(b))。综 上可知,Fe3O4@mSiO2纳 米球制 备成功。
2.2.2 负载光敏剂后的供体球
2.2.2 .1 Fe3O4@mSiO2-NH2纳米球的表征
用马尔文粒度仪测得产物的Zeta 电位为+23.5 mV(见图9(a)),由于氨基呈碱性,在水中应带正电,因此该结果与理论预期相符,表明氨基修饰成功。
2.2.2 .2 供体球和Fe3O4@mSiO2-COOH 纳米球的表征
用马尔文粒度仪测得供体球及Fe3O4@mSiO2-COOH 纳米球的Zeta 电位分别为-23.3 和-26.5 mV(见图9(a)),与理论预期相符。这是由于Ce6带有3 个羧基,其中一个与氨基缩合,另外两个暴露于水中而带负电。供体球的荧光发射谱明显可见Ce6 的特征发射峰(见图9(c)),表明体系中存在Ce6。由于Ce6 易溶于DMF,产物被DMF 洗涤后,未与纳米载体共价结合的Ce6 被洗出,因此产物的荧光只能来自于通过酰胺键负载于纳米载体的Ce6,表明Ce6 负载成功。综上所述可知,供体球制备成功。
2.3 光激化学发光
图12 为阳性样品和阴性样品在未分离和磁分离后的光激化学发光信号。从图12 可见:不用磁分离去除未结合和非特异性结合的受体球时,测得阳性样品和阴性样品的光激化学发光信号强度分别为10 359 和9 988,两者相差不大,表明供体球能在光照下产生单线态氧,并且受体球在单线态氧的作用下能发光,但是供、受体球之间存在强烈的非特异性结合;阳性样品和阴性样品分别磁分离3 次去除未结合和非特异性结合的受体球后,测得阳性样品和阴性样品的光激化学发光信号强度分别为10 907 和1 755,阳性信号远大于阴性信号,表明磁控供体球能有效打散非特异性结合。抗原和抗体之间的特异性结合远强于探针之间的非特异性结合,因此可以做到让磁场力只能打散非特异性结合而不能打散特异性结合的程度,此时即可消除非特异性结合造成的误差。综上所述可知,基于磁颗粒的光激化学发光免疫检测探针材料制备成功。
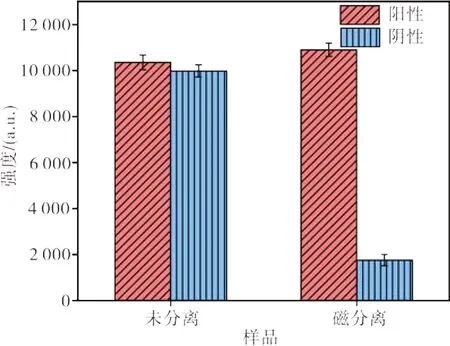
图12 阳性样品和阴性样品在未分离和磁分离后的光激化学发光信号Figure 12 AlphaLISA signals of positive and negative samples
3 结论
用苯乙烯-丙烯酸钠共聚法成功制得了PSCOOH 纳米球,作为受体球的纳米载体。PSCOOH 纳米球形貌呈规则的球形、尺寸均一,平均粒径约为200 nm,在水中易分散,不易团聚。以PSCOOH 纳米球作为载体,以硫氧杂环己烯衍生物PCU 作为化学发光剂,以铕螯合物Eu(DBM)3Phen作为荧光剂,用溶胀法成功制得了受体球。受体球在溶胀过程中形貌无明显变化,仍呈规则的球形、尺寸均一,平均粒径约为200 nm,在水中易分散,不易团聚。从受体球的EDS 能谱图中可见硫元素和铕元素,表明Eu(DBM)3Phen 和PCU 负载成功。
用溶剂热法成功制得了Fe3O4纳米球,然后包覆上了一层介孔SiO2壳,即成功制得了Fe3O4@mSiO2纳米球,作为供体球的纳米载体。Fe3O4@mSiO2纳米球呈球形核壳结构,平均粒径约为700 nm,在水中易分散,不易团聚。以Fe3O4@mSiO2纳米球作为载体,在修饰氨基后用酰胺缩合法成功制得了负载光敏剂Ce6 的供体球。
用兔IgG 和羊抗兔IgG 作为模型抗原与抗体,用市场化的均相化学发光免疫分析仪成功检测到了兔IgG 修饰供体球和羊抗兔IgG 修饰的供体球之间的光激化学发光信号。表明,供体球能在光照下产生单线态氧,受体球在单线态氧的作用下能发光,供体球与受体球均已制备成功。磁分离后,阳性样品的光激化学发光信号远高于阴性样品,表明磁控供体球在磁场作用下能有效打散非特异性结合。综上所述可知,成功制得了基于磁颗粒的光激化学发光免疫检测探针材料。
光激化学发光免疫检测材料成功解决了免疫检测需要繁琐的清洗操作、背景荧光干扰等问题,也解决了传统光激化学发光免疫纳米探针单分散性差、非特异性结合干扰检测的问题。
4 展望
探针材料还有许多改进空间,如非特异性结合还需要进一步降低、灵敏度还能进一步提高,供体球的单分散性和光敏效率还有所欠缺,检测条件还未优化,未来还需展开以下研究。
(1)优化制备受体球的溶胀条件,包括溶剂的种类与体积、染料的浓度、溶胀时间、表面活性剂的种类与浓度等参数,以制得发光效率最高的受体球。
(2)采用核壳结构的Fe3O4@mSiO2纳米球作为供体球的纳米载体,但是该纳米载体的介孔SiO2壳层太薄,只有10 nm 左右,从而使负载光敏剂的量较少,导致光敏效率还有提高的空间,此外该供体球虽然呈规则的球形,但单分散性比受体球差,Fe3O4@mSiO2纳米球的制备方案有待优化,增大介孔SiO2壳层的厚度,负载更多的光敏剂,以增大灵敏度,制得兼顾磁性和光敏性的磁控供体球。
(3)搭建检测平台,该平台由磁控系统、光学系统和信息处理系统构成。光学系统包括光源、滤光片和检测器,要求光源功率足够激发供体球,滤光片能有效滤除化学发光信号波长以外的各种光,包括纳米分散液强烈的散射光和生物基质的背景荧光,检测器能检测到微弱的化学发光信号。磁控系统包括三维亥姆霍兹线圈和微流控芯片,要求该平台能输出指定的变化磁场,比如指定强度与频率的旋转磁场,并且在缓冲溶液及血液等生物基质中能驱动磁控供体球,并准确操控其在芯片中集群运动,包括混合、旋转、聚集与打散。信息处理系统将光信号转化为电信号,再转化为数字信号输出,探究孵育时间、抗原与各探针的浓度、磁场等参数对检测的影响,找出最佳的参数,以此优化检测条件,将信噪比提升至最高。
(4)将上述系统集成为单一设备,并用于实际生物样品的检测。
纳米材料由于比表面积大、表面能高,存在自发的团聚与沉降倾向,还容易吸附生物基质中的蛋白质,这些非特异性结合是所有纳米材料的共同局限性,是所有应用于生物医学检测的纳米材料面临的共同难题。利用磁力打散非特异性结合,有望解决该问题。因此,将磁控纳米马达与光激化学发光免疫检测探针材料相结合,是光激化学发光免疫检测法将来的创新突破发展方向之一。光激化学发光免疫检测探针材料有望广泛用于POCT,可用于大范围大规模筛查,还可用于居家自测,在传染病流行期间能缓解医疗挤兑、减少院内感染,在生物医学检测领域中有广阔的前景。
