锂/钠离子电池中铁基氟化物正极材料的研究进展
2023-11-21朱树豪姚锐肖承翔朱浩杰杨诚
朱树豪,姚锐,肖承翔,朱浩杰,杨诚
(清华大学材料研究院, 清华大学深圳国际研究生院 , 深圳 518055)
0 引言
化石燃料一直以来对推动人类社会和工业的发展发挥着重要作用,但由于其自身不可再生,以及地球储量有限和伴随着的环境污染问题,一直以来是人类不得不面对的挑战[1]。在寻求可再生能源的道路上,锂离子电池应运而生,并在上个世纪九十年代率先实现商业化。锂离子电池使用的正极往往是 具 有 层 状 结 构(如LiMO2(M 为Co 和Ni)、LiNi1-x-yCoyAlxO2(NCA)、LiNi1/3Co1/3Mn1/3O2(NCM))及尖晶石结构(LiNixMn2-xO2(LNMO))和橄榄石结构(LiMPO4(M=Ni、Co、Mn、Fe))的材料[2]。纵观近几年快速商业化发展的钠离子电池,其正极材料也大多采用嵌入型结构的O3 型和P2 型[3]材料,但无论是钠离子还是锂离子电池的嵌入型正极材料,他们的理论容量都低于300 mAh·g-1。然而,与正极材料匹配的负极材料,除了石墨负极(372 mAh·g-1)之外,还 有锂金属负 极(3 860 mAh·g-1)、硅负极(4200 mAh g-1)[4]和 钠 金 属 负 极(1 166 mAh·g-1)[5]等材料的理论容量均远远超过嵌入型正极,所以要从根本上实现高能量密度锂/钠离子电池在3C 产品(计算机、通信、消费类电子产品)中的应用突破,主要挑战在于如何提升正极材料的电化学性能。
转化型电极材料,如氧化物[6]、硫化物[7]、氟化物[8],因为具有高的理论比容量而逐渐引起了研究人员的广泛关注。通常这些转化型材料都是通过以下电化学反应过程实现能量转化。
放电过程:MaXb+zY++ze-→bYz/bXaM
充电过程:aM+bYz/bX→MaXb+zY++ze-
其中,M 代表过渡金属元素、Y 代表锂或者钠、X 代表氧、硫或氟元素。该电化学反应是通过旧化学键的断裂和新化学键的生成,实现能量存储过程。其中,氟在自然界中储量丰富,氟析出电位很高(2.87 V vs SHE)而不用担心氟的腐蚀作用[9]。此外,氟拥有最强的电负性,赋予了氟化物材料更强的键能并表现在化学性能上,这使得理论反应电位更高(3 V vs Li+/Li、2.7 V vs Na+/Na)[10]。同时,因为金属氟化物可以发生多电子转移而有较高的理论容量,特别是三氧化铼型FeF3(1—4.5 V vs Li+/Li、712 mAh·g-1,2—4.5 V vs Li+/Li、237 mAh·g-1)和金红石型FeF2(570 mAh·g-1),因为铁元素本身的原材料价格低廉及多电子转移所带来的高容量,引起了研究人员的广泛关注。但是氟的强电负性会导致其所形成的FeF3和FeF2自身的电子电导率低,并且这两种正极材料在充电和放电过程中体积变化大,以及伴随着较大的电压滞后,致使两种氟化物在电池中的应用受限。
本文将介绍现阶段铁基氟化物正极材料在锂/钠离子电池中所存在的问题,并从本征和非本征调控策略两方面总结了近年来改善铁基氟化物的改性策略,最后对铁基氟化物的未来发展方向做出了展望。
1 现阶段存在的问题
铁基氟化物转化型正极材料,因其理论容量高和工作电位高等优势而受到电池领域内研究人员的广泛关注。现阶段,由于电子电导率差、电压滞后、以及巨大的体积变化等问题,在实际应用过程中会导致全电池的库伦效率和能量密度偏低,循环寿命和倍率性能等无法充分发挥。
1.1 电子电导率差
因为氟元素具有最强的电负性,导致其化合物FeF3(4.48 eV)[11]和FeF2(3.14 eV)[12]的带隙过大,表现出比较差的电子电导率[13]。在FeF2和FeF3的材料锂化以后,会偏析出电子绝缘的LiF,因此导致其具有较差的电化学性能[14-15]。此外,也有研究表明[16],FeF3正极在经过放电以后,结构中铁纳米颗粒弥散分布在LiF 当中,从而形成导电网络,这也解释了在充电过程中也存在容量贡献。为弥补自身不足,往往需要从本征结构和同其他导电性良好的材料复合改善其导电性。
1.2 电压滞后
电池中导致电压滞后的原因通常有3 种,分别为欧姆极化、电化学极化和浓差极化[17]。欧姆极化,来源于集流体、电极材料、电解质、隔膜等。电化学极化,主要看电极材料的化学反应动力学,受限于电子在电极材料体相中的传输速率。浓差极化,是由电极材料和电解质界面的离子扩散速率决定的。在铁基氟化物放电得到金属和LiF 的两相混合物以后,由于铁纳米颗粒自发团聚,且LiF 电子绝缘,这会导致在随后的充电过程中离子会沿着同放电过程不同的相变路径扩散[16]。此外,活性物质的不均匀分布也会增加电压滞后[18]。因此,电压滞后在电化学性能中表现出较差的循环和倍率性能,导致电池的能量密度下降。
1.3 体积膨胀大
传统的嵌入型正极材料具有比较小的体积应变,甚至是零应变[19]。而转化型材料在充放电的时,由于发生化学键的断裂和新键的生成,必然会导致巨大的体积变化[20]。在该过程中,伴随着不断重复的体积变化,使活性物质材料粉化而从集流体上面脱落。同时,活性物质巨大的体积变化也会诱导电极表面重复形成固态电解质界面(CEI),导致电解液不断被消耗。这些劣势都会导致电池内部阻抗升高,表现出较大的电压极化,从而降低了电池的能量密度和循环寿命。
2 潜在的解决方案
2.1 本征调控
2.1.1 阴离子取代
因为铁基氟化物本身的电子电导率较低,通常需要通过掺杂的方式来改善其导电性能。阴离子取代往往可以改变金属和晶体场的电子状态,以及改变结构和物化性质,其中的离子键和价态的变化会导致其表现出与金属氧化物或氟化物不同的性质[21]。在FeⅡ1-xFeⅢxOxF2-(xx=0—1)中,Fe—O 键会具有较高的电子电导率[22-23],这极大地改善了铁基氟化物材料的电化学性能。其中,与FeF2结构类似的具有金红石结构的FeOF(x=1)的理论容量达到了885 mAh·g-1,比FeF2和FeF3的理论容量要高得多[24]。在反应机理上,氟氧化铁类似于BiOxF3-2x化合物[25],作为锂离子电池正极比FeF2具有更优异的循环稳定性和放电容量[23]。
Deng 等[26]通过简单高效的溶剂热的方法,利用FeF3·3H2O 合 成 了 纯 相 的FeOF 纳 米 棒,并 揭 示 了可能的形成机理。利用该方法合成的FeOF 组装钠离子电池,在放电的时候遵循如下反应。
该钠离子电池在10 和20 mA·g-1的电流密度下循环20 圈后仍然能保持在 250 和210 mAh·g-1的可逆比容量。此外,其他不同氧取代含量的氟氧化铁也有报道,均表现出较好的电化学性能[27]。
2.1.2 阳离子掺杂
Wang 等[28]在FeF2中引入铜离子,两种阳离子的相互协同作用显著改善了铁基氟化物电压滞后的不足(见图1(a)—图1(b))),结果表明:具有金红石结构的CuF2和FeF2混合球磨得到CuyFe1-yF2单相固溶体,其在放电的时候有两个明显的还原平台,Cu2+还原为Cu 金属,随后Fe2+在较低电位下还原为Fe 金属;在充电过程中,Fe 又被氧化成Fe2+,随后Fe2+与Cu 同时氧化成Fe3+和Cu2+,Cu2+到Cu 金属转变过程中的高放电平台,以及CuyFe1-yF2比CuF2具有更低的电压滞后(<150 mV),说明阳离子取代可能为调节转化电极的关键电化学性能提供了新的途径(见图1(c))[28]。Yushin 课题组[29]合成了一系列混合金属二氟化物正极材料(NiyFe1-yF2、CoyFe1-yF2、MnyFe1-yF2),结果发现:混合金属二氟化物可以在一个步骤中发生还原,还原电位介于相应的单金属二氟化物之间;对于在充放电过程中经历最大电压滞后和最大容量衰减的化学物质,电荷转移电阻的增长幅度最大,这意味着电压迟滞增长和容量衰减可能主要由循环初期的电荷转移阻抗控制,并且在反复的锂化和脱锂过程中恶化,不利于电荷传输的CEI 形成可能是这种阻力的原因。Yushin等[30]又进一步探究了NixFe1-xF 电化学性能衰减的机理,将Ni 引入到FeF2中虽然可以提升电极材料在初始循环过程中的放电容量,但电池在循环的过程中因为生成较厚的CEI 而导致电荷转移阻抗变大,致使容量快速衰减,该研究还表明在电化学循环的过程中原位生成的LiNiO2会诱导电解液和CEI 分解,这为日后选择合适的阳离子掺杂和电解液优化提供了见解。

图1 CuyFe1-yF2的结构和在充放电过程中的结构演变[28]Figure 1 The structure and phase transition of CuyFe1-yF2 during discharge ang charge
近年来,高熵材料在储能领域取得一系列的研究进展[31-33]。高熵材料的概念来源于高熵合金材料,是通过将5 种或者5 种以上元素引入到单相的材料中,其产生的鸡尾酒效应往往可达到意想不到的结果[34]。高熵概念可以引入到氟化物电极材料中,通过5 种以上阳离子共掺杂开发高性能的高熵氟化物材料[35]。得益于其独特的高熵稳定特性,Cu、Ni、Fe、Zn、Co 共掺的固溶体氟化物(Cu1/7Ni1/7Fe1/7Zn1/7-Co1/7Mn1/7Mg1/7)F2表现出比其他比例的样品更优异的电化学循环稳定性。
2.1.3 阴阳离子共掺杂
王春生课题组[36]通过溶剂热的方法在FeF3中引入Co 和O,分别取代Fe 和F 的位置,显著改善了反应动力学和结构稳定性,结果表明:Fe0.9Co0.1OF正极在70 mA·g-1的电流密度下循环300 次后仍具有1 000 Wh·kg-1的高能量密度和显著降低的0.27 V 电压滞后;在Co 和O 取代在金红石相到岩盐相的相变过程中,存在一个长时间的插层-挤压-阳离子无序化过程,这在微观上对应于Fe/Co-O/F 八面体的拓扑重排[37],在此过程中锂的扩散通道由3D 转变为2D,共角八面体转变为共边八面体;同时,DFT 计算 表明,Fe0.9Co0.1OF 阴极的Co 和O 共掺 杂可以提高其结构稳定性。
利用电镀法和阳极化处理可以得到同源钝化膜覆盖的NiFeOF 多孔薄膜[38],该材料可以有效地缓解过渡金属阳离子分离和溶解,以及在理化和脱锂过程中材料的体积变化。其应用在锂离子电池中,可在100 mA·g-1的电流密度下循环1000 圈,库伦效率接近100%且容量保持率为88%。
2.1.4 铁基氟化物水合物
FeF3本身因为结构致密具有较低的离子电导率,不利于离子在体相中扩散[18]。在FeF3中引入结构水,可以构造更加开放的离子传输通道,比如具有六方钨青铜结构的FeF3·0.33H2O 和具有烧绿石结构 的FeF3·0.5H2O。在FeF3·0.33H2O 中,Fe-F 构造的八面体以水分子为中心通过共角连接,构造出可以便于锂离子快速传输的六方形通道[39-40]。由单晶八边形薄片组成的多级结构的FeF3·0.33H2O 应用在锂电正极能够在20 mA·g-1的电流密度下循环100 圈,并且容 量保持 在166.9 mAh·g-1[41]。不同于FeF3·0.33H2O,FeF3·0.5H2O 的六边形通道可以形成三维多孔结构,并且通道中的结构水呈现“之”字形排列,更便于锂离子和钠离子传输[42-43]。通过将还原石墨烯和FeF3·0.5H2O 复合之后应用于钠离子电池,能够在电流密度11 mA·g-1下表现出266 mA·g-1的放电容量,并且循环100 圈以后容量保持大 于86%[44]。图2 为FeF3、FeF3·0.33H2O 和FeF3·0.5H2O 的晶体结构图[40,45]。
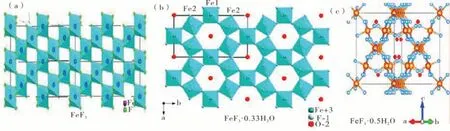
图2 FeF3、FeF3·0.33H2O 和FeF3·0.5H2O 的晶体结构图[40,45]Figure 2 Crystal structure of FeF3, FeF3·0.33H2O and FeF3·0.5H2O
2.2 非本征调控策略
针对铁基氟化物本身电子电导率较低、同电解液的副反应及存在较大的电压极化等缺点,可利用区别于非本征的调控策略,比如电解液改性及对电极表面包覆或同导电碳材料复合,实现电化学性能的改善。
2.2.1 电解质改性
通过对电解液的组分和浓度调控,分析了电解液对FeF2正极的可逆容量、循环稳定性、倍率性能和电压极化等多方面性能的影响。在比较了不同的锂 盐LiPF6、LiFSI 和 LiTFSI,以 及 溶 剂EMC 和DME 之后,发现3 mol·L-1的LiFSI/DME 电解液能够让FeF2发挥最优的电化学性能[46]。高浓度电解液可以防止活性物质的溶解,提升电极材料的循环稳定性。具有自支撑结构的FeF3-C 纳米复合纤维材 料,在 4.6 mol·L-1的LiFSI/DME 高 浓 度 电 解 液中,循环400 圈后容量基本保持在500 mAh·g-1[47],将该电解液应用于Li-FeF2电池,在140 mAh·g-1的电流密度下循环100 圈容量仍具有300 mAh·g-1。但是,高浓度的电解液往往会具有较大的粘度,从而降低本身的离子电导率,表现出较大的电压极化。
Ogumi 等[48]首次将硼基阴离子受体作为电解液添加剂应用于FeF3-Li 电池,指出:硼基阴离子受体(如三(五氟苯基)硼烷(TPFPB)和三(1H,1H 七氟丁基)硼酸盐(THFBuBO))因硼的存在,增强了本身的路易斯酸作用、促进了LiF 的解离、提升了FeF3的循环性能;由于TPFPB 具有刚强的吸电子作用更容易溶解LiF,然而在循环时因为强氟离子亲和力使氟离子更难从[TPFPB-F]-中释放出来,表现出比加入THFBuBO 略差的循环性能。但是,有报道[49]指出,阴离子受体作为一种强路易斯酸,不当使用会使氟化物电极溶解而导致较差的电化学性能,这一点在氟离子电池中尤为明显,而电解质中的氟盐达到饱和可以明显地抑制活性物质溶解。李驰麟等[27]将阴离子受体TPFPB 溶解到LiTFSI-DME中,使溶解LiF 达到饱和,通过固液转化机制提高了氟氧化铁的反应动力学(见图3),结果表明:TPFPB可以促进LiF 的裂解和Fe 纳米颗粒重新结合,避免了缓慢的固-固转化机制;FeO0.3F1.7和FeO0.7F1.3正极利用该电解液体系,表现出优异的倍率性能,而且在100 mA·g-1的电流密度下循环100 圈,容量分别为472 mAh·g-1和484 mAh·g-1。

图3 TPFPB 和LiF 的作用机理及FeO0.3F1.7和FeO0.7F1.3的倍率性能和循环性能[27]Figure 3 The interaction mechanism of TPFPB and LiF, and the rate performance and cycle performance of FeO0.3F1.7 and FeO0.7F1.3
近年来,固态电解质因为可以解决碱金属电池枝晶生长导致的安全问题而被广泛研究。固态电解质可以避免铁基氟化物材料的溶解而提高循环稳定性,有机固态电解质因为高柔性和较低的界面阻抗而颇具吸引力。以具有柔性的LiTFSI/PEO 薄膜作为固态电解质,将该电解质、FeF2和CNT 复合得到柔性的复合正极材料,且该固态电解质可以在正极表面原位生成弹性、薄且均匀的CEI(见图4(a)),该复合正极在50 ℃的高温和50 mA·g-1的电流密度下循环100 圈容量保持在450 mAh·g-1(见图4(b)—图4(c))[50]。转化型正极匹配无机固态电解质,比如卤化物基和石榴石型固态电解质也表现出较好的电化学性能[51-52]。Han 等[51]发现,相较于晶态FeF2,非晶态FeF2匹配卤化物固态电解质Li3YCl6在倍率性能上要比晶态FeF2更为优异,且在60 ℃的高温条件和0.1 C下循环100圈容量基本保持在600 mAh·g-1。李驰麟等[52]为克服锂/钠金属无法在Li7La3Zr2O12(LLZO)固态电解质表面润湿以降低界面阻抗的不足(见图4(d)),制备了具有良好润湿性的锂-钠合金负极(见图4(e)—图4(h)),该Li-Na/LLZO/FeF3电池表现出良好的电化学性能,在50 μA·cm-2活化并在200 μA·cm-2的电流密度下循环100 圈后仍然具有200 mAh·g-1的可逆容量。李驰麟课题组[53]还通过将具有强路易斯酸性质的介孔AlF3同PEO 复合得到复合电解质,结果表明:介孔AlF3促进了对TFSI-的吸附作用,使得Li+迁移数达到0.67(见图4(f));另外,固体电解质中的氟化界面可以提供额外的氟源补充FeF3正极在反应中的氟损失,提高了自身电化学转化可逆性;该固态电解质匹配锂金属和FeF3能够实现900 圈的超长循环,在倍率性能上也十分优异(见图4(g)—图4(h));组装的软包电池能够在110 mA·g-1的电流密度下循环100 次仍具有超 过400 mAh ·g-1的 可 逆 容 量(见 图4(i)—图4(j))。
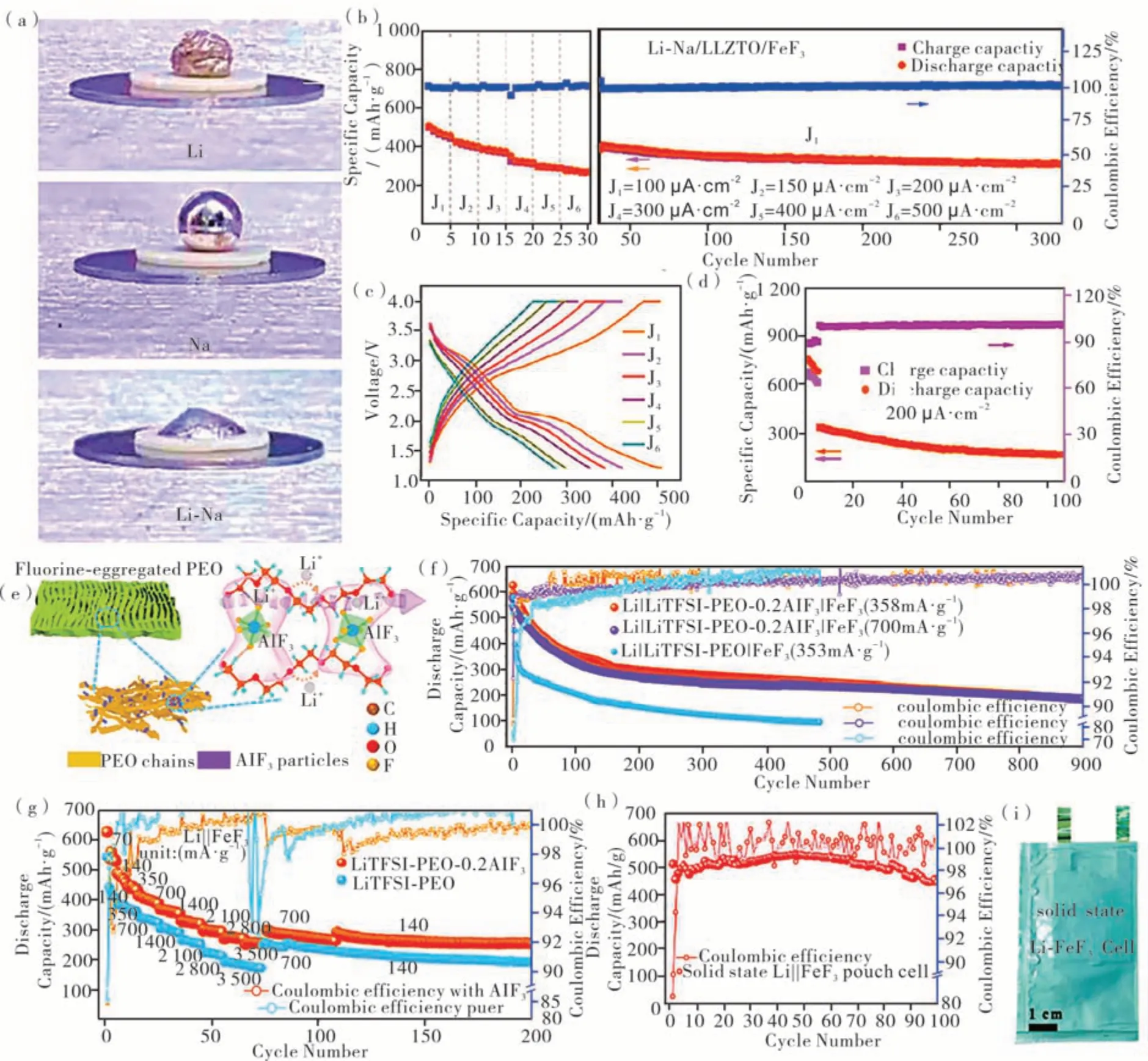
图4 固态电解质同FeF3匹配及表现出的电化学性能Figure 4 Solid electrolyte matches with FeF3 and the corresponding electrochemical performance
2.2.2 与碳材料复合
由于铁基氟化物本身的电子电导率较低,往往采用与碳材料复合的方法来改善电子传输。在由导电碳纳米片和纳米级别的FeF3颗粒组成的三维(3D)蜂窝状限域结构中,导电碳墙提高了正极的电子传输速率(见图5(a—c))[54]。由于FeF3纳米颗粒上被碳均匀包覆,防止了FeF3同电解液直接接触,即使是在高载量(5.3 mg·cm-2),该材料在15 C 的电流下具有超过100 mAh·g-1的可逆容量,在5 C 电流密度下循环1 000 次容量保持78.5%(见图5(d—e))。
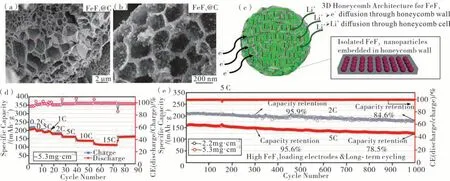
图5 FeF3和碳纳米片组成的蜂窝状结构复合材料以及在高载量下的倍率和循环性能[54]Figure 5 Honeycomb structure composites composed of FeF3 and carbon nanosheets and their rates and cycle performances under high load
具有自支撑结构的纳米材料,可以保证在电化学循环的过程中活性材料和聚合物粘结剂不从集流体中分离。Yushin 等[47]开发的具有自支撑结构FeF3-碳纳米纤维正极材料,在100 mA·g-1电流密度下循环400 次后容量保持率为100%(500 mAh·g-1),这种独特的自支撑结构可以将FeF3纳米颗粒均匀地限制在一个稳定的导电碳网络中,提供了快速的离子/电子传输通道,避免了FeF3纳米颗粒与集流体的不可逆分离。其他与碳材料复合的形式也有所报道,比如FeF2@碳纳米棒[55]及在碳纳米管表面形核FeF3实现异质生长[56],均起到了明显改善电化学性能的 作用。Huang 等[55]制备的FeF2和PVP 衍生碳的复合纳米棒在60 C 下循环500 圈能够具有107 mAh·g-1的可逆容量,这优异的循环稳定性得益于FeF2表面原位形成的Fe3O4可以阻止活性物质溶解以及电解液副反应。Kang 等[56]将CNT 用HF 处理得到可以FeF3·3H2O 形核的位点,FeF3·3H2O-CNT经过热处理后得到FeF3-CNT 异质结构,该正极材料因为CNT 构成的3D 导电网络,能够在500 mA·g-1的高倍率下表现出150 mAh·g-1的可逆容量。
3 结语
在电化学储能需求日益旺盛的背景下,开发具有高能量密度的电化学储能体系具有重大意义。转化型正极材料因其具有比嵌入型材料更高的理论比容量,在能量密度上更加占有优势,特别是廉价的铁基氟化物材料。但由于氟的强电负性,铁基氟化物表现出差的电子电导率,在充放电过程中伴随着化学键不断断裂和生成所导致的大体积变化会使正极上的材料粉化,从集流体脱落,以及活性物质的溶解等。这些不利因素都会导致电极材料表现出较大的电压滞后,在能量密度、库伦效率、循环性能上均不占优势。目前一些非本征的材料调控策略,比如与碳材料复合可极大地提高材料的导电性能,但是非活性物质过多也会降低电池的能量密度;电解液改性可以减少过渡金属的溶解,在电极表面构筑良好的CEI,保证电极材料电化学性能的稳定性。本征的调控策略,比如阴离子取代、阳离子掺杂以及阴阳离子共掺杂使材料的性能得到了有效提升。目前,充分发挥铁基氟化物正极材料的性能并加快其在商业化道路中的应用,仍要从电极材料和电解质设计两个方面进行调控:
为提高电池的质量比能量密度,应该尽可能减少非活性物质的使用,所以在改性过程中,更多地应该从材料的本征结构入手提高材料的电子电导率。在兼顾电子电导率的同时,也应注意开发具有利于离子传输的材料,特别是一些具有大尺寸隧道结构的正极材料。另外,在研究多金属氟化物或者氟氧化物的同时,要关注到金属阳离子对于电池性能发挥的作用以及反应机理。需要指出的是,目前铁基氟化正极材料的研究大多还是在低载量(1 mg·cm-2左右)下去评估其电化学性能,离满足商业化应用的载量要求(8—10 mg·cm-2)还有很大差距,仍然需要产学研界的研究人员相互配合,攻坚克难。
在电解质设计方面,已有报道表明组分和浓度对铁基氟化物的性能有显著影响。电解质在电极表面形成稳定的CEI 将会是正极材料稳定发挥电化学性能的关键,所以仍需利用理论计算和先进的原位表征技术在CEI 的形成机理和组分上多关注。另外,电解质添加剂阴离子受体的存在可以溶解放电产物LiF,绕过传统的固-固反应机制,提高反应动力学。除了液态电解质,有机固态电解质主要面临的问题是离子电导率低,较难实现电池在大电流下的充放电循环,而无机固态电解质因为本身同电极的固-固接触导致具有较大的界面阻抗及电压极化,所以两种固态电解质目前距离实际应用还存在一段距离。
