基于荧光检测的高通量筛选技术和装备助力细胞工厂构建
2023-11-21孙梦楚陆亮宇申晓林孙新晓王佳袁其朋
孙梦楚,陆亮宇,申晓林,孙新晓,王佳,袁其朋
(北京化工大学化工资源有效利用国家重点实验室,北京软物质科学与工程高精尖创新中心,北京 100029)
合成生物学是一门发展迅猛的前沿交叉学科,从早期仅是探究自然界中生命体合成化合物能力的认识阶段到分子生物学技术快速发展,从基因层面实现生命体局部功能改造与优化的改造阶段再到创造新“价值”生物系统的创造阶段[1]。经过多年积累和发展,合成生物学已经形成了相对成熟的理论系统,即以工程化思想为核心,设计和构建具有目标功能的人工生命系统。目前,合成生物学已广泛应用到在医药、化工、农业、食品、化妆品及绿色环保等领域。利用合成生物学技术构建和改造微生物细胞工厂,可以实现高附加值化学品、医药活性成分、石油燃料等产品的绿色生物合成[2-6]。目前,微生物细胞工厂开发依赖于“设计-构建-测试-学习”的DBTL(Design-Built-Test-Learn)循环[7]。但由于缺乏理性设计,当前仍需长期、反复的人工实验试错。
基于理性合成途径设计与非理性的进化工程相结合的方法,建立一套高效微生物工厂设计和构建策略是重要的研究方向。由于微生物代谢网络和调控机制的复杂性及基因型和表型偶联中“生命暗物质”大量存在,理性方式(如解析生理机制、构建基因操作体系、重构及改造代谢途径等)设计和构建微生物工厂耗时费力,有时甚至无效[8]。通过非理性的进化工程方式,利用生物信息学、代谢组学等分析方法从整体水平对复杂的代谢网络和调控机制中的未知信息进行挖掘和学习,实现原理标准化,从而高效指导微生物工厂的设计和构建[9]。具体而言,首先通过多种诱变方式构建一个非特异性的突变库;随后以特定性状作为筛选指标建立高通量筛选方法,利用先进的高通量筛选技术和设备,高效、快速筛选高产菌株;通过基因组、转录组、代谢组等数据处理方法比较分析高产菌株与野生型菌株之间的区别,寻找突变体高产的原因(功能基因变化、代谢网络调控变化、生命暗物质挖掘等);最后将诱导高产的原理应用到其他菌株,理性指导目标化合物的生产,从而实现原理普适化。
随着分子生物学技术和基因编辑技术的发展,突变方法从蛋白质到代谢通路再到基因组水平不断迭代创新,致使突变体库的规模巨大,增加了突变文库的筛选难度。为了加快DBTL循环,测试阶段需要与文库规模相匹配的高通量筛选技术。微孔板(microtiter plates, MTP)作为传统筛选方法,利用微升培养液中代谢物的光学变化进行检测分析,满足文库中变体重复检测、精准测定,同时也具备胞外代谢产物高产菌株筛选的能力[10]。但该筛选方法耗时且通量低。基于微孔板自动化工作站搭建很好地解决了微孔板筛选通量低的局限性[11]。然而,自动化设备昂贵、平台运行成本高,导致自动化工作站不具有普适性[12-14]。目前,高通量筛选主要方法是荧光激活细胞分选技术,它可以达到每秒约10万个细胞的筛选通量。然而,荧光激活细胞分选技术(FACS)应用仅限于检测细胞内目标产物相关的荧光信号或与膜结合的代谢物荧光信号,不能用于细胞外代谢物的细胞筛选[15-16]。液滴微流控技术很好地解决了这一问题,该技术将单细胞包埋和培养在单分散、皮升液滴中,每个液滴作为单独的微反应器[17]。这种区室化将胞外分泌产物与单细胞控制在液滴中,实现基因型与表型的偶联[18]。液滴微流控技术在微生物细胞选育及酶定向进化领域的应用,对庞大突变文库的筛选,筛选通量可达107个/天,有效提高了微生物工业菌株开发和酶定向进化工作效率,而且在实验成本方面也表现出极大优势,实现筛选通量高、成本消耗低的微生物细胞工厂开发及高活性酶变体筛选[19-20]。
本文结合具体案例综述了高通量筛选技术在工业微生物育种和酶定向进化领域应用的主要进展,首先介绍近几年兴起的微孔板高通量筛选自动化工作站及目前主流筛选技术——荧光激活细胞分选技术在高通量筛选中的原理和应用。然后,重点介绍液滴微流控技术的组成和特点,并介绍近年来FADS在工业微生物育种和酶定向进化领域应用案例。最后介绍目标分子与荧光信号偶联常见策略,并简单介绍目前国内外基于液滴微流控技术高通量筛选装备的研发情况。
1 基于微孔板的高通量筛选自动化工作站
微孔板筛选是一种传统且直接的高通量筛选方法。筛选要求是在微孔板容器中直接或间接测量目标代谢物或蛋白质特性,最常见的检测方式是通过分光光度法或荧光法[21]。通常实验流程如下:构建突变菌库;挑选单个菌落接种到微孔板中培养;在适宜的生长条件下孵育菌株及蛋白质表达,最终将每个培养物的上清液或细胞裂解物转移到新的微孔板以检测与产物、蛋白质功能相关的光学特性。总体而言,微孔板筛选是早期高通量筛选的常用方法,虽然微孔板筛选精准性、可重复性高于其他筛选技术,但其耗时费力且通量低,无法适配庞大突变文库的筛选工作。
近些年,基于微孔板自动化工作站的搭建完全模拟人工操作,将常规操作利用自动化设备代替,并结合机械臂完成中间步骤从而实现整体自动化(图1)。一般实验流程为:利用全自动培养基分装系统,实现600~800皿/h培养基分装;采用QPix系列等菌种自动挑选设备实现平板菌落向微孔板自动转移,该设备每小时挑取至少2000菌落,在挑取过程中能实现快速精准挑取,避免交叉污染风险;利用多通道全自动移液工作站,可实现每批次多达300块微孔板精准移液操作。自动化工作站的优点为完全模拟人工操作、筛选模型易于构建而且筛选通量大幅提高,其筛选通量可达到每天103~105克隆。例如,研究人员结合自动化设备建立解脂耶氏酵母过量生产α-酮戊二酸的高通量筛选工艺[22]。实验中使用一系列pH指示剂用于平板预筛选和微孔板筛选。在高通量筛选过程,使用菌株自动挑选设备Qpix460从2880个突变体中成功筛选出1-C6突变体。该突变菌在500 mL三角瓶中产量比野生型提高了51.8%[22]。除此之外,基于微孔板高通量筛选自动化工作站已经成功用于多种工业微生物菌株和酶元件筛选工作[23-25]。但自动化装置和机械臂引入增加实验经济成本,并且由于自动化设备维护费用高、实验耗材贵,致使工作站运行成本高,不具备普适性。

图1 微孔板的高通量筛选自动化工作站Fig. 1 High-throughput screening automation workstation for microplates
2 流式细胞技术和荧光激活细胞分选技术
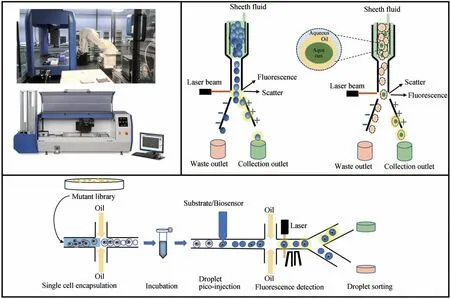
流式细胞技术是利用流式细胞仪对荧光标记的单细胞进行高速、逐一的多参数定量分析和分选的技术[26-28]。其原理是利用激光作为光源照射异质流体混合液产生散射光和荧光信号,并将这些光学信号通过电子检测器读取、转换为电子信号输出,从而对异质流体混合物的单个细胞进行快速分析和筛选的技术[26]。根据细胞分选能力将流式细胞术分为:非分选型和分选型。其中分选型流式细胞仪主要部件包括:流体系统、光学系统(激发和收集)、电子系统(检测器)、数据系统和细胞分选系统[28]。
荧光激活细胞分选术(FACS)是一种分选型流式细胞术,能够从混合细胞群中分析单细胞的多个参数,同时快速对目标细胞进行分选[图2(a)][29]。基于FACS分选的常规流程为:高压将荧光染色的细胞悬液从样品管中压入充满鞘液的流动室内;在鞘液的包裹和推动下细胞流体被排成单列柱状,由于喷口处高压晶体振动使柱状流体断裂成均匀的细胞液滴,形成的水相液滴与入射的激光束垂直相交,激发产生荧光;根据每个细胞经过监测点时光学信号的变化来判断该细胞的形态、大小以及荧光强度,电子系统将这些信息转化为数据;数据系统分析后,将这些单细胞液滴充以正、负不同的电荷;细胞到达偏转板时,在高压静电场的作用下发生偏转,落入各自不同的收集管中实现目标微生物细胞的分选(图2)。荧光激活细胞分选在单细胞水平上分析大型突变文库,并将表现出高荧光的细胞从培养液中分离出。因此,基于FACS高通量筛选是工业菌株选育和酶定向进化最常用的方法[19,30]。然而,由于单细胞水平的差异和目标产物在细胞间运输,这两种情况都可能导致基于FACS高通量筛选的假阳性率,所以在应用该筛查技术时可能会出现挑战[15,31]。即使存在这些障碍,也有许多基于FACS高通量筛选获得高活性酶突变体和高产能工业菌株的成功案例(表1)。

表1 FACS应用工业微生物菌株构建和酶分子定向进化及实例Table 1 Summary of recent FACS applications for microbial cell factories and directed evolution

图2 基于FACS技术高通量筛选Fig. 2 Based on FACS high-throughput screening technology
2.1 基于FACS技术高通量筛选实例
目前,FACS技术对大容量突变文库高通量的分析和筛选,与传统筛选方法相比具有显著优势,尤其是对代谢网络调控复杂的工业菌株选育、酶定向进化等领域都有着重要应用。以下主要介绍近几年基于FACS高通量筛选技术经典案例。
L-半胱氨酸是生物体重要的含硫氨基酸,已广泛应用到多个领域[45]。利用代谢工程策略已经设计和构建了生产L-半胱氨酸的微生物工业菌株[46]。然而,L-半胱氨酸的细胞毒性及其代谢调控网络复杂,利用传统代谢工程策略(例如敲除竞争基因和过表达途径关键基因)无法实现L-半胱氨酸在细胞内的过量生产。工业菌株的选育(工业菌株定向进化)可以有效改善菌株耐受性,实现产量提升。研究人员首先开发了响应L-半胱氨酸的转录因子生物传感器,并与FACS高通量筛选技术结合应用到丝氨酸乙酰基转移酶定向进化和L-半胱氨酸高产菌株的选育工作中。利用该筛选平台成功获得酶活性提高7倍的丝氨酸乙酰基转移酶变体及10株L-半胱氨酸高产变体菌株[31]。综上所述,当对遗传代谢信息认识不足时,基于FACS高通量筛选技术是构建微生物工厂的有力工具。
杨广宇团队[42]利用细胞膜转运蛋白对于荧光标记底物和产物通透性差异,实现荧光在细胞内的富集并结合FACS高通量筛选法,用于筛选岩藻糖基转移酶突变库。实验中,设计多种荧光标记底物衍生物通过半乳糖透酶转运,由胞内糖基转移酶催化生成无法跨膜转运的荧光产物,实现细胞内成功捕获荧光,并且利用FACS高通量筛选技术成功筛选到活性提高14倍的α-1,3-岩藻糖基转移酶突变体[42]。单胺氧化酶是一类黄素腺嘌呤二核苷酸(FAD)依赖性氧化酶,其催化一类构型胺生成氧化产物亚胺,同时释放过氧化氢作为副产物。研究人员利用H2O2高度敏感的荧光探针结合FACS高通量筛选技术,用于筛选单胺氧化酶(MAO-N)突变文库[43]。此外,基于过氧化氢高度敏感荧光探针的FACS高通量筛选方法也广泛适用于大肠杆菌中其他FAD依赖性氧化酶的定向进化。由于荧光蛋白或单细胞水平途径酶表达的异质性造成FACS筛选过程的假阳性,可通过琼脂平板或者微孔板筛选的形式进行低通量二次复筛来消除这种误差。此外,为了解决细胞间产物扩散造成筛选误差,研究人员添加了一种甲醛清除剂——谷胱甘肽,作为甲醛的“水槽”[47]。因为谷胱甘肽在从生产细胞扩散到其他细胞之前与甲醛形成复合体,从而阻止谷胱甘肽的细胞间扩散[47]。
2.2 液滴FACS技术及应用
基于表1中FACS高通量筛选技术成功案例,充分说明FACS是在微生物选育及酶定向进化领域最普遍应用的分选方法。但FACS应用仅限于分析细胞内目标产物相关的荧光信号或与膜结合的代谢物荧光信号,不能用于鉴定过量生产细胞分泌代谢物和胞外分泌酶的细胞筛选。在合成生物学和代谢工程的背景下,FACS局限性直接限制了工程菌株在工业上的应用。特别是许多底物和目标产品存在于胞外,即使是细胞内的产物,科研人员也通过各种策略改造微生物实现产物向外分泌,从而缓解毒性对细胞造成的压力、降低产品的分离难度及经济成本[31,48]。为了克服FACS应用的局限性,研究人员提出水/油/水(W/O/W)双液滴或水凝胶的仿细胞区室化以实现基因型和表型的偶联,从而拓宽FACS的应用范围[图2(b)][48]。
在核黄素高产菌株筛选的一项研究中,将微滴FACS与传统的单细胞FACS进行了比较[16]。结果表明,尽管通量和特异性相同,但不同的筛选模式会产生不同表型的菌株。与传统的单细胞FACS分选出细胞内核黄素含量增加的突变菌株相比,水/油/水(W/O/W)双液滴包裹细胞的微滴FACS分选出胞外产量增加的菌株更有利于工业应用,可直接从培养物中获取核黄素[16]。此外,木聚糖酶定向进化筛选工作中将生成的突变菌与荧光底物一起包埋在凝胶液滴中,以将所需高酶活性的表型与增加的荧光偶联,从而能够通过液滴FACS高通量筛选技术成功鉴定具有提高木聚糖酶生产能力的酵母突变体[38]。然而,通过水/油/水和水凝胶形成的液滴仍然无法实现后续底物和分析试剂的添加操作[15],甚至如何生成这种稳定的水/油/水双液滴或水凝胶都存在技术障碍。
3 液滴微流控技术
微流控技术(microfluidics)是在微米到纳米通道中进行微流体精确操纵和分析的一项技术[49]。因能将整个生物化学实验室集成到单个芯片中,又称之为“芯片实验室”(lab-on-chip)。近年来,由于微流控技术在化学、生物医学、物理等多领域的应用,它已成为一个独特的新研究领域。液滴微流控技术(microdroplet)是微流控技术的重要分支,其通过互不相容的两流体剪切形成单分散的微液滴,并在芯片中实现液滴孵育、融合、分裂、检测和分选等精细操作(图3)[17]。

图3 液滴微流控装置的设计示意图Fig. 3 Schematic of droplet microfluidic device
微液滴的单分散性可实现单细胞代谢物浓度定量监测,而其包裹性为单细胞及液体环境提供了一个隔绝的空间[30]。因此,微液滴是高通量筛选中细胞区室良好的替代方案,为实现基因型和表型偶联奠定了基础。液滴微流控技术通常以每秒超过3万个液滴的速度进行分析和操作,有效提高了筛选效率[50-51]。此外,该技术快速、大量生成体积低至皮升的微隔室,不仅有利于细胞精准分选,还极大程度降低实验过程中生物试剂和耗材的经济成本[52]。
3.1 液滴微流控技术原理及微滴分选模式
由于不同领域的需求,液滴微流体技术设计方案有很多。本文仅描述应用于高通量筛选中单细胞液滴微流控技术总体设计,主要从微滴的生成、细胞液滴培养、微滴融合、皮升注射器、微液滴检测及细胞分选等方面进行介绍。
3.1.1 微滴的生成(microdroplet generation)
微滴生成,是结合两个不混溶的相通过液-液界面剪切力和界面张力自发形成微细胞反应器的过程[图3(a)][53]。微滴生成旨在持续、快速且均匀地生产微滴,而产生微滴的方法很多,包括T形结构法(T-junction)、流动聚焦法(flow focusing)、并流(co-flowing)、微滴分裂(microdroplet splitting)和微孔矩阵(microwell arrays)[54-55]。微滴生成的方法主要取决于微生物突变文库的通量和后续分选设计要求,其中利用流动聚焦法生成微滴过程快速、稳定且微滴尺度操作范围广,因此是微生物细胞微滴生成中最常见的方法[56]。流动聚焦法又称之为十字通道法,是由Anna最早提出的[57]。该方法是在十字微管道中分散相(细胞悬液)和连续相(油相)汇合于十字交叉管处,注入的分散相同时被两侧通道泵出的垂直连续相挤压剪切,细胞悬液在油相的垂直挤压和管道几何结构作用下断裂,从而形成油包水或水保油的液滴[图3(a)][58-59]。通过控制两相流速比,可以调节液滴生成的大小和频率。
3.1.2 细胞液滴培养
细胞液滴培养是实验设计的一个关键点[图3(b)]。细胞液滴在不良环境中,可能会产生液滴收缩和细胞生长减慢等问题[60-61]。尤其对于一些好氧微生物细胞,其生长需要充足的氧气、适宜的温度。为解决这一问题,研究者提出采用管式培养方式。具体操作是在芯片中通过细胞液滴在微型透气管道中流动实现细胞培养,并将这样一个集成性芯片系统安装于可以控制温度、湿度及透气性的容器中,从而满足菌株的生长条件。然而,寻找通透性、坚韧性良好的微管材料应用到芯片中满足细胞生长需求和后续液滴精细操作是具有挑战性的。所以,研究人员提出了另外一个替代方案,即在芯片中设计了离线的分离培养室,将液滴操作和细胞孵育过程分离,以确保细胞正常生长和后续液滴分选操作[62]。此外,新型表面活性剂可维持液滴的亚稳状态,使细胞微滴可以稳定孵育长达数周[63]。当然,表面活性剂对于液滴生产不是必需的,但未添加表面活性剂的液滴之间可能会发生聚结和融合[64]。
3.1.3 微滴融合和皮升注射器
微流体系统中的微滴可用作独立的微反应器,执行一系列生化反应。然而,为了在特定时间将预先生成的细胞液滴与含有试剂液滴发生融合,需添加以下试剂形成新液滴完成生化反应,包括:维持细胞稳定的表面活性剂、检测信号的生物传感器、生化反应的底物及细胞裂解剂等[65]。液滴融合(droplet merge)是通过微管几何结构及液滴表面张力改变或外加施压(电场、磁场等),改变液滴表面的稳定性,将含有试剂的液滴与细胞液滴相融合[66]。例如,研究人员利用微滴融合的方法将裂解剂、底物rac-PheTIQ以及由辣根过氧化物酶(HRP)和荧光染料Amplex UltraRed组成的混合液滴与细胞液滴融合发生生化反应,便于检测胞外目标代谢物产量[67]。这种通过液滴融合方法将新试剂添加到细胞液滴中完成反应的做法,已广泛地应用到液滴操作中。在液滴融合过程中,表面活性剂的添加在保证液滴稳定的同时也会阻碍液滴间融合[64]。为了解决这类问题,研究人员提出通过皮升注射器方法实现液滴中试剂的添加工作。皮升注射器(pico-injection)通过类似于电子介导融合方式将试剂直接注入细胞液滴中[图3(c)][62]。具体而言,当液滴通过皮升注射器时,利用电极通电破坏微液滴水-油界面的稳定性致使试剂进入液滴。这种方法可用于向含有细胞的微滴中注入各种试剂,从而实现产品检测。
3.1.4 微液滴检测及细胞分选
微液滴信号检测决定液滴微流控技术在工业微生物选育及酶定向进化领域的应用范围[图3(d)]。目前,主要的液滴检测方法是基于荧光强度的,被称为荧光激活液滴分选技术(FADS)。由于自发荧光的化合物稀缺,分析物通常需用荧光染料标记和荧光探针辅助,并且也开发了多种用于触发荧光信号的生物传感器。除此之外,研究人员也开发许多无标记检测方法,例如双光子荧光寿命(TPEFLADS)[68]、紫外-可见光谱(UVADS)[69]、光学吸光度(AADS)[51]、拉曼光谱(RACS)[70]、质谱[71]和图像识别[72]等。其中一些检测技术,如双光子荧光寿命可对小芳香族化合物进行无标记荧光检测[68]。该方法将深紫外光谱区域吸收的小芳香族化合物进行无标记的液滴内检测,并通过时间相关的单光子计数,可动态测定液滴的荧光寿命从而区分具有不同化学成分的液滴。再比如,拉曼光谱检测根据分子震动、转动特性指纹检测化合物。质谱检测根据化合物离子状态质荷比进行物质结构分析和检测。这些方法多数根据化合物化学特异性分析样品。然而,因吸光度检测灵敏性低、拉曼光谱检测通量低、质谱检测存在破坏性且通量低等问题,这些技术仍需进一步发展以扩大其应用范围。
液滴分选是液滴微流控流程的最后一步,其旨在从巨大文库中捕获和分离具有目标性状的液滴。液滴分选的通量和精确性主要取决于液滴驱动方法[20]。在不同的驱动力中,电力驱动具有通量高和灵活性强等优点[73-74]。目前,液滴分选技术利用了被动和主动策略,可快速、准确地分选出目标液滴。介电电泳捕获(dielectrophoresis DEP)技术是微流控中常用的主动分选策略。当交流电压施加两端时可产生超高的电场梯度力,由于介电极化的作用,细胞受到不同的介电力进而以不同的速率偏离原始轨迹,实现细胞分选[图3(e)][74]。
3.2 基于微滴细胞分选技术高通量筛选实例
传统的筛选方法,如平板筛选和微量滴定板测定,其成本高且通量低。荧光激活细胞分选(FACS)是目前用于单细胞分选和分析的高通量方法。然而,FACS要求荧光标记物必须保留在待分选细胞的内部或表面上。液滴微流控技术提供了一种多功能的操作系统,在微流体芯片中以千赫兹的速率产生单分散的油包水细胞液滴,液滴中的单细胞隔室增加孵育后的细胞密度,并使分泌物在液滴中积累,然后以0.1~1 kHz的频率单独筛选[64]。近几年,荧光激活液滴分选(FADS)已被应用于酶定向进化和工程微生物筛选(表2)。下面主要介绍2020年以来的最新案例,阐明FADS方法在酶定向进化和微生物工业菌株选育工作中的最新研究进展。
表2 FADS应用工业微生物菌株构建和酶分子定向进化及实例Table 2 Summary of recent FADS applications for microbial cell factories and directed evolution
3.2.1 FADS应用于食品发酵菌株改造
对于安全要求高的发酵食品或食品酶制剂的生产菌株构建,只能选择诱变的方法获取庞大突变株文库,结合FADS高通量筛选技术获得高产菌株[85]。例如食品工业酶制剂谷氨酰胺酶可以提高食品中蛋白质的溶解性和乳化性。研究人员利用FADS技术筛选解淀粉芽孢杆菌高产谷氨酰胺酶突变株。团队研发了荧光信号传感器应用到FADS中,对全基因组突变细胞文库进行单次实验通量高达105克隆筛选,成功获得了1株谷氨酰胺酶产量提高47%以上的突变株[85]。
3.2.2 FADS应用于菌株基因挖掘领域
基于生物体多个基因决定性状特点,借鉴正向遗传筛选思路,即“表型基因型”。通过FADS筛选随机诱变文库以鉴定高产菌株,并使用全基因组测序辅助分析挖掘关键功能基因[80]。清华大学张翀和江南大学刘秀霞团队[80]开发了一个CRISPRi-FADS微流体筛选平台,用于全面挖掘谷氨酸棒状杆菌高产分泌蛋白潜在的关联基因,并系统指导理性改造纳米抗体VHH高效分泌生产。在实验中,研究人员首先构建谷氨酸棒杆菌的CRISPRi突变文库,使用荧光素衍生物FlAsHEDT2对VHH进行荧光标记。其标记原理是VHH的C末端与四半胱氨酸短肽标签发生融合,该融合体被绿色荧光FlAsH-EDT2 试剂标记形成荧光复合物[80]。然后,结合FADS高通量筛选技术对文库进行单细胞筛选。最后,经过三轮筛选的基因型分析,揭示了促进蛋白分泌的潜在靶点[80]。从基因组规模挖掘表型关联基因,实现微生物细胞工厂高效构建不仅需要全面的基因型干扰技术,还需要高通量表型筛选策略,而FADS高通量筛选是实现这一目标的有力工具。
3.2.3 FADS应用于缺乏遗产操作系统菌株的改造
放线菌的代谢产物结构新颖、生物活性独特,多用于临床药物研发。由于放线菌的基因遗传操作方法不够完善,对于放线菌的改造多采用非理性突变的方式。利用FADS技术可以解决放线菌突变株文库的高通量筛选问题。研究人员首先开发全细胞生物传感器:利用放线菌产生的红霉素与大肠杆菌的转录因子MphR结合激活GFP蛋白表达,从而将红霉素浓度信号转化为绿色荧光信号[87]。在实验中,研究人员利用液滴包埋放线菌和大肠杆菌(全细胞生物传感器)构建共培养体系实现产量和荧光信号的转换。然后,结合FADS筛选技术完成多轮迭代突变和筛选,获得多种红霉素高产放线菌。最后,通过测序和生物信息学分析解析高产红霉素机理。此外,研究人员通过反义RNA技术成功验证一个关键基因对于红霉素生产的影响,为完善放线菌遗传操作系统提供了一个潜在的靶点[87]。
3.2.4 FADS应用于调控复杂初级代谢产物菌株构建
初级代谢产物丙酮酸是一种重要的α-酮酸,在生物代谢途径中具有重要作用。虽然丙酮酸合成路径清晰,但严格受到菌株多水平复杂调控影响,严重制约了工业菌株产量提高。周景文团队[39]基于构建光滑球拟酵母表面荧光展示体系和FADS技术,建立了微液滴中丙酮酸与荧光信号偶联的高通量筛选方法。最终获得了1株高产突变菌,其丙酮酸摇瓶产量达48.6 g/L,相比原始菌其产量提高了73.6%。研究人员首先构建荧光检测系统:Pir1、Agα两种锚定蛋白将荧光蛋白定位于酵母膜外表达,成功将胞外丙酮酸产量与荧光信号偶联。再将光滑球拟酵母利用ARTP诱变处理获得突变株文库,利用FADS技术对细胞进行包埋,孵育后进入微滴检测系统将丙酮酸分泌浓度信号转化为荧光强度信号,最终完成细胞分选。
3.2.5 FADS应用于酶定向进化高通量筛选
缺乏途径酶及酶催化活性低是利用合成生物学构建人工合成途径的瓶颈之一;而酶催化元件的有效设计是亟待解决的难题。定向进化是在实验室模拟达尔文自然进化,通过随机突变和重组构建库容量庞大突变文库,筛选出具有目标性状的蛋白质。基于高通量筛选酶定向进化策略,由于缺乏蛋白质结构和功能关系,只能利用暴力破解方式筛选高催化活性蛋白质。研究人员开发了一系列酶定向进化的FADS筛选方法,以微液滴作为酶催化荧光反应发生器,将酶活性信号转化为荧光信号,利用FADS设备对单细胞直接读取荧光信号并完成细胞分选。例如,D-阿洛酮糖是一种低热量、高生理活性的蔗糖替代品,其通过酮糖3-差向异构酶(KEases)催化合成。研究人员发现该酶在工业条件下表现出活性低、耐受性差等问题。为了解决此类问题,研究人员开发响应D-阿洛酮糖转录因子生物传感器,并结合FADS高通量筛选技术实现了合成D-阿洛酮糖的差向异构酶的高效催化和耐受性[86]。杜文斌课题组[75]基于FADS筛选系统,从PET纺织厂废水样品中挖掘新型PET降解酶。该团队首先对PET纺织厂的废水中的单个细胞进行液滴包埋和细胞孵育。然后,选择荧光底物荧光素二苯甲酸酯(FDBz)注射到细胞液滴中完成酶催化反应,释放绿色荧光单苯甲酸酯(FMBz)和荧光素,根据荧光信号变化进行单细胞分选。最后,通过FADS高通量筛选技术成功获得9株PET降解微生物,并对挖掘的两个PET降解新酶进行异源表达,实现其PET降解活性的初步验证[75]。此外,研究者搭建工业产酶菌株FADS高通量筛选平台,通过模拟实验验证FADS筛选通量,并利用该平台筛选了产α-淀粉酶地衣芽孢杆菌突变文库,成功获得出α-淀粉酶生产能力较高的突变体[89]。实验人员利用荧光素BODIPY标记淀粉,当α-淀粉酶水解淀粉时,荧光基团被释放增加荧光强度,进而将α-淀粉酶水催化活性转化为荧光信号实现细胞分选[89]。
4 荧光信号检测
FADS和FACS由于高通量、低消耗,是目前常用高通量筛选技术。在基于FADS的高通量筛选中,单细胞封装并在单分散的皮升液滴内培养,通过检测孵育后的液滴荧光信号的变化激活电场从而分选所需的细胞。而FACS则通过捕获细胞内或膜偶联荧光信号变化进行高通量细胞分选。无论哪种技术,最重要的问题之一是如何将荧光信号与所需的表型偶联。为了解决这一难题,已经开发了几种方法用于实现信号的检测。
4.1 直接产品检测
最理想的情况下,目标产物本身具有荧光性,可直接应用FADS高通量筛选。例如,研究者利用核黄素荧光特性,结合高通量筛选技术,获得高产核黄素的解脂耶式酵母(Yarrowia lipolytica)和乳酸乳球菌(Lactococcus lactis)[16,90]。同样,研究人员通过叶绿素自身荧光特性对微滴中的微藻和蓝藻进行无标记分析和分类[88],首次将叶绿素荧光特性应用于测量蓝藻种群之间生物量差异,并鉴定快速生长的菌株[88]。此外,研究者发现在488 nm激发光照射下,仅有β-胡萝卜素在(535±25)nm可接收到信号并激发荧光。这一发现可排除番茄红素中间产物造成的假阳性干扰响。将这种荧光检测方法与FACS高通量筛序技术相结合,最终获得β-胡萝卜素产量增加53%~166%的9株突变菌[34]。虽然这种情况对于信号检测而言显然是理想的,但具有荧光特性的化合物稀缺,因此,几乎所有其他应用都需要一些手段将化学浓度转化为可检测的信号。以下主要介绍基于荧光信号检测常用策略。
4.2 基于荧光染料/探针信号检测
使用荧光染料/探针进行筛选是一种常用方法,通常用于微生物内或外分泌待测物自身特性无法满足的检测。FACS高通量筛选中,为了保证基因型-表型偶联,需要将荧光产物截留在细胞内以便后续检测。利用细胞膜的选择性,转运蛋白可以实现细胞捕获荧光产物[91]。具体而言,外部添加的小分子荧光标记底物透过膜转运蛋白进入细胞,酶促反应后产生的荧光产物无法转运而滞留细胞内富集引起荧光的积累,根据荧光信号的变化进行筛选。例如,研究人员描述了一种基于FACS高通量筛选技术,用于唾液酸转移酶的定向进化,以提高其对不同荧光标记的受体糖的催化效率[91-92]。实验中,荧光标记底物和N-乙酰神经氨酸(Neu5Ac)通过膜选择性转运蛋白进入细胞,并被唾液酸转移酶CstⅡ转化。唾液酸化的荧光产物无法被转运蛋白识别,从而将荧光信号捕获在胞内。该方法也被用于岩藻糖基转移酶定向进化的工作中,研究者基于细胞膜表面的半乳糖透酶对荧光标记底物及产物通透性的差异实现胞内荧光信号的捕获,结合FACS筛选技术实现高通量文库的筛选[42]。此外,研究人员也通过将疏水性荧光标记底物带上电荷阻止其扩散到细胞外实现细胞内荧光捕获[30,93]。
基于FADS高通量筛选中,微液滴区室化优势保障了细胞分泌待测物的表型-基因型连接。简言之,FADS荧光信号来源不局限于细胞自身。但是,荧光染料/探针的选择在满足良好的灵敏性和特异性的同时,需要考虑荧光染料/探针及其产物跨液滴水-油屏障扩散和液滴间串扰因素[94]。对于疏水性较强的荧光基团的衍生物,在液滴中的滞留性差,分子很快地扩散到油相,甚至在相近的液滴之间发生串扰。这种情况造成荧光背景增加,干扰筛选同时降低筛选的准确性。为了解决这类问题,研究人员通过添加极性基团增加荧光物的亲水性,提高液滴中荧光信号的稳定性[95-96]。
荧光底物与目标酶分子直接反应是高通量筛选常规方法[图4(a)]。例如,利用荧光染料BODIPY标记淀粉,当α-淀粉酶水解淀粉,荧光基团被释放增加荧光强度,从而将α-淀粉酶水催化活性转化为荧光信号实现细胞分选,获得高活性α-淀粉酶突变体[89]。然而,很多代谢产物无法直接进行荧光测定或目标酶分子缺乏直接催化的荧光标记底物,都成为利用FADS技术进行工业菌株筛选和酶定向进化的瓶颈。而通过偶联其他酶促反应(即多酶级联反应)间接产生荧光信号变化,为解决该类问题提供有效策略[图4(b)][94]。具体而言,目标途径产生的副产物与荧光探针经偶联酶催化产生荧光信号,从而实现目标代谢物或酶分子信号偶联。该方法多用于氧化还原反应中氧化酶、脱氢酶和其代谢物的检测[图4(c)、(d)]。例如,胺分子经过环己胺氧化酶(CHAO)催化产生亚胺和过氧化氢,后者与荧光染料Amlex UltraRed被辣根过氧化物酶(HRP)催化释放荧光基团。根据荧光信号变化,筛选高活性CHAO变体酶[67]。在具体实验中,将含有CHAO变体的菌株包埋于液滴中,孵育之后,与含有裂解试剂、反应底物1-苯基-1,2,3,4-四氢异喹啉(PheTIQ)、偶联酶HRP及荧光染料的液滴发生融合,同时在新形成液滴表面添加表面活性剂,防止荧光基团扩散,最终获得酶活性提高960倍的CHAO酶变体[67]。
4.3 转录因子介导生物传感器
鉴于化学荧光染料和荧光探针价格昂贵且难以开发,而生物传感器利用微生物自身遗传调控机制响应目标产物,可被应用于精准监测代谢物和酶分子。基于转录因子(transcription factor,TF)的生物传感器是连接基因和表型的有用工具。简而言之,工业菌株产物或者酶反应底物和产物可以导致荧光蛋白基因表达的上调或下调,最终形成荧光信号,从而将基因型和表型关联。基于转录因子的生物传感器可以分为:检测细胞内代谢产物的内源性转录因子生物感受器;检测细胞分泌代谢的全细胞转录因子生物传感器。
4.3.1 内源性转录因子生物感受器
内源性转录因子生物感受器是指将异源转录因子转化到生产菌株中,以检测生产菌株自身生产能力[图4(e)]。例如,转录因子CcdR结合L-半胱氨酸,与启动子PccdA上游DNA序列结合,RNA聚合酶激活下游基因表达。基于以上原理,将胞内L-半胱氨酸浓度转化为荧光强度信号偶联,实现对胞内L-半胱氨酸浓度的检测[31]。在实验中,研究人员通过转录因子代谢工程策略,对响应L-半胱氨酸的转录因子生物传感器的响应灵敏度和响应强度范围做了改造和提升。同样,为了获得生理环境下高活性精氨酸脱亚胺酶(ADI)变体酶[97],研究者开发了酶介导荧光蛋白调控生物传感器Arg-LiMEx系统。其检测原理如下:增强型绿色荧光蛋白(eGFP)的荧光强度依赖于细胞内精氨酸浓度,而细胞内精氨酸浓度是由精氨酸脱亚胺酶(ADI)催化精氨酸的活性决定。启动子与增强绿色荧光蛋白基因(eGFP)相连,在精氨酸存在下,与同源抑制子ArgR结合形成ArgR+精氨酸+ArgR复合体,复合体结合到argG启动子区域阻止eGFP表达。精氨酸脱亚胺酶ADI与同源抑制子ArgR供体竞争细胞内精氨酸,高活性ADI变体有效地耗尽细胞内精氨酸,阻止精氨酸与ArgR形成复合体,启动eGFP的表达。荧光信号越强说明细胞内精氨酸浓度越低,从而分选出高活性ADI变体酶。经过三轮迭代的随机诱变和FACS筛选,鉴定出一种变体(M31),与野生型相比其催化活性提高了970倍[97]。
除了荧光蛋白外,基于荧光染料的转录子介导生物传感器也被广泛应用于高通量筛选技术。通过转录因子介导的触发荧光染料的释放,从而增加荧光信号进行细胞分选。利用荚膜红杆菌的天然H2传感系统,设计了一种筛选高产H2的固氮酶变体。在分子氢存在下,hup基因簇(HupUV、HupT、HupR)转录上调,最终诱导β-半乳糖苷酶表达。β-半乳糖苷酶催化荧光染料表达的底物荧光素二-β-D-半乳糖苷释放荧光素,筛选高产氢气固氮酶变体,获得了一株氢气产量增加10倍的突变菌[98-99]。
4.3.2 全细胞转录因子生物传感器
全细胞生物感受器用于将转录因子转入到新的宿主中以产生功能性全细胞生物传感器,其准确反映生产菌分泌产物浓度的生物传感[图4(f)]。大肠杆菌菌株是最常用的全细胞生物传感器宿主。基于枯草芽孢杆菌转录抑制因子PadR可以特异性结合对香豆酸的原理,将PadR异源转入大肠杆菌表达,构建全细胞生物感受器。将对香豆酸生产工程酵母突变株与大肠杆菌生物传感细胞封装在皮升液滴内,并在微流体装置中,使用荧光大肠杆菌生物传感器信号快速分选含有酵母细胞的液滴,产生大量细胞外对香豆酸。MphR是一种转录抑制因子,可识别广泛的大环内酯类分子作为其配体[100-101]。大肠杆菌生物传感器菌株和产红霉素菌株在液滴中共培养,突变株产生红霉素进入大肠杆菌,与转录抑制因子MphR结合,促进RNA聚合酶与启动子区域结合,引起荧光蛋白GFP表达。红霉素生成水平与绿色荧光强度呈正相关,并通过荧光激活液滴分选(FADS)进行分选,可以筛选具有较高红霉素产量的突变菌株。在很多工作中都证明全细胞生物传感器-目标产物生产菌株共培养策略在小分子筛选中的可行性[102-103]。基于响应赤藓糖醇转录因子EryD的生物传感器,当酵母突变菌株产生赤藓糖醇,与全细胞生物传感器中的EryD结合,并激活下游集基因表达产生荧光用于快速筛选和表征赤藓糖醇高产酵母菌株[102]。值得注意的是,这种全细胞生物感受器策略在应用中存在一些局限性。最关键的问题是生物传感器菌株和生产菌株在液滴中无法避免的竞争性。在有限液滴环境中大肠杆菌细胞与生产菌株在营养和生存空间方面竞争,致使生产菌生长受限。鉴于这种竞争生长原因,其他生长速率相对较低的模式菌株如谷氨酸棒状杆菌、枯草芽孢杆菌和酵母菌,在某些共培养应用中可能是更好的替代生物传感器宿主。另外,全细胞生物传感器检测荧光信号耗时长,并且需要在液滴筛选后将目标生产菌株与传感器细胞分离。基因编码生物传感器可以很好地解决这些问题。例如,响应谷氨酸的iGluSnFR基因编码生物传感器,这是一种基于谷氨酸浓度荧光蛋白传感器,用于可视化谷氨酸产量[85]。研究者将突变体细胞包埋生成微液滴,并在透气的特氟龙管中孵育液滴。将谷氨酰胺和iGluSnFR的混合物皮升注射到细胞液滴中,对荧光强度高的液滴进行分选。突变株产生谷氨酰胺酶,对添加的底物发生水解反应生成谷氨酸。iGluSnFR结合谷氨酸,启动发生荧光反应。谷氨酸的浓度越高,荧光越强,从而获得高产谷氨酰胺酶菌株[85]。
4.4 核糖体开关生物传感器
核糖体开关(Riboswitch)是基于mRNA水平的一类基因编码生物传感器,是mRNA 5′端非编码区的序列,该序列可折叠成具有一定构象的二级结构。典型的核糖体开关是由适配体结构域和表达基因结构域组成。该结构能够特异性地结合细胞内小分子化合物,使其构象发生改变,从而释放核糖体结合位点(RBS),激活下游基因的表达[图4(g)]。基于核糖体开关原理,研究人员设计了响应色氨酸(Trp)生物传感器生物[76,82]。其传感原理为:当缺乏细胞内Trp时,核糖体开关形成茎环结构,阻止核糖体与核糖体结合位点结合,导致翻译终止[76];当细胞内Trp过量时,Trp分子可以结合茎环并改变其结构,释放核糖体结合位点RBS启动黄色荧光蛋白YFP表达[82]。研究人员利用色氨酸核糖体开关传感器与FADS相结合,成功筛选出一种突变菌株,其Trp滴度提高了165.9%[76]。
5 展 望
微生物工业制造是以微生物细胞工厂为核心,利用低成本、可再生资源为原料,实现高附加值化合物的绿色生产。高通量筛选技术是实现微生物工业制造的有力工具。微孔板、自动化设备与机械臂相结合搭建筛选平台,极大地降低了高通量筛选过程的人力劳动密度,并实现104克隆/天的筛选通量。荧光激活细胞分选和液滴微流控技术的发展加大了细胞筛选通量并降低了实验中试剂耗材成本。尤其是液滴微流控技术的开发和发展为自动化高通量微生物细胞工厂和酶定向进化的筛选提供了新的解决方案。
微流控技术在高通量筛选中表现出巨大的潜力,其应用范围和筛选能力方面都在进一步完善。大多数文献报道的成功案例都是来源于单个实验室搭建的微流控组合装置。一些公司已经将微流体芯片技术商业化,用于液滴生成和分选。例如来自英国Sphere Fluidics公司研发的Cyto-Mine®,该设备将高分泌克隆包埋、筛选、分选、分离和复筛验证集成到一个全自动小型仪器中[104]。Cyto-Mine可以根据实验目的和要求,按需定制工作流程进而实现利用微流控技术提高工作效率[105]。这样的商业化单细胞分析装置允许筛选通量105克隆/天。同时,该设备可实现自动化复筛,将初筛高活力菌株转移到MTP中进行培养检测[104]。此外,包括美国TTP Labtech、Missionbio、SphereFluidics和On-chip biotechnologies在内的几家公司已经开始将集成的台式设备商业化。
我国在微流控技术设备研发方面也取得了一些成就。例如,清华大学化工系生物育种技术与装备团队和天木生物公司合作研发微升级单细胞液滴筛选系统(MISS Cell),该设备允许在微升级液滴中进行自动化、高通量的微生物单细胞培养和分选,通量可达104。这样一个高度集成商业化设备已经应用于多个实验室工作中[84]。该公司还自主研发了基于FADS技术皮升级单细胞分选设备DREM cell,该设备具有体积小、通量高、无交叉污染等特点。DREM cell设备通过将待测细胞包埋成单细胞液滴,利用荧光信号检测分选,实现单细胞微生物的高通量分离、孵育、皮升注射、检测筛选等操作。近年来,基于该设备的高通量筛选研究,充分证明该设备的可靠性[80,85-86]。除此之外,国内科研机构(如中科院微生物研究所、天津工业技术研究所等)也研发一些基于微流控技术的设备。例如杜文斌研究团队和黄力团队共同开发了一种新型的微流控界面纳升注射设备(INJ),该设备可以完成在纳升级体积的油包水微液滴生成,并与FACS高通量筛选技术结合,实现单细胞分析和分选流程。随着时间的推移,高通量筛选技术和设备的开发与应用加速微生物细胞工厂构建和测试的效率,并极大推动合成生物学的高速发展。
