自动化高通量技术在天然产物生物合成中的应用
2023-11-21胡哲辉徐娟卞光凯
胡哲辉,徐娟,卞光凯
(1 中国科学院深圳先进技术研究院合成生物学研究所,广东 深圳 518055; 2 华中农业大学园艺林学学院,果蔬园艺作物种质创新与利用全国重点实验室,湖北 武汉 430071)

天然产物通常是指来源于动物、植物或微生物的次生代谢物。具有多种生物学功能及活性,广泛应用于药物、食品、营养添加剂和化妆品等领域[1]。特别是在癌症治疗和传染病防治方面,天然产物药物发挥着重要作用[2-3]。相较于传统的有机合成分子,天然产物的结构更加复杂多样,通常具有良好的生物活性和多种生物学功能。目前,新颖天然产物挖掘以及高附加值天然产物高效合成仍是该领域研究的热点和难点。
迄今为止,研究人员已通过产物直接分离、同源激活和异源表达等策略挖掘了大量天然产物[4-5]。然而,这些经典的研究策略存在挖掘通量低和产物合成效率低等共性问题,难以满足天然产物研究高速发展的需求[6-7]。为了解决这些问题,一方面,可利用基因组、代谢组和转录组等多组学方法挖掘新颖的天然产物生物合成元件;另一方面,可利用数据库现有功能元件,对代谢通路和生物合成途径进行理性设计和优化,以构建高效底物供给的微生物底盘,实现目标产物的高效合成[8-9]。在过去的二十年中,研究人员已利用高效底物供给的微生物底盘实现了多种天然产物的高效合成,如生物燃料法尼烯[10],抗疟疾药物青蒿素前体青蒿酸[11-12],抗癌药物紫杉醇前体紫杉二烯[13-14],以及柠檬烯、瓦伦烯等香精原料[15-17]。
然而,在取得一系列研究进展的同时,天然产物生物合成研究仍面临诸多挑战。首先,在产物挖掘方面,随着基因组数据的快速增长,功能未知的天然产物生物合成基因(簇)数量已远超已知功能的基因簇。因此,如何有效利用海量基因组信息高效挖掘天然产物“暗物质”成为当前研究的热点和难点[18]。其次,在产物高效合成方面,研究人员需要投入大量时间来对菌株和发酵生产工艺进行代谢工程、酶工程和发酵工程等多个方面的系统改造和优化,以实现目标产物的高效合成[19-21]。此外,在产物筛选和检测方面,快速、灵敏、高通量的目标产物筛选和检测方法的匮乏仍然是限制其生物合成研究高效开展的瓶颈之一。因此,研究人员亟需开发更快速、灵敏且高通量的筛选和检测方法,以推动天然产物的挖掘和高效合成改造过程。
针对上述问题,自动化高通量(automated high-throughput, Auto-HTP)技术在天然产物的挖掘、高效合成和快速筛选等研究领域逐渐得到广泛应用,并取得了显著的成果[22-23]。利用自动化高通量设备进行海量的工程化试错,取代传统的劳动密集型研究范式,能够更快速、低成本、多循环地完成“设计-构建-测试-学习”这一闭环,实现天然产物的高效自动化挖掘,并为构建高附加值化合物细胞工厂提供可行方案[24-26]。本文聚焦于Auto-HTP技术在天然产物生物合成领域的应用。首先,介绍了相对于传统筛选方法,高通量筛选的优缺点,以及Auto-HTP工作站的组成部分和运行流程,并概述了目前国内外Auto-HTP基础设施平台的发展现状。随后,重点介绍了当前Auto-HTP技术在天然产物挖掘、高效合成和快速检测方面的研究进展。最后,总结了目前Auto-HTP技术在天然产物生物合成领域面临的挑战,并展望了未来的发展趋势。Auto-HTP技术的应用将为天然产物的深入挖掘和高效生物合成提供强大的支撑。
1 自动化高通量技术
1.1 自动化高通量技术的优势
Auto-HTP技术的发展始于20世纪90年代初,并随着对高通量处理的需求不断增加,进一步推动了小型化和自动化技术的发展[27]。自动化步骤包括取样、稀释样品、混合样品转移、目标产物检测以及数据分析等[28-29]。随着新设备、新技术的推出,如菌落拾取器[30]、液体处理系统[31]、荧光激活细胞分选[32]和液体微流体技术[33],Auto-HTP的应用范围得到极大的扩展。现如今,Auto-HTP已成为常规实验室技术,在合成生物学的基础研究和应用研究中得到广泛应用。表1对比了传统方法和Auto-HTP技术在天然产物挖掘、高效合成和快速检测三个方面的特点,展示了Auto-HTP在天然产物生物合成领域广阔的应用前景。

表1 传统方法与自动化高通量方法在天然产物生物合成中的比较Table 1 A comparison of automated high-throughput and traditional methods in natural product biosynthesis
在利用“突变-筛选”策略获取高产菌株的过程中,传统方法通常使用琼脂平板活性筛选,如基于透明圈或颜色圈的筛选,或是基于抗性琼脂平板的选择性筛选[34][图1(a)]。然而,这些方法对突变体间的微小差异的分辨率低,仅适用于对突变体库进行初步筛选,并需要结合其他方法进行精确定量分析[35]。为了解决上述问题,基于荧光或吸光度精确检测目标产物的微孔板筛选法应运而生,并已广泛应用于酶和细胞工厂的定向改造[36-37]。通过引入自动单克隆采集系统、液体自动处理系统等自动化设备,研究通量得以提升,同时也显著减少了人力和时间成本[38]。目前这些自动化设备可以代替研究人员完成一些耗时的实验操作,包括分子克隆、质粒构建以及对应底盘系统中目标基因功能的测试等[图1(b)]。目前已有研究人员将自动化高通量设备引入天然产物的挖掘领域,结合高产微生物底盘,有效解决了传统天然产物挖掘过程中效率低和通量低的瓶颈,具体内容在将后文详细介绍。
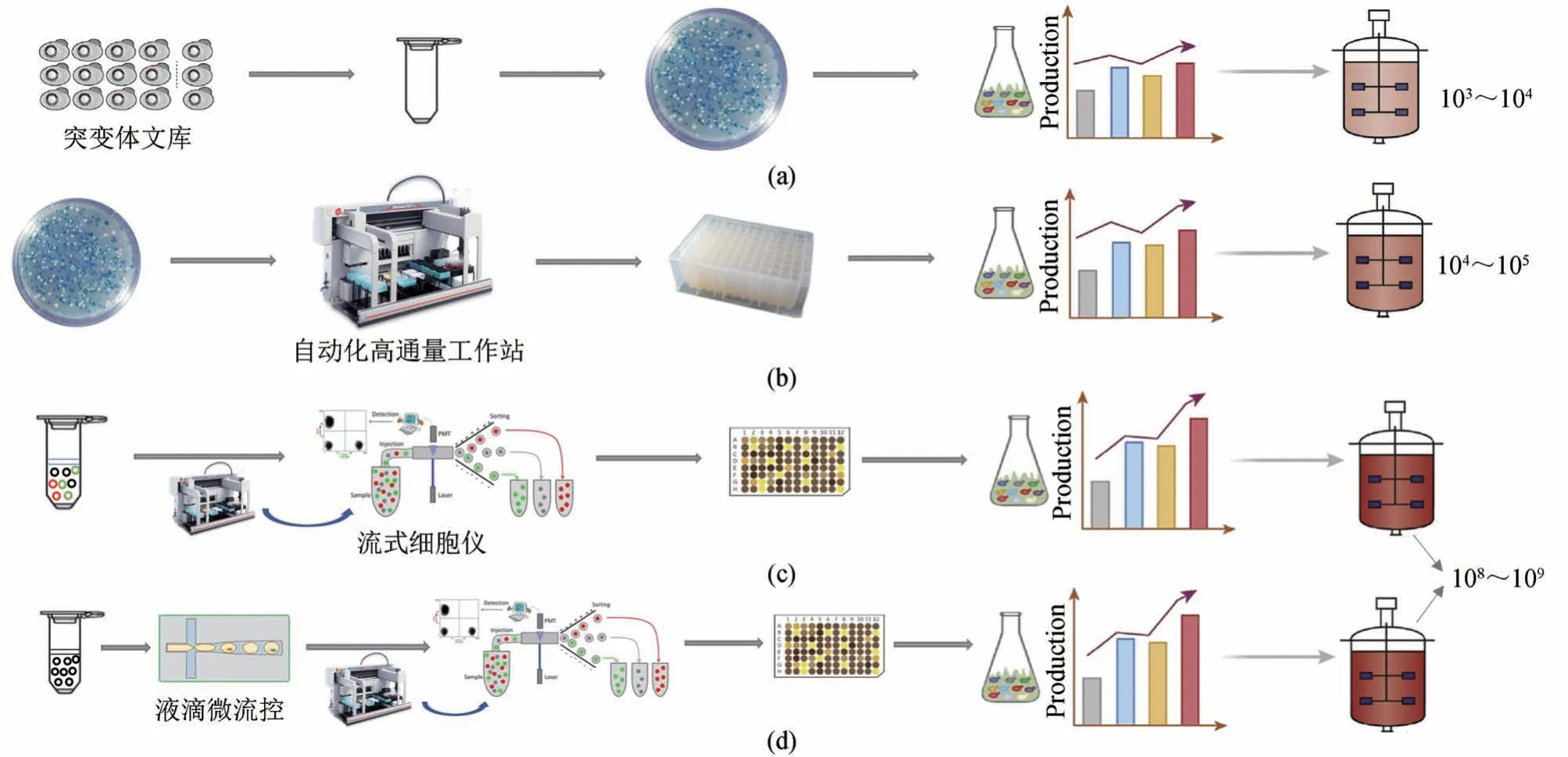
图1 不同通量筛选方法的比较[41-42]Fig. 1 A comparison of different screening methods[41-42]
随着生物技术快速进步和仪器设备的革新,荧光激活细胞分选(fluorescence-activated cell sorting,FACS)和液滴微流控分选(droplet-based microfluidic sorting,DMFS)技术在天然产物的快速检测中得到了广泛应用[31-32]。其中,FACS是一种基于流式细胞仪的高效荧光激活细胞分选技术,可根据单个细胞的荧光信号差异进行精确分选,其通量高达每秒106个细胞[39-40]。该技术已较为成熟,并适用于细胞内或细胞膜上的目标产物的筛选[图1(c)]。对于胞外游离产物,则需要结合液滴微流控技术对单个细胞进行封装,并对其周边微环境进行分析[图1(d)][41]。此外,FACS和DMFS与生物传感器、拉曼光谱等先进技术结合,可以进一步提高天然产物高产菌株的筛选通量和效率。
1.2 自动化高通量设施平台的建立
在当前天然产物研究中,Auto-HTP的有效利用对于加快天然产物研究具有重要意义。通过自动化替代传统的费时费力的常规操作,例如分子克隆和菌株构建,可以实现快速、大规模的工程试错闭环运行,从而实现对自然界丰富天然产物资源的快速挖掘[43]。自动化高通量设施平台在国内外得到积极发展,为自动化合成生物技术的进一步推动提供了支持。例如,美国伊利诺伊大学的iBioFAB(Illinois Biological Foundry for Advanced Biomanufacturing)、英国爱丁堡大学的EGF(Edinburgh Genome Foundry)和帝国理工学院为核心组建的SynBICITE(Synthetic Biology Innovation, Commercial and Industrial Translation Engine)等机构[24]。此外,全球合成生物设施联盟(Global Biofoundry Alliance, GBA)的成立进一步促进了全球范围内的合作和交流[44]。其中,中国科学院深圳先进技术研究院牵头建设的“深圳合成生物研究重大科技基础设施”与天津大学合成生物学前沿科学中心成为GBA中来自中国的发起单位[45],展示了中国在该领域的重要地位和贡献。
在合成生物学的研发过程中,快速试错具有巨大优势。因此,除国家科研机构,自动化高通量筛选技术也成为企业的关键技能。包括Amyris、Ginkgo Bioworks、凯赛生物等国内外合成生物学领域重要企业,都已建立了高通量、自动化、数据化的筛选平台,以缩短从菌株改造到实现量产的研发周期。Ginkgo Bioworks公司作为自动化平台的先驱之一,其第一代自动化铸造厂每月可完成多达1.5万个自动化实验,随后推出的Biowork2进一步提高了设备集成度和小型化程度,使效率提升了6倍[46]。这些设施平台在硬件方面采用微孔板作为载具,并配备自动化仪器,例如自动化移液工作站、自动冷冻离心机、恒温培养箱、连续分液仪、封膜仪、撕膜仪、自动化PCR仪和自动挑克隆机器人等。这些仪器之间通过轨道机械臂对接,实现样品、试剂和耗材在不同设备之间的自动化传输[图2(a)]。同时,还需要一个集成软件系统自动化控制仪器设备的正常运行[47]。以酿酒酵母为例,Auto-HTP工作站可自动化完成分子克隆、酵母转化、菌株筛选等实验室常规操作[图2(b)],极大地提高工作效率并节省了人力和物力成本。

图2 自动化高通量工作站Fig. 2 Automated high-throughput workstation
随着合成生物学技术的迅猛发展,自动化、智能化、信息化的研究平台已成为工、农、医等各大领域应用的科研利器。例如,伊利诺伊大学赵惠民教授团队[48]开发了一种自动化组装类转录激活因子感受器核酸酶(transcription activator-like effector nucleases, TALEN)蛋白的方法。该方法利用iBioFAB平台实现DNA自动化组装,每天可以构建多达1000个编码TALEN蛋白的DNA,且每对TALEN表达载体的成本仅为商业售价的0.3%。此外,iBioFAB平台可全自动对酿酒酵母基因组进行定向进化,快速获得最具乙酸耐受能力的酵母菌株[49]。基于Auto-HTP平台在其他领域展现的强大功能,我们有理由相信该策略将为天然产物研究提供强有力的支持。
2 自动化高通量技术在天然产物生物合成中的应用
2.1 天然产物的挖掘
传统的天然产物挖掘策略通常是基于单一生物样本,对其天然产物直接分离、同源激活、异源表达。这些经典策略一定程度上实现了天然产物的有效挖掘[4,50]。然而,在面对低丰度的产物挖掘时仍显得捉襟见肘,且大部分研究仍局限于单个基因(簇)的异源表达,存在通量低、耗时长和效率低等问题[51],使得天然产物的挖掘进入了瓶颈期。为应对这一挑战,武汉大学刘天罡教授[5]提出“一类钥匙一类锁”的研究理念,并开发了一系列微生物萜类高产底盘,以充分释放酶的产物合成潜力。这种方法显著提高了产物产量,将研究效率提升了3~5倍,加速了萜类合酶的挖掘进程。
近年来,随着基因组测序技术和生物信息学计算工具兴起和蓬勃发展,使得大量微生物基因组信息得以扩展并存储在数据库中[52-55]。这为研究人员提供了大量功能未知的天然产物生物合成基因(簇),然而传统的个性化挖掘策略难以满足海量基因(簇)挖掘的需求。因此,刘天罡教授团队[56]将自动化高通量平台引入天然产物生物合成领域,并结合酿酒酵母高产底盘,对公共数据库所有真菌来源稀有嵌合萜类合酶进行挖掘,成功地从34个新的嵌合萜类合酶中鉴定了24个二萜和二倍半萜产物[图3(a)],数量超过了已报道该类酶总数的一倍。该策略为萜类化合物的挖掘提供了一个强大而高效的方法,摆脱了对生物样本的依赖,充分挖掘并利用数据库现有资源。同时,实现了萜类合酶的跨物种批量研究和实验过程的自动化,推动了萜类天然产物挖掘进入规模化和自动化研究阶段[57-58]。

图3 基于生物铸造平台对新功能萜类基因(簇)的高效挖掘及抗炎新分子mangicol J的高效合成[51,56]Fig. 3 The application of biocasting in efficient mining of new functional terpenoid genes (gene clusters) and the biosynthesis of mangicol J, a new anti-inflammatory molecule[51,56]
随后该团队采用组合生物合成策略,对丝状真菌萜类合酶基因簇进行系统挖掘。开发了以米曲霉(Aspergillus oryzae)作为底盘的Auto-HTP生物铸造体系,在自动化平台上实现了从质粒构建、基因簇重建到生物活性筛选等全流程的高通量自动化操作。利用该方案,成功地重建了39个丝状真菌萜类基因簇,构建了208个突变株,并检测到185个萜类产物[图3(b)~(e)],将实验周期缩短至29天,极大地提高了研究效率,并实现了研究方法的迭代升级。通过该方案,获得具有显著抗炎活性的二倍半萜产物mangicol J[图3(c)],并揭示了其生物合成机制[图3(d)]。通过代谢途径改造,将mangicol J产量提升了111倍[图3(e)][51]。这一“基于微生物高产底盘和生物铸造平台”的萜类产物创新挖掘策略,为萜类产物的挖掘和开发提供了包括“基因簇挖掘—活性筛选—生物合成机制解析—产物高效合成”等流程在内的高效解决方案,克服了传统挖掘方法中通量低的限制。相信该策略将在未来推动其他类型天然产物的快速挖掘,并加速天然产物研究领域的发展。
2.2 天然产物的高效合成
微生物细胞工厂在生物制造中扮演着重要的角色,但通常需要经过多轮迭代改造才能满足实际的生产需求。这一过程中,高效获得具有目标特性的工程菌株至关重要[59]。然而,受通量低和检测速度慢等多种因素限制,传统方法在突变体大规模筛选时耗时较长[32,60]。通过Auto-HTP可以快速高效地对一系列底盘细胞进行多维改造,从而获得高效天然产物微生物细胞工厂。例如,Amyris公司的自动化菌株改造平台可以实现对底盘细胞的持续改造,配置的高通量、自动化、数据化的筛选系统每周平均可以筛选出350个高产法尼烯菌株,显著缩短了从菌株改造到实现量产的研发周期。利用该平台成功在人工酵母中合成角鲨烯,用于替代传统的鲨鱼肝油提取方法[44]。这种技术不仅为医药、食品等多个领域提供了优良的细胞工厂,也是实现“造物致用”的重要手段之一。
近年来,研究人员通过不同的检测原理和针对各种产物的策略,成功提高了多种天然产物工业菌株产量,为工业生产带来了可观的经济价值[61-63]。例如,Lauchli等[64]成功合成了一种含有异戊二烯二磷酸的乙烯基醚,其结构类似于FPP,经萜类合酶(terpene synthase,TPS)催化后该分子会释放出甲醇。接着,在倍半萜合酶BcBOT2定向进化过程中,研究人员使用甲醇偶联酶测定法对萜类产物hemiacetal进行测定,并利用高通量筛选技术对2800个突变株进行筛选。在保证产物组成、酶活等其他特性不变的前提下,大幅提升了该酶的热稳定性。这一技术的应用成功加速了hemiacetal的工业化生产研究进程,同时也为其他具有工业应用价值的萜类化合物研究提供了一种可行的方法。Furubayashi等[65]开发了一种基于底物竞争的TPS高通量比色测定方法,通过TPS与类胡萝卜素合成途径对底物的竞争导致最终溶液的颜色深浅差异,来评估紫杉二烯合酶、马兜铃烯合酶、香叶醇合酶的活性。Zhou等[66]通过易错PCR对酪氨酸解氨酶(tyrosine ammonia-lyase,TAL)进行随机诱变,并利用auto-HTP快速、高通量筛选高产突变株,通过检测315 nm处的吸光度从众多突变株中筛选出3种对香豆酸生产滴度最高的:MT-S9N,MT-A11T和MT-E518V。对三位点同时突变(MT-S9N/-A11T/-E518V)进一步提高了酶活性,相较于野生型TAL提高了65.9%。
此外,研究人员通过改进传统的微生物培养方法,不仅提升了培养通量和培养能力,还进一步降低了试剂耗材的消耗和劳动力成本[67-68]。其中,由我国研究人员研发的微生物微液滴培养仪,能够利用液滴微流控、光电传感与控制和自动化技术,实现微生物液滴的平行培养、生长曲线测定和适应性进化[69]。该系统在常见微生物如大肠杆菌、酿酒酵母和乳酸杆菌等方面表现出稳定的传代能力,使微生物能够实现自动化、高通量自适应性进化,从而获得在某些胁迫条件下耐受性增强的菌株[70-71]。鉴于该系统的高度综合性和多功能性,未来可在微生物培养条件的多因素优化[72]以及单细胞液滴的高通量培养[73-74]等方面得到广泛应用。
2.3 天然产物的检测
在开发各类天然产物高效合成细胞工厂的过程中,准确检测和精准定量目标代谢至关重要。传统的检测方法,如气相色谱、液相色谱、质谱和核磁共振[75],已广泛应用于天然产物的检测。然而这些方法存在一些限制,如耗时长、通量低以及对目标产物的产率和纯度要求较高。为此,近年来涌现出一系列天然产物高通量的筛选方法,如基于紫外/可见光谱、荧光光谱和生物传感器的荧光筛选方法。紫外/可见光谱适用于具有相对复杂分子结构或带有颜色的天然产物,如阿维菌素[32]、番茄红素[76]、头孢菌素C等[77],可以通过直接测量吸光度进行筛选。对于那些没有明显吸光度特性的产物,可以通过添加pH指示剂、与金属离子螯合、与酶或化学反应偶联来检测[30,78-79][图4(a)]。该方法已广泛应用于传统天然产物检测中,并且由于酶标仪体积较小,更易与自动化设备整合,进一步提高了检测通量和效率。例如,赵惠民团队[80]将iBioFAB自动化平台与机器学习算法相结合,通过吸光度对番茄红素进行精确定量,实现了番茄红素生物合成途径的快速迭代优化。与紫外/可见光谱类似,基于荧光光谱的HTP可以根据目标产品的特性分为直接和间接检测方法[图4(b)]。例如,Gao等[81]通过重组红色荧光蛋白筛选纤维素酶,将内切葡聚糖酶活性提高了1.6~2.3倍。使用荧光染料/探针进行筛选也是常见方法,例如使用荧光染料标记死细胞或活细胞[32],用罗丹明定量甲萘鲲和聚苹果酸[82-83]。另外,利用(2S)-柚皮素与金属离子相互作用产生的紫外荧光光谱,可以实现(2S)-柚皮素的快速检测[84]。此外,基于产生荧光信号的化学或酶偶联反应的方法也广泛应用于改良工业微生物菌种的筛选[85-86]。相较于传统的气相/液相色谱法,这些方法有着便捷、迅速、高通量的特点,并且易于实现自动化,将成为未来助力天然产物快速检测的重要工具。
针对无法通过直接或间接颜色或荧光反应检测的天然产物,生物传感器的荧光筛选策略可作为一种替代方案[87-88]。细菌感知环境中特定分子并相应地触发代谢反应的能力为生物传感器的开发创造了许多机会[89]。生物传感器由传感器和报告器两部分组成,其中传感器能够识别特定的细胞内代谢物,而报告器则通过一系列与传感器信号响应的程序化遗传回路产生定量信号。生物传感器分为蛋白质和核酸两种类型。蛋白质生物传感器通常以转录因子和荧光蛋白为基础[90]。例如,Sun等[91]鉴定到一种能够与白藜芦醇发生反应的MarR转录因子,利用该转录因子开发的生物传感器能够有效区分白藜芦醇与其前体物质[原理如图4(c)①、②所示],在一轮FACS中,荧光响应强度较对照组提高了667倍。另外,核酸生物传感器则是以核糖开关为基础,核糖开关是在细菌mRNA的5′-UTR中发现的调节元件,当与特定代谢物结合后,会诱导构象变化,并对下游基因进行转录和调控[92]。例如,Xiu等[93]设计了一种响应柚皮素的RNA核糖开关生物传感器,当该生物传感器与柚皮素结合后,基因表达激活荧光信号产生[原理如图4(c)③所示]。经过遗传改造的生物传感器,可实现对天然产物快速、实时的检测和高效的筛查。此外,将生物传感器与其他先进高通量技术(如FACS和DMFS)相结合,可以进一步提升自动筛选的效率[94]。
除了上述方法外,基于拉曼光谱、傅里叶变换红外光谱(FTIR)和傅里叶变换近红外光谱(FTNIR)等先进仪器平台的光谱技术也正在逐步得到应用。其中,拉曼光谱具有快速、灵敏、无损、实时检测等优点。例如,Wang等[96]开发了一种集成的拉曼激活液滴分选微流体系统,实现了高产虾青素雨生红球藻的精确化、高通量、高活性保持的分选。与拉曼光谱类似,FTIR和FTNIR也是无损分析方法,具有高通量和快速自动检测的优点。将这些光谱技术及其先进的成像技术与Auto-HTP相结合,在天然产物的生物合成中具有巨大潜力。
3 总结与展望
当前,人类正面临日渐严峻的挑战,包括疾病肆虐、环境破坏和能源枯竭等。在过去的一个多世纪中,天然产物作为“环境友好”型先导分子,在医药健康和农业生产领域发挥着重要作用,并得到广泛应用[97]。生物信息学分析表明,目前仅有3%的细菌来源天然产物被发现,即使是深入研究的类群如链霉菌,仍存在大量未知的天然产物有待挖掘[98]。合成生物学作为新兴的科学领域,在生物医药与大健康、生物化工、食品与农业等领域已经取得了多项标志性成果[99-100]。在合成生物学理念指导下,天然产物的挖掘效率得到进一步提升。例如,Yuan等[51]采用“bottom-up”策略将39个基因簇重构为208个突变株,获得185种产物,充分释放了基因簇中各个酶的催化潜力。此外,合成生物学工具,如各种微生物高产底盘和经遗传改造的生物传感器,在天然产物的高效合成和快速检测方面起到了重要的支持作用。因此,在合成生物学理念指导下,配备Auto-HTP平台,可以更高效、充分地挖掘自然界中的天然产物“暗物质”。
虽然Auto-HTP在不同领域中取得了应用并提高了通量,并实现了自动化,但仍然面临一些挑战。首先是成本问题,建立一套完整的auto-HTP工作站需要多台昂贵且维护成本高的机械自动化设备,如菌落自动拾取器和液体处理系统,这限制了其广泛应用。其次,一些HTP系统(如DMFS)操作过程复杂且技术性强,且现有装置多由实验室研制,仍未得到大范围推广[101-102]。再次,目前主流的FACS和DMFS依赖荧光信号进行检测,虽然已有基于吸光度和拉曼光谱的DMFS报道[95,103],但其灵敏度和筛选通量远低于标准要求,难以满足实验需求。最后,目前仍缺乏高度集成的工程化研究平台,以进行系统化的天然产物资源研究和挖掘。
虽然仍面临诸多挑战,但自动化合成生物技术在天然产物生物合成领域已取得广泛应用。我国已建成或正在建设多个大型合成生物学基础设施平台,并将依托这些平台进一步挖掘未知生物合成元件、代谢途径和天然产物。基于合成生物学策略,研究人员可以从改造催化途径酶、整合生物途径和化学途径,以及改造底盘细胞等方面着手,以实现高价值天然产物的高效合成[104]。随着人工智能的快速进步和生物大数据的不断发展,我们相信,当前Auto-HTP运行模式有望进一步提升,并降低成本。
综上所述,自动化合成生物技术近年来在天然产物的生物合成领域取得了多项突破性进展。但作为近十年来迅速发展的研究手段,其仍处于发展初期[27],需要合成生物、信息技术、自动化等多领域的研究人员共同协作,对设施平台进行不断的更新和优化。尽管还存在着诸多不成熟的地方以及有待进一步解决的问题,但相信其具备的独特优势将会为天然产物的深入挖掘和高效生物合成提供强大支撑,为新型天然产物功能产品的开发提供可持续来源。
