Nrf2-ARE信号通路影响糖尿病心肌梗死氧化应激的机制研究
2023-11-21刘平方蔡承哲冯小倩叶贤区许卓帆
刘平方,蔡承哲,冯小倩,叶贤区,许卓帆
(广州市第十二人民医院,广东 广州 510620)
冠心病(CHD)病发的重要危险因素之一即为糖尿病(DM),其在心血管疾病的整个发生发展过程中起着重要的作用[1]。近年调查显示,CHD的发病率已呈现下降趋势,但合并DM者却日益增多[2]。而DM合并CHD患者死亡风险相对更高,可促使心肌发生恶化,对患者预后生活质量产生严重的影响[3]。有研究显示,氧化应激损伤可加重DM患者心肌梗死的程度,而Nrf2-ARE信号通路是一种内源性抗氧化应答的机制,在氧化应激调控领域地位显著[4]。一方面,氧化应激可致使Keap1-Nrf2复合体发生解离,增加游离Nrf2的比例,而细胞质中的Nrf2可以通过核膜进入细胞核中,对下游的二相解毒酶基因和抗氧化蛋白具有上调作用,进而产生氧化应激抑制作用[5-6]。氧化应激还可促进Nrf2蛋白的合成。相关研究显示,HO-1等对Nrf2-ARE信号通路产生保护作用的内源性基因[7]。故本文探讨Nrf2-ARE信号通路对糖尿病心肌梗死大鼠氧化应激的影响,并对其作用机制进行研究,为糖尿病心肌梗死患者的临床诊治提供参考。
1 材料与方法
1.1实验动物:60只清洁级别SD雄性大鼠,体重(156.87±12.28)kg,均购于南京斯科瑞生物科技有限公司。链脲佐菌素(STZ)上海金畔生物科技有限公司。本次试验经过本院医学伦理委员会同意。
1.2造模与分组[8-9]:采用高热量饮食+STZ 注射方法制备2型糖尿病模型40只,随机分为糖尿病组(DM组)和糖尿病合并心肌梗死组(DMI组)两组,各20只。其中DMI组再通过结扎前降支的方式制备心肌梗死模型,另取20只健康大鼠作为空白组。其中糖尿病大鼠建模方法:采用STA注射+高热量饮食的方式制备糖尿病大鼠模型,高脂饲料喂养6 w以后,按照30 mg/kg STZ的量一次性腹腔注射,之后对尾血血糖水平采用血糖仪(G086型;湖南达优医疗科技有限公司)进行测定,明显多尿且血糖值不小于16.7 mmol/L即为建模成功。心肌梗死建模方法:在呼吸机辅助下,左侧2~3肋骨间进行开胸手术,于肺动脉圆锥和左心耳交界位置下方2 mm处进行前降支结扎处理。当近心尖的左室前壁变为暗灰色,收缩力消失或者降低时;心电图出现Q波以及ST段弓背向上抬高,即为建模成功。
1.3活性氧(ROS)、活性氮(RON) :各组大鼠均喂养1 w后,取心肌组织,采用连续缓冲液进行洗涤处理,取出适量心肌组织,再向其中加入适量的磷酸钾缓冲液以配成10%匀浆液,离心分离,取上清。采用酶联免疫吸附试验(ELISA)对心肌组织ROS、RON水平进行测定,试剂盒购于艾美捷科技有限公司。
1.4Nrf2-ARE信号通路相关因子的表达[10-11]:通过Western印迹法对HO-1、Nrf蛋白进行检测,取0.1 mg保存的心肌组织,采用裂解液500 μl进行裂解处理,冰浴后离心10 min,取部分上清,心肌组织HO-1、Nrf蛋白采用BCA蛋白测试试剂盒进行测定。采用上样缓冲液对剩余上清进行封闭处理,10 min沸水浴后,-70℃保存。各个样品进行凝胶电泳上样,之后转移至聚偏氟乙烯微孔膜,脱脂奶粉进行60 min的封存,在4℃条件下进行一抗封闭处理,PBST进行3次洗膜,15 min/次,二抗(1∶4 000)处理,常温条件下进行60 min孵育,PBST漂洗,采用凝胶系统对上述进行成像,目的条带灰度值通过Labwork4.6进行分析,其中HO-1采用β-actin校正,Nrf2采用H1校正。
1.5Ⅱ相解毒酶表达:取1.3中所述心肌组织上清液,通过氧化酶活性,采用分光光度法对心肌组织过氧化氢酶(CAT)、超氧化物歧化酶(SOD)水平进行测定,试剂盒购于上海研谨生物科技有限公司。
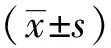
2 结果
2.1各组大鼠心肌组织Nrf2-ARE信号通路相关因子的表达:与空白组相比,DM组和DMI组大鼠心肌组织HO-1、Nrf表达水平逐渐降低,且DMI组降低更为显著,差异有统计学意义(P<0.05)。见表1和图1。
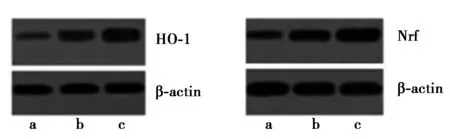
a、b、c分别表示DMI组、DM组、空白组
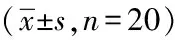
表1 各组大鼠心肌组织Nrf2-ARE信号通路相关因子的表达
2.2各组大鼠心肌组织ROS、RON水平表达:与空白组相比,DM组和DMI组大鼠心肌组织ROS、RON表达水平逐渐升高,且DMI组升高更为显著,差异有统计学意义(P<0.05)。见表2。
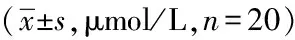
表2 各组大鼠心肌组织ROS、RON水平表达
2.3糖尿病心肌梗死大鼠氧化应激与Nrf2-ARE信号通路的相关性:经Pearson相关性分析显示,糖尿病心肌梗死大鼠心肌组织ROS表达水平与HO-1、Nrf表达水平呈负相关,心肌组织RON表达水平与HO-1、Nrf表达水平呈负相关,差异有统计学意义(P<0.05)。见表3。

表3 糖尿病心肌梗死大鼠氧化应激与Nrf2-ARE信号通路的相关性
2.4各组大鼠心肌组织CAT、SOD的表达水平比较:与空白组相比,DM组和DMI组大鼠心肌组织CAT、SOD表达水平逐渐升高,且DMI组升高更为显著,差异有统计学意义(P<0.05)。见表4。
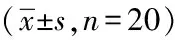
表4 各组心肌组织大鼠CAT、SOD的表达水平比较
3 讨论
研究显示,DM的病发与内分泌失调、氧化应激、环境、感染等因素关系密切,其中MI是重要的一种并发症[12]。氧化应激是机体在受到相关外界刺激时,体内产生的ROS和RON高活性分子过多,超出机体清除能力,会致使机体氧化还原系统失调,进而引发细胞内蛋白质等氧化性损伤,最终造成组织器官损伤和细胞凋亡[13]。为维持机体氧化还原平衡,机体会对多余的自由基进行清除。而Nrf2-ARE信号通路是近年抗氧化研究的热点,其介导的多种基因表达被认为是抗氧化的重要机制[14]。Nrf2-ARE信号通路的激活可以有效降低ROS和RON的产生,同时还可改善机体胰岛素抵抗状况,纠正患者生化功能紊乱,从而发挥抗氧化应激的功能,在DM合并心肌梗死的发生发展过程中起着重要的作用[15]。
Nrf2-ARE通路的核心分子是Nrf2-和HO-1。有研究显示,其在解毒、免疫调节、抗组织损伤抗炎、抗氧化等过程均具有重要作用,通过调节此通路可以发挥抗心脏、抗动脉粥样硬化等作用[16]。而氧化应激产生的ROS和RON会对细胞内大分子生物的生理功能产生间接或直接的影响,是引发糖尿病心肌梗死患者的重要病理基础[17]。文中相关性分析显示,糖尿病心肌梗死大鼠Nrf2-ARE通路与氧化应激反应呈现负相关,这可能是由于机体在受到氧化应激损伤时,会形成一种复杂的抗氧化应激系统。近年研究显示,Nrf2-ARE通路在抵抗外源性有毒物质和氧化应激损伤中作用显著,是目前最重要的一种内源性抗氧化通路[18]。有研究显示,对敲除Nrf2基因的小鼠,诱导性和基础性基因的表达显著降低,而小鼠ROS和RON生成量大大增加,氧化应激损伤程度增加,这也说明了Nrf2-ARE通路在小鼠氧化应激调控过程中作用显著[19]。本文结果显示,糖尿病心肌梗死组大鼠心肌组织CAT、SOD表达水平更高,故Nrf2-ARE通路可能是通过对CAT、SOD的表达进行调控,进而实现抗氧化应激的作用。这主要是由于CAT、SOD是Ⅱ相解毒酶和抗氧化酶的代表物质,可以有效地对机体系统内的自由基进行有效清除,从而对ROS和RON的产生具有较好的预防作用。SOD是以超氧化物阴离子自由基为主要底物,可以对体内歧化作用生成过氧化氢产生催化作用,是机体氧自由基重要的清除剂[20]。另外,在外界化学物质或者自由基的刺激下,Nrf2可以被快速磷酸化,从而解离Keap1,两者均被活化,被活化的Nrf2在进入细胞核以后,会与ARE相互结合,进而对下游的蛋白酶体/分子伴侣、Ⅱ相解毒酶、抗氧化酶等基因表达和转录基因产生启动作用,促使CAT、SOD等分子的大量表达,起抵抗外界有害刺激的功效[21]。而HO-1等氧化还原基因还是一种重要的内源性保护基因。上述蛋白相互之间会产生一种抗氧化的协同作用,对过量的ROS和RON等分子产生清除效果,具有较好的细胞氧化应激对抗和氧化还原状态维持作用[22]。
综上所述,糖尿病心肌梗死大鼠Nrf2-ARE信号通路可能通过CAT、SOD分子对其氧化应激反应进行调控,进而避免细胞和组织免受损伤,具有一定的临床应用价值。
