把握三个知识点,突破非金属实验题
2023-11-20厉宗阳
厉宗阳
(山东省五莲中学)
新高考化学注重学生的探究意识及深度思维的培养,关注化学知识的实践应用.非金属相关试题以生产、生活、科技发展为背景,考查学生阅读理解、提取信息、迁移应用、数据计算等能力,是每年高考的高频考点.实验题是考查非金属相关知识的常见综合类试题.对于非金属实验题,要把握试题中常见的知识点,扎实掌握理论知识,才能合理地运用所学知识解决问题.
1 常见气体的制备
常见气体的制备实验基础性较强.高考对这部分内容的考查不仅涉及制取装置的选择和使用、常见气体的收集和检验方法,还涉及制备实验中仪器的连接顺序及装置中参与反应的物质的选择,即更注重实验方案的设计.
例1SO2具有漂白性,工业上常用SO2来漂白纸浆、毛、丝、草帽等.此外,SO2还具有还原性,可用作防腐剂.甲组同学拟利用Mg粉与浓硫酸反应制取22.4 L(标准状况下)SO2.实验方案设计如下:取24 g Mg粉与100 mL 98% 的浓硫酸(含2.204 mol H2SO4)混合,加热充分反应,待Mg粉全部溶解后,干燥并收集气体.
(1)写出Mg粉与浓硫酸反应制备SO2的化学方程式:_______.
(2)乙组同学认为:按甲组同学的实验方案无法达到实验目的,并且制得气体含有杂质,该杂质为_________(填化学式).
(3)为了检验甲组同学所制气体的成分,乙组同学按甲组同学的实验方案制备气体,并设计了如图1所示的实验装置进行检验(已知酸性高锰酸钾溶液及B中试剂均过量),其中C 是Cu O 固体,D 是无水Cu SO4.
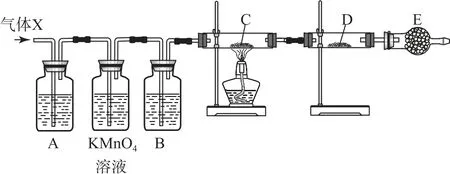
图1
①A 中试剂是品红溶液,作用是_________.
②B中所装试剂为_________.
③证明气体中混有杂质气体的实验现象是________.
(4)将SO2气体通入FeCl3溶液中反应一段时间后,取少量反应后的溶液,分成两份,一份滴加KSCN溶液,溶液未变红色;另一份滴加稀盐酸酸化的Ba Cl2溶液,生成了白色沉淀.请写出SO2气体通入FeCl3溶液中发生反应的离子方程式:_______.
分析Mg与浓硫酸反应制备SO2,所制得的气体通入装置A(品红溶液)后,品红溶液褪色,再通入酸性高锰酸钾溶液,SO2被酸性高锰酸钾溶液吸收,剩余的H2被装置B中的浓硫酸干燥后,通入装置C,H2在加热的条件下会与Cu O 反应生成H2O 和Cu,生成的H2O 会与无水Cu SO4结合,使得无水Cu SO4变蓝,从而验证混合气体中混有杂质气体.
(1)Mg与浓硫酸发生的是氧化还原反应,化学方程式为
(2)Mg与浓硫酸反应一段时间后,浓硫酸变成稀硫酸,Mg会与稀硫酸反应生成杂质气体(H2).
(3)①A 中品红溶液的作用是检验气体中含SO2.②由前文分析可知B 中所装试剂为浓硫酸.③若混有杂质气体(H2),则H2在加热的条件下会与Cu O 反应生成H2O 和Cu,生成的H2O 会与无水CuSO4结合,使得无水CuSO4变蓝,所以现象是:C中黑色粉末变成红色,D 中白色粉末变成蓝色.
(4)滴加KSCN 溶液,溶液未变红色,说明Fe3+被还原为Fe2+,滴加稀盐酸酸化的BaCl2溶液,生成了白色沉淀,说明有生成,则离子方程式为2Fe3++SO2+2 H2O=2Fe2+++4 H+.
2 常见离子的检验
非金属相关离子的检验是高中阶段重要的验证性实验,旨在考查学生的推理验证和实验方案设计能力,具备较强的创新意识和深度思维能力是解答此类试题的关键.在离子检验中,不仅要熟悉某离子的检验方式,还要排除其他离子的干扰,保证离子检验的准确性和缜密性.
例2根据实验目的,下列实验及现象、结论都正确的是( ).
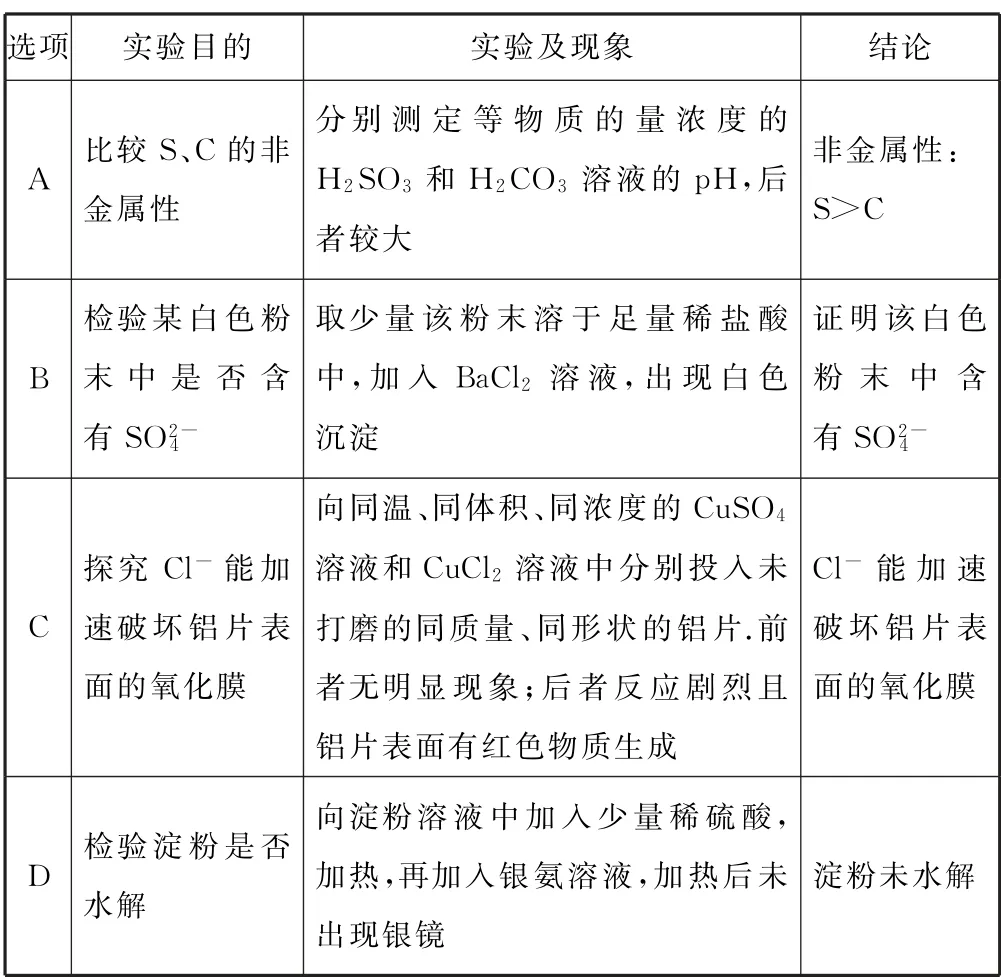
分析H2SO3不是硫元素对应的最高价含氧酸,不能比较S、C的非金属性强弱,选项A 错误.由实验操作和现象可知,白色沉淀可能为Ag Cl,不能证明是否含,选项B错误.CuSO4溶液和Cu Cl2溶液的阴离子不同,由实验操作和现象可知,Cl-能加速破坏铝片表面的氧化膜,选项C 正确.淀粉水解后,没有加Na OH 溶液中和硫酸,不能检验葡萄糖,则不能说明淀粉未水解,选项D 错误.答案为C.
3 物质性质的验证
验证物质的性质是非金属实验题中的重要内容,综合性强,涉及硅、氯、氮、硫、碳及其化合物的性质,通常以生活或科技发展为背景,考查非金属单质及其化合物之间的转化,依据复分解反应及氧化还原反应原理设计实验验证常见含非金属元素物质的性质.
例3二氧化氯(Cl O2)与氯气性质相近,可用于自来水消毒.为检测二氧化氯能否与KI溶液反应,某兴趣小组设计了如下实验(实验装置如图2所示,且气密性良好,D 中稳定剂不能与Cl2反应).
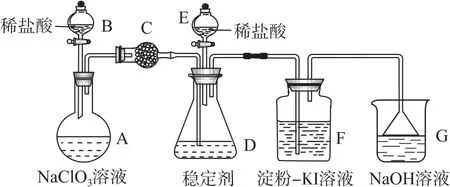
图2
(1)打开仪器B的活塞,装置A 中发生反应,且产物有Cl O2、Cl2等,该反应中稀盐酸体现了_________性和________性.
(2)关闭仪器B的活塞,Cl O2在装置D 中被稳定剂完全吸收生成Na Cl O2,此时观察到装置F 中溶液的颜色不变,原因是_________.
(3)已知在酸性条件下Na Cl O2可发生反应生成NaCl并放出Cl O2,反应的离子方程式为_________.打开E的活塞,可观察到装置F 中的溶液变成蓝色,该反应中还原剂与氧化剂的物质的量之比为_________.
分析稀盐酸与氯酸钠溶液在圆底烧瓶内反应,生成Cl O2、Cl2等气体,通过装置C除去Cl2,Cl O2进入装置D 被稳定剂吸收生成Na Cl O2,用淀粉-KI溶液检验是否有氧化性气体逸出,尾气用Na OH 溶液吸收,用倒扣的漏斗防止倒吸.
(1)装置A 中发生反应的化学方程式为2 NaCl O3+4 HCl=2Cl O2↑+Cl2↑+2 Na Cl+2 H2O,该反应中,HCl体现了酸性和还原性.(2)装置F中的颜色不变,说明无I2生成,即通入F 中的气体中不含有Cl2,因此Cl O2、Cl2混合气体中的Cl2被装置C除去.(3)已知酸性条件下Na Cl O2可发生反应生成Na Cl并放出Cl O2,该反应是歧化反应,离子方程式为+4 H+=Cl-+4Cl O2↑+2 H2O.Cl O2和KI反应生成I2,氯元素化合价由+4价变为-1价,碘元素化合价由-1价变为0价,根据电子守恒可知,还原剂与氧化剂的物质的量之比为5∶1.
新高考中有关非金属的实验题是高考的必考点和热点.学生在解决非金属实验题时,要在掌握非金属相关知识的基础上,厘清解题突破口,从常见气体的制备、常见离子的检验及物质性质的验证3个方面进行针对性训练,并在解题过程中总结归纳自己的解题方法,以便高效率地解答此类试题.
(完)
