一道实验探究题的深度剖析
——探究溶液中Ag+与单质S的反应
2023-11-20陈建托
陈建托
(首都师范大学附属中学)
科学探究是进行科学解释和发现、创造和应用的科学实践活动.北京市等级性考试及模拟考试中的实验探究题情境新颖、方法灵活、思维发散空间大,可以充分考查学生的学科核心素养,具有良好的区分度和选拔功能.2022年北京市西城区一模考试的实验探究题是探究溶液中Ag+与单质S的反应,题目涉及物质检验、找排干扰、对比实验等,探究思路、实验方法和设问形式具有较强的启发性.笔者深入分析此题,探索实验探究题的一般解题方法,希望对学生学习有一定的帮助.本题素材源自2015年第29届全国高中学生化学竞赛(省级赛区)试题.
原题写出下列各化学反应的方程式.
1-4 在水中,Ag2SO4与单质S作用,沉淀变为Ag2S,分离,所得溶液加碘水不褪色.
答案3 Ag2SO4+4S+4 H2O→3Ag2S+4 H2SO4.
1 一模题目
例 探究溶液中Ag+与单质S的反应.
资料:Ag2S不溶于6 mol•L-1盐酸,Ag2SO3和Ag2SO4在6 mol•L-1盐酸中均发生沉淀的转化.
实验Ⅰ.将10 mL 0.04 mol•L-1Ag NO3溶液与0.01 g S粉混合,水浴加热,充分反应后,过滤,得到无色溶液a(p H≈1),沉淀除S、洗涤后得到黑色固体b.
(1)研究黑色固体b的组成.
①根据S 具有________性,推测b 中可能含有Ag2S、Ag、Ag2SO3或Ag2SO4.
②检验黑色固体b的成分.
实验Ⅱ.操作流程如图1所示.
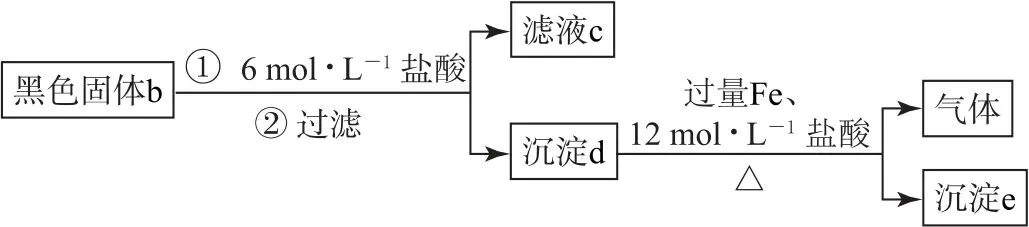
图1
ⅰ.取少量滤液c,先加入足量稀盐酸,再滴加BaCl2溶液,未出现白色沉淀,判断黑色固体b 中不含_________.
ⅱ.用滤液c继续实验证明了黑色固体b中不含Ag2SO3,可选择的试剂是_________(填序号).
A.酸性K Mn O4溶液
B.H2O2和Ba Cl2的混合溶液
C.溴水
ⅲ.进一步实验证实了黑色固体b中不含Ag.根据沉淀e含有Ag、气体含有H2S,写出同时生成Ag和H2S的离子方程式:_________.
(2)研究无色溶液a的组成.
实验Ⅲ.操作流程如图2所示.
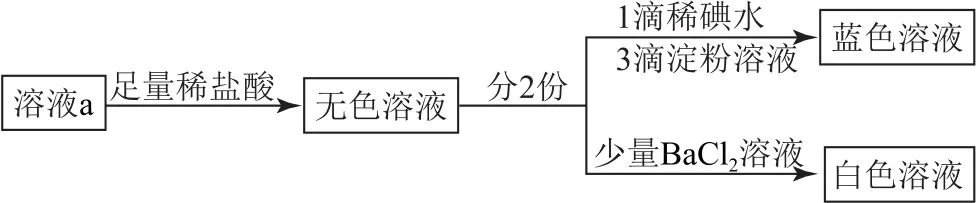
图2
①说明溶液a 中不含H2SO3的实验证据是_________.
②加入足量稀盐酸的作用是________.
(3)在注射器中进行实验Ⅳ,探究Ag2SO4溶液与S的反应,所得产物与实验Ⅰ相同.
①向注射器中加入的物质是________.
②改用Ag2SO4溶液的目的是_________.
(4)用Na NO3溶液与S进行实验Ⅴ,发现二者不反应.综合以上实验,写出溶液中Ag+与S反应的离子方程式并简要说明Ag+的作用:_______.
答案(1)①氧化性和还原.②ⅰ.Ag2SO4.ⅱ.B、C.ⅲ.Ag2S+2 H++Fe2 Ag+Fe2++H2S↑.
(2)S转化为Ag2S发生了还原反应,反应必然同时发生氧化反应,能发生氧化反应的只有S,故在p H≈1的溶液中可能存在或H2SO3.
①向溶液a中加入足量稀盐酸后,再加入碘水和淀粉溶液,蓝色不褪去.
②排除Ag+对和H2SO3检验的干扰.
(3)①10 mL 0.02 mol•L-1Ag2SO4溶液与0.01 g S粉.②排除对反应的影响.
(4)6 Ag++4S+4 H2O =3 Ag2S++8 H+,形成Ag2S难溶物,降低c(S2-),提高S的氧化性,利于反应发生.
2 深度剖析
根据实验现象可初步预测Ag NO3与S发生氧化还原反应,氧化剂可能有,还原剂可能是S,本题探究过程则是要逐步确定氧化剂和还原剂及对应产物,进而确定二者的真实反应.
2.1 研究黑色固体b的组成
实验Ⅱ将黑色固体b溶于一定浓度的盐酸,将可能存在的Ag2SO3或Ag2SO4转化分离,实验过程分析如图3所示.
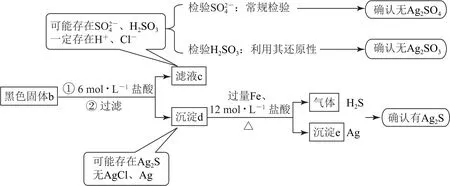
图3 探究黑色固体b的组成
实验结论:黑色固体b 中有Ag2S,无Ag、Ag2SO3和Ag2SO4.
证明黑色固体b中不含Ag2SO3,也就是证明滤液c中没有H2SO3.分析题给选项可知,利用H2SO3的还原性进行检验,要注意检验是否有明显现象(实验证据),是否有其他干扰(确保检验的唯一性).选项A,有Cl-干扰,不可以证明(酸性KMn O4溶液可以氧化Cl-).选项B,H2O2氧化H2SO3生成,进而生成BaSO4沉淀,可以证明(若只加H2O2不可以证明,没有明显实验现象).选项C,H2SO3与Br2发生氧化还原反应,溴水褪色,可以证明.
沉淀e中含有Ag,气体中含有H2S.根据银元素守恒或硫元素守恒可以判断黑色固体b中必然存在Ag2S(银元素、硫元素均无其他来源).
如何检验黑色固体b或沉淀d中是否存在Ag?一般检验Ag 的方法:固体先加硝酸溶解,再滴加Na Cl溶液或盐酸,观察是否出现沉淀.本题固体b和沉淀d中存在Ag2S,Ag2S可溶于较浓的硝酸,所用硝酸浓度不能太大,但硝酸浓度较小时,Ag的溶解又不充分,加之本题试剂用量很少,不容易准确检验Ag是否存在.题目或是为简化处理,所以明确给出了固体b中不存在Ag.
2.2 研究无色溶液a的组成
体系中可以升价的物质只有S,固体b 中没有Ag2SO3、Ag2SO4,预测溶液a中存在或H2SO3,进一步实验如图4所示.

图4 探究无色溶液a的组成
实验Ⅲ用BaCl2溶液检验,“碘水+淀粉”检验有还原性的H2SO3,需要注意溶液a中可能存在Ag+(Ag NO3未完全反应).一方面,Ag+可以与Ba Cl2反应生成沉淀,干扰检验.另一方面,Ag+可与碘水中I-反应生成沉淀,促进I2与水的反应,干扰H2SO3检验.检验和H2SO3需要排除Ag+干扰,也就是加入足量稀盐酸的作用.
2.3 研究 是否参与反应
实验Ⅱ、Ⅲ已经确认有Ag2S 和生成,但是否参与氧化还原反应尚不能确定.研究是否参与反应需要将Ag NO3替换为Ag2SO4进行对比实验,当然一定要注意控制单一变量,保证溶液体积和Ag+浓度一致(Ag2SO4浓度为Ag NO3浓度的二分之一).故实验Ⅳ向注射器中加入的物质是10 mL 0.02 mol•L-1Ag2SO4溶液与0.01 g S粉.实验Ⅳ所得产物与实验Ⅰ相同,再替换Ag+进行对比实验,用Na NO3溶液与S 进行实验Ⅴ,发现二者不反应,充分排除了(H+)参与反应的可能.
实验Ⅳ在注射器中进行,可以排除空气中O2的干扰,同时也排除了O2作为氧化剂的可能性.
2.4 整体分析
实验整体分析如表1所示.
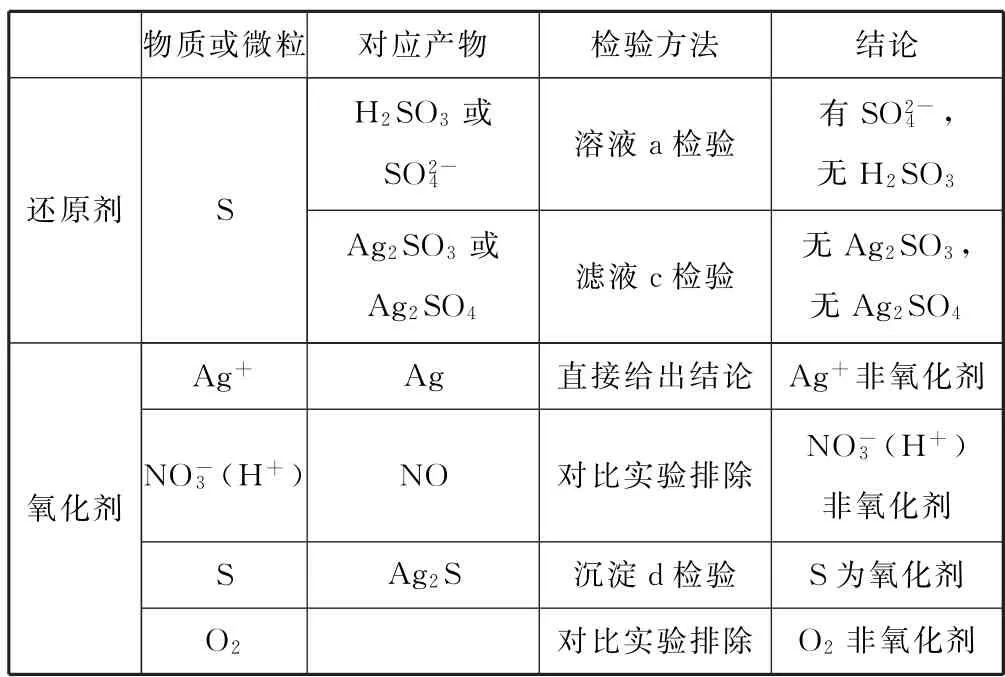
表1 整体分析
综合以上信息,体系中反应物是Ag+和S(还有H2O),产物为Ag2S和,也就是硫元素歧化,反应方程式:6 Ag++4S+4 H2O+8 H+.分析电极反应式:S+2e-=S2-可知,Ag+与S2-形成Ag2S难溶物,降低c(S2-)可以提高S 的氧化性,利于反应发生.
读者可以分析类似的情境:CuSO4溶液与铜粉不反应,但是Cu Cl2溶液可与铜粉反应生成Cu Cl.
3 结语
实验探究题兼具基础性、综合性、应用性和创新性,凸显对学科关键能力和学科核心素养的考查.高效解答此题需要考生在熟练掌握基础知识的同时能够快速准确读懂题意,明确思路,灵活运用多种探究方法.
(完)
