高考中滴定实验的重要考点和案例分析
2023-11-20刘庆
刘 庆
(广西桂林市中山中学)
滴定实验是高中化学最为重要的实验之一.滴定实验分为酸碱中和滴定、氧化还原滴定及沉淀滴定.本文对滴定实验常见考点及几类问题进行详细分析.
1 滴定实验常见考查内容
在高考试题中,围绕着滴定实验的常见考点有仪器的运用是否合理、操作是否正确、指示剂的选择及反应终点的确定等.仪器的运用及操作部分常考的有酸式、碱式滴定管的选择,查漏、洗涤、润洗、读数等常见步骤的具体操作.因此,学生需要熟悉做滴定实验时需要用到的仪器及其基本操作,常见的指示剂及其特征性反应等,如酚酞、甲基橙、石蕊等常用指示剂适用的p H 范围.另外,计算、误差分析等问题也是常见的考点.学生在解答这类问题时,需要根据反应式,找到各物质之间的关系,而后进行计算.相关步骤如图1所示.
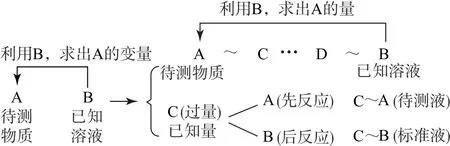
图1
2 酸碱中和滴定
酸碱中和作为滴定实验中最为经典的一类问题,是考查的重点.试题通常考查仪器的运用、操作、滴定终点的确定以及相应的计算等.
例1(2017年全国Ⅰ卷26,改编)凯氏定氮法测定蛋白质中氮的含量过程如图2所示.

图2
已知:NH3+H3BO3=NH3•H3BO3,
NH3•H3BO3+HCl=NH4Cl+H3BO3.
取甘氨酸(C2H5NO2)样品mg进行测定,消耗浓度为cmol•L-1的HClVmL,则样品中N 元素的质量分数为_________.样品的纯度小于等于_________.

由题意可知,C2H5NO2中的N 元素先转化为NH3,NH3被H3BO3吸收后变为NH3•H3BO3.由N 原子守恒可知
由NH3•H3BO3+HCl=NH4Cl+H3BO3可得
所以n(C2H5NO2)=n(HCl),样品中N 元素的质量分数为
样品纯度小于等于
3 氧化还原滴定
氧化还原反应是高中化学重要反应类型之一,滴定问题是考查氧化还原知识的主要题型.在氧化还原反应中,产物会与指示剂呈现显色反应,以此来确定反应终点.因此,学生需要在题目中没有给出反应方程式时,能够根据题目,写出相应的反应式,在此基础之上,进行相应的计算.
例2利用K2Cr2O7标准溶液测定硫代硫酸钠(Na2S2O3•5 H2O,M=248 g•mol-1).测定步骤如下:称取1.200 g Na2S2O3•5 H2O 晶体,配制成100 mL溶液,取0.009 5 mol•L-1的K2Cr2O7标准溶液20 mL,硫酸酸化后加入过量KI,发生反应:
然后用Na2S2O3•5 H2O 溶液滴定至淡黄绿色,发生反应:.以淀粉溶液为指示剂,继续滴定,当溶液_________,即为滴定终点.平行滴定3 次,若消耗Na2S2O3•5 H2O溶液的平均量为24.80 mL,则样品纯度为________.

K2Cr2O7溶液中加入过量KI,发生反应:+6I-+14 H+=3I2+2Cr3++7 H2O,此时I-全部被氧化为I2,加入淀粉溶液后,溶液变为蓝色.加入Na2S2O3•5 H2O 溶液后发生反应:,I2转化为I-,蓝色会褪去,且30 s内不复色,即为滴定终点.在整个过程中,涉及两个反应式,之间的关系为,则
则其纯度为
例3环己烯含量测定:在一定条件下,向ag环己烯样品中加入bmol Br2,反应后剩余的Br2与足量的KI反应生成I2,用cmol•L-1的Na2S2O3标准溶液进行滴定,终点时消耗Na2S2O3标准溶液VmL.(以上数据均已扣除干扰因素).测定过程中,发生的反应如下:
则样品中,环己烯的质量分数为_________.

根据上述反应可知,关系式为
整个过程中,环己烯和KI共消耗bmol Br2,根据关系式有
所以样品中环己烯的质量为
4 沉淀滴定
沉淀滴定法是以沉淀反应为原理的一种滴定方法.其中最常见的题型是以Ag NO3标准溶液测定卤化物、硫氰酸盐等,离子反应为Ag++X-=Ag X↓(X-通常为Cl-、Br-、I-、SCN-等).当滴定剂与被滴定溶液反应时,会生成其他颜色的沉淀,此时达到滴定终点.需要注意的是,若反应开始时便存在沉淀,则所选择试剂与其反应产生的沉淀,颜色需存在差别.
例4表1 为各种Ag 盐的颜色和Ksp,以K2Cr2O7为指示剂,用Ag NO3标准溶液滴定待测液,测定溶液中Cl-的浓度.

表1
(1)滴定终点现象为________.
(2)若用Ag NO3溶液滴定KSCN 溶液,指示剂为________.
A.KBr B.NaCl
C.Na CN D.Na2Cr O4

(1)根据各物质的Ksp分析可以发现,当Cl-完全沉淀时,Ag+与生成Ag2Cr O4沉淀,滴定终点现象为滴入最后一滴标准液时,生成砖红色沉淀,且30 s内沉淀不溶解.
(2)Ag NO3溶液滴定KSCN 溶液过程中,Ag+与SCN-产生沉淀,当SCN-完全沉淀后,Ag+会与指示剂进行反应,这就要求产生与AgSCN 颜色不同的沉淀,因为Ag Cl、Ag CN 均为白色,所以不能使用NaCl、Na CN 作为指示剂.同时,添加的指示剂不能先于SCN-与Ag+反应.所以应该选择Na2Cr O4作指示剂.
综上所述,滴定实验作为重要实验之一,在题目中通常会对仪器的运用、操作,指示剂的选择,反应终点的确定及相关计算等进行考查,学生在复习备考时要注意总结归纳.
(完)
