铝胁迫下苹果酸对灰木莲幼苗生理特性的影响
2023-11-16禤俊卿谢慈江石驭天申礼凤杨梅何春
禤俊卿 谢慈江 石驭天 申礼凤 杨梅 何春
铝胁迫下苹果酸对灰木莲幼苗生理特性的影响
禤俊卿1谢慈江2石驭天1申礼凤2杨梅2何春1
(1. 广西国有高峰林场 广西南宁 530000;2. 广西大学林学院/广西高等学校林业科学与工程重点实验室 广西南宁 530004)
为了解灰木莲(Blume)幼苗对酸铝复合胁迫的生理适应性,以灰木莲幼苗为试验对象,采用不同浓度的苹果酸(0、5、10、15 mmol/L)和铝(0、60、120、150 mg/L)模拟酸铝复合胁迫,测定幼苗叶绿素、MDA、可溶性糖、可溶性蛋白含量和POD、SOD、CAT活性。结果表明,相同铝浓度下,添加中低浓度苹果酸处理的灰木莲叶绿素a、叶绿素b和叶绿素总量普遍高于未添加苹果酸处理,MDA、可溶性糖和可溶性蛋白含量均随苹果酸浓度增加呈先升高后下降的变化趋势,中低浓度的苹果酸(5、10 mmol/L)能够增加中低铝浓度(60、120 mg/L)处理下灰木莲的POD和CAT活性。10 mmol/L苹果酸能够有效缓解灰木莲受到的浓度为150 mg/L的铝胁迫,5 mmol/L苹果酸能够有效缓解灰木莲受到的浓度为60和120 mg/L的铝胁迫。
酸铝胁迫;灰木莲;苹果酸;生理特性
灰木莲(Blume)为木兰科()木莲属常绿阔叶大乔木,原产于越南、印度尼西亚等地,树干通直,高大挺拔,树形优美,材质优良,抗性强且生长快,我国广西、广东、云南、福建等地相继成功开展了灰木莲的引种栽培[1]。灰木莲具有较强的光合能力和固碳释氧能力,且早期耐荫性较强,对微酸性至酸性红壤土有较强的适应能力,凋落物量大[2],是提升我国南方人工纯林质量的优秀混交树种。随着国家生态公益林建设,灰木莲作为速生用材树种在华南地区被广泛推广和种植,在植被恢复和涵养水源等方面发挥着重要作用[3-5]。当前灰木莲存在育苗材料缺乏[6]等生产难题,针对灰木莲环境胁迫方面的研究主要集中在光照胁迫[7]、水淹胁迫[8]和低温胁迫[9]。关于酸铝胁迫对灰木莲影响的研究几近空白。
近年来由于酸雨的频繁沉降及生理酸性化肥的大量使用,土壤中的铝化作用大大加强,红壤地区发生酸雨的频率高,降雨量大,红壤普遍呈强酸性(pH 4.0~5.5),其富铝化程度为全国最高[10]。因此,铝毒被认为是南方红壤地区农作物减产的重要原因之一[11]。生长于酸性土壤的植物易受到营养元素缺失和重金属毒害的威胁,严重影响林木产业的发展。在铝的外部排斥解毒过程中,有机酸例如苹果酸能够与铝形成稳定的复合体,使得离子态的金属转变成低毒或无毒的螯合态形式,从而使植物达到体外解除铝毒害效应的目的[12]。郑开敏等[13]研究发现,适宜质量浓度的有机酸能够有效缓解铝胁迫对豆瓣菜的伤害作用;亢亚超等[14]研究发现,低浓度AlCl3(0.2 mmol/L)胁迫可促进格木幼苗的生长。因此,探究酸铝处理对植物生理指标的影响,对研究林木栽培及选育具有现实指导意义。本研究以灰木莲幼苗为试验对象,研究不同浓度苹果酸和铝处理下灰木莲幼苗植株叶绿素、渗透调节物质含量和抗氧化酶活性等生理指标的变化规律,并以此为基础探索酸铝胁迫下灰木莲生理特性的抗性机制;结合南方地区灰木莲的实际生存条件,从另一个角度丰富了灰木莲酸铝毒害的研究,从而为灰木莲的生产、管理和应对酸铝复合胁迫提供理论支持。
1 材料与方法
1.1 材料
1.1.1 试验地概况 试验地位于广西大学林学院苗圃,属典型的亚热带季风气候,气候温和,雨量充沛,年均温约21.6℃。
1.1.2 试材 试材为无病虫害、长势健康整齐的8个月生灰木莲苗木,种源来自广西凭祥,平均苗高(31.24±5.46)cm,平均地径(5.74±0.81)mm。
1.1.3 育苗基质 育苗基质为60%黄心土+20%河沙+20%珍珠岩,于2018年3月移栽植株至育苗袋(高19 cm,直径21 cm),经一个月缓苗处理后进行试验。
1.2 方法
1.2.1 试验设计 采用双因素随机试验设计,在不同铝处理(0、60、120、150 mg/L)的基础上增施苹果酸(0、5、10、15 mmol/L),以添加等体积的营养液为空白对照(CK),详见表1,同时控制营养液pH为4.5(以0.1 mol/L HCl和0.1 mol/L NaOH调节),每个处理3个重复,1个重复15株苗木。试验于2018年4月开始,以1/6 Hoaglan营养液的形式浇灌不同浓度的铝溶液[Al2(SO4)3·18H2O配制],3 d后增施不同浓度的苹果酸(C4H6O5,去离子水配制),每30 d重复以上步骤一次,历时6个月,浇施前后2 d内禁止浇水,以保证培养液充分吸收。
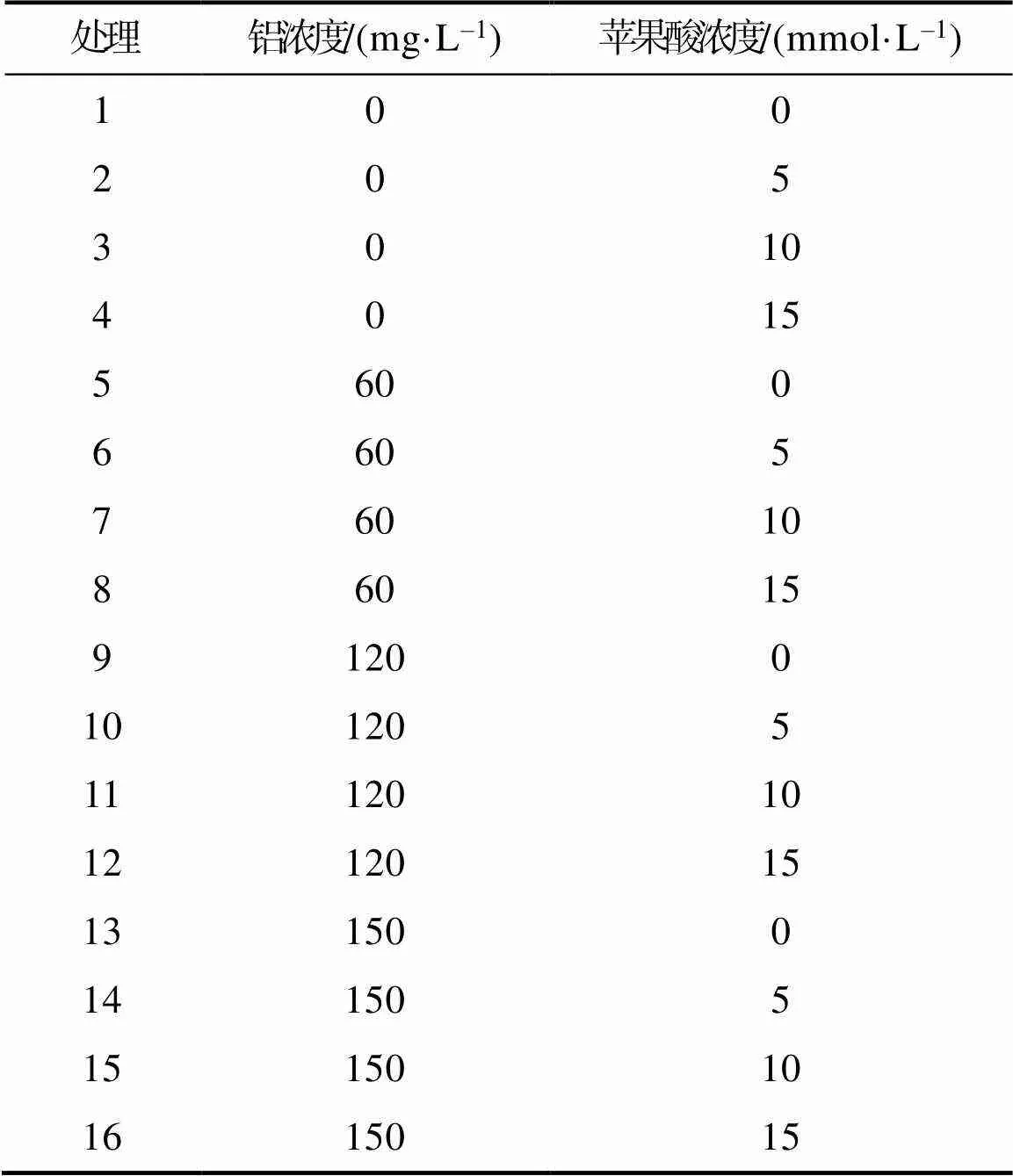
表1 铝和苹果酸浓度处理的设置
1.2.2 指标测定 2018年10月试验结束后,随机从各处理选取不同生长方向的成熟叶片,采用丙酮乙醇提取法测定叶绿素含量,硫代巴比妥酸法测定丙二醛(MDA),蒽酮比色法测定可溶性糖,考马斯亮蓝G-250染色法测定可溶性蛋白,愈创木酚比色法测定过氧化物酶(POD),NBT光化还原法测定超氧化物歧化酶(SOD),紫外光吸收法测定过氧化氢酶(CAT)。
1.2.3 数据处理 试验数据采用Excel 2010进行统计、整理,绘制图表,以IBM SPSS Statistics 26进行One-WayANOVA方差分析(Duncan,<0.05)和相关性分析(Pearson),采用隶属函数对苗木质量进行综合评价。
隶属值(X)(X‒Ximin)/(Xmax‒Xmin)
式中:X为指标测定值;Xmax和Xmin为所有处理中某项指标的最大值和最小值。
2 结果与分析
2.1 铝和苹果酸处理对灰木莲幼苗叶绿素含量的影响
由表2可知,不同酸铝浓度下灰木莲幼苗叶绿素a、叶绿素b和叶绿素总量变化明显(< 0.05),总体上随着铝浓度的上升呈先上升后下降的趋势。其中,在低浓度铝处理(60 mg/L)下,叶绿素a、叶绿素b和叶绿素总含量均最高,而在高浓度铝处理(150 mg/L)下各叶绿素含量最低。在不受铝胁迫的情况下,灰木莲幼苗各色素含量随着苹果酸浓度的上升呈先上升后下降的趋势,中浓度苹果酸(10 mmol/L)处理下达到最高;同时在低中浓度(60、120 mg/L)铝胁迫下,添加低浓度(5 mmol/L)的苹果酸处理,各色素含量较高,显著高于其他处理。而在高浓度铝(150 mg/L)胁迫下,添加中浓度(10 mmol/L)的苹果酸处理,各色素含量较高,显著高于其他处理。

表2 铝和苹果酸对灰木莲幼苗叶绿素含量的影响 单位:mg/g
注:表格中不同大写字母表示同一铝浓度下,不同浓度苹果酸处理之间差异显著(<0.05);不同小写字母表示同一苹果酸浓度下,不同浓度铝处理之间差异显著(<0.05),下同。
2.2 铝和苹果酸处理对灰木莲幼苗渗透调节物质含量的影响
由表3可知,灰木莲幼苗MDA、可溶性糖和可溶性蛋白含量受铝浓度和苹果酸浓度影响显著。在低、中浓度(60、120 mg/L)铝胁迫下,添加低浓度(5 mmol/L)的苹果酸处理,MDA含量较低;可溶性糖、可溶性蛋白含量较高,与其他处理差异显著。在高浓度铝(150 mg/L)胁迫下,添加中浓度(10 mmol/L)的苹果酸处理,MDA含量较低;可溶性糖、可溶性蛋白含量最高,与其他处理差异显著。
2.3 铝和苹果酸处理对灰木莲幼苗抗氧化酶活性的影响
由表4可知,铝浓度和苹果酸浓度对灰木莲抗氧化酶活性影响显著。灰木莲幼苗SOD、POD和CAT活性在未受铝胁迫的情况下,随着苹果酸浓度的上升呈先上升后下降的趋势。在低、中浓度(60、120 mg/L)铝胁迫下,添加低浓度(5 mmol/L)的苹果酸处理,SOD和POD活性较高;在高浓度(150 mg/L)铝胁迫下,添加中浓度(10 mmol/L)的苹果酸处理SOD和CAT活性较高,添加高浓度(15 mmol/L)的苹果酸处理POD活性最高。

表3 铝和苹果酸对灰木莲幼苗渗透调节物质含量的影响
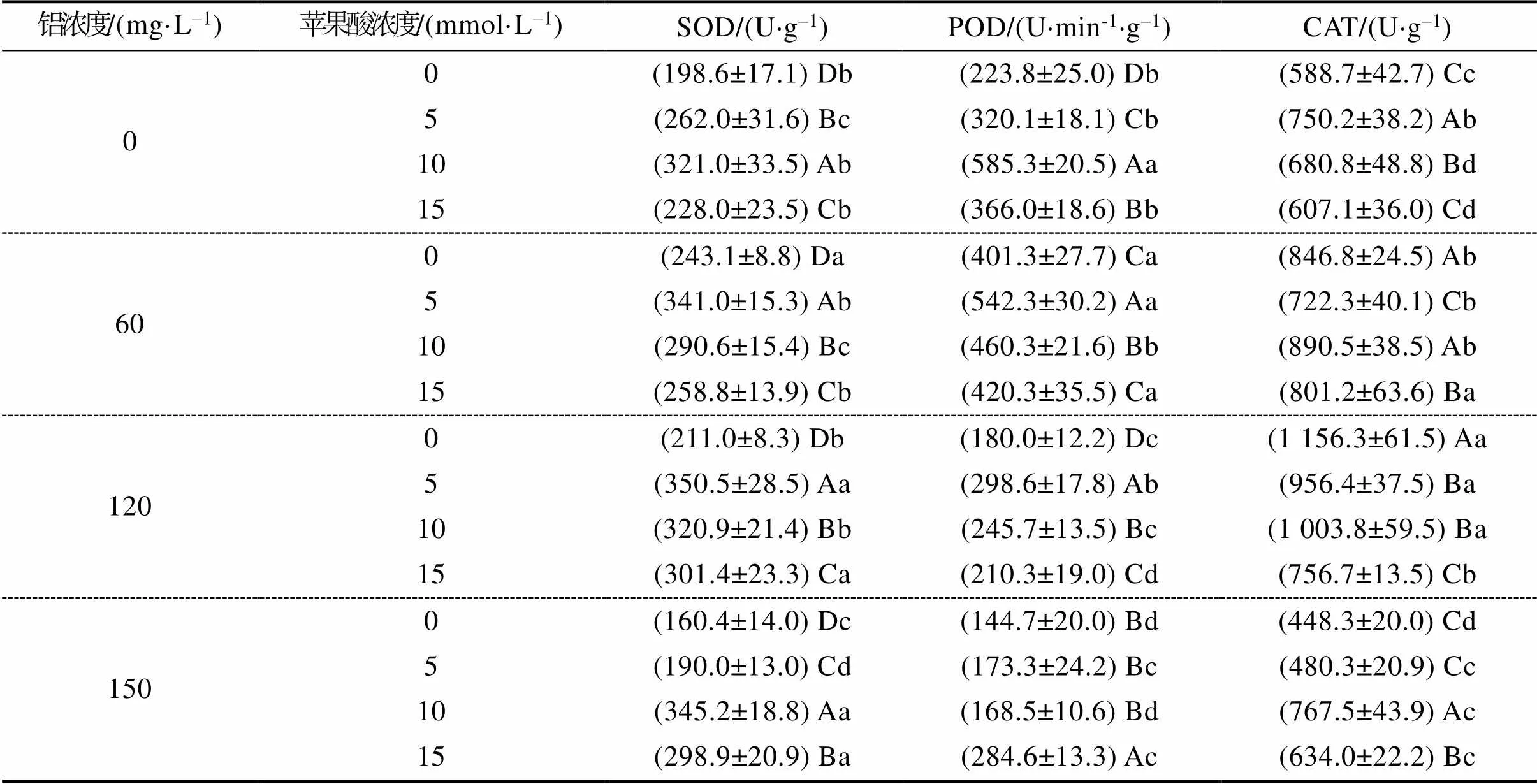
表4 铝和苹果酸对灰木莲幼苗抗氧化酶活性的影响
2.4 不同浓度铝和苹果酸处理下灰木莲幼苗生理指标相关性以及综合评价
由表5可知,总体而言,灰木莲叶绿素含量与可溶性糖、可溶性蛋白含量、抗氧化酶活性显著正相关,叶绿素含量、SOD、POD活性与MDA含量显著或极显著负相关。由表6可知,各处理隶属值排序(前3)为处理10>处理6>处理15,即中浓度铝+低浓度苹果酸处理>低浓度铝+低浓度苹果酸处理>高浓度铝+中浓度苹果酸处理,表明当受高浓度(150 mg/L)铝胁迫时,中浓度(10 mmol/L)的苹果酸处理下,灰木莲生理状况最佳;而受低中浓度(60、120 mg/L)铝胁迫时,低浓度(5 mmol/L)苹果酸处理下,灰木莲生理状况最佳。
注:“**”表示在0.01级别(双尾),相关性极显著(<0.01);“*”表示在0.05级别(双尾),相关性显著(<0.05)。

表6 不同浓度铝和苹果酸处理对灰木莲生理特性影响的综合评价
注:1,叶绿素a含量;2,叶绿素b含量;3,叶绿素总含量;4,MDA含量;5,可溶性糖含量;6,可溶性蛋白含量;7,SOD活性;8,POD活性;9,CAT活性。
3 讨论与结论
光合色素的含量影响叶绿素对光能的吸收、传递及分配,以及转换合成的量,同时也体现植株受胁迫的程度[15]。本研究发现,低浓度铝能够促进灰木莲幼苗叶绿素b含量的提升。随着铝浓度的提升,各叶绿素含量均有不同程度的下降,低浓度铝有利于灰木莲叶绿素的合成,这是由于一定浓度的铝可维持细胞膜的稳定性,减少细胞内的外渗物[16];伴随着浓度的提升,过量的铝离子结合叶绿素酸酯还原酶,进而降低其活性。苹果酸的添加能够有效提高灰木莲植株叶绿素含量,尤其是中浓度(10 mmol/L)的苹果酸,适宜酸度条件能够促进其生长,超出正常范围即对植株生长产生抑制,抑制作用与酸性强度呈正相关,这与桉树[17]的研究结果相类似。在同一浓度铝胁迫下,灰木莲叶绿素含量随着苹果酸浓度的增加呈先增加后下降的趋势,产生这种现象的原因可能是灰木莲幼苗根系所处土壤中的Al3+在一定程度上能够与苹果酸螯合,抑制了灰木莲对活性Al3+的输送;而随着铝浓度的提高,苹果酸对铝胁迫的缓解作用并未随着浓度的上升而增强,植株叶绿体被膜存在被高浓度Al3+破坏的可能[18],黑麦草[19]对有机酸的响应也有相类似的规律。可见施加苹果酸可有效缓解铝胁迫对植物光合色素产生的伤害,提高植物的光能捕捉能力和光合作用能力,增强灰木莲耐铝性。
MDA是细胞质膜不饱和脂肪酸过氧化的产物,其含量通常被用来表示逆境胁迫下生物膜系统损伤的程度[20]。本研究中,随着铝浓度的升高,MDA含量呈升高趋势,浓度越高,MDA含量积累量更大,说明铝胁迫下灰木莲的细胞膜脂过氧化严重,细胞膜受到严重损伤。可溶性蛋白质和可溶性糖是植物体内的主要渗透调节物质,能为细胞提供能量,保持细胞渗透势。单一铝胁迫或酸胁迫下灰木莲可溶性糖、可溶性蛋白含量总体上增加,可见逆境使灰木莲启动了自身保护机制,其体内渗透调节物质大量合成与积累[21]。在铝胁迫下施用苹果酸,灰木莲在不同浓度苹果酸胁迫下,可以通过增加可溶性蛋白和可溶性糖含量、降低MDA含量来维持水分和渗透平衡,以提高植物对逆境的抵抗力[22],说明高浓度苹果酸能改变灰木莲体内的物质代谢途径,从而改变渗透调节物质含量。
SOD、POD、CAT等抗氧化酶是植物体内清除活性氧、减少羟基自由基形成的重要酶类,能够保护细胞免受伤害[23]。单一低浓度铝胁迫会刺激灰木莲抗氧化酶活性升高,这是因为少量的铝可以通过提高保护酶活性来清除代谢过程中产生的活性氧自由基等有害物质,使灰木莲处于比较旺盛的新陈代谢中,为体内有机物合成提供充足的氮源。而在高质量浓度铝胁迫下,3种抗氧化酶的活性均受到强烈抑制,推测此时活性氧清除系统已经遭到破坏,细胞内活性氧(ROS)含量上升[24],植株受到严重的氧化胁迫。而施加苹果酸能有效减少铝胁迫对上述指标的伤害程度,提高灰木莲的耐铝性,以中低浓度的苹果酸效果为佳,说明一定浓度的苹果酸能够有效缓解铝对灰木莲的毒害。虽然灰木莲具有一定抗铝机制,但过量的酸铝胁迫依然能够破坏植物的生理平衡[25],对叶片抗氧化系统产生毒害,可能是高浓度苹果酸加强了铝毒害作用,抑制植物清除活性氧自由基的能力,导致活性氧的积累。
一定浓度外源苹果酸能够起到较为理想的缓解铝毒作用,但浓度过高则会使缓解作用减弱,甚至对植物产生更严重的毒害[26],这可能是因为高浓度有机酸会加剧根际环境的酸化,刺激可溶性铝活性的增大,从而加重植物根际铝的毒害。本试验采用相关性分析和模糊数学的隶属函数值法对不同浓度铝和苹果酸处理下灰木莲苗木生理质量进行了综合评价,结果表明,添加苹果酸能不同程度地缓解铝胁迫对灰木莲幼苗的毒害作用,但不同浓度的铝毒作用下,苹果酸对植株所受生理毒害的缓解效果不同,苹果酸浓度为10 mmol/L时,对缓解灰木莲受到的浓度为150 mg/L的铝胁迫最为有效;苹果酸浓度为5 mmol/L时,对缓解灰木莲受到的浓度为60和120 mg/L的铝胁迫最为有效。
[1] 曾冀, 卢立华, 贾宏炎. 灰木莲生物学特性及引种栽培[J]. 林业实用技术, 2010(10): 20-21.
[2] 曾珠, 毛纯, 李万年, 等. 林分改造对桉树人工林土壤微量元素的影响[J]. 森林与环境学报, 2022,42(3): 253-261.
[3] 韦善华, 何斌, 魏国余, 等. 速生阶段灰木莲人工林营养元素积累及其分配格局[J]. 东北林业大学学报, 2012, 40(12): 36-39.
[4] 卢立华, 何日明, 农瑞红, 等. 坡位对灰木莲生长的影响[J]. 林业科学研究, 2012, 25(6): 789-794.
[5] 卢立华, 何日明, 农瑞红, 等. 灰木莲生长对土壤养分和气候因子的响应[J]. 应用生态学报, 2014, 25(4): 961-966.
[6] 韩吉思, 易冠明, 方小荣, 等. 生根剂及插条粗度对灰木莲扦插生根影响[J]. 内蒙古农业大学学报(自然科学版), 2018, 39(4): 34-38.
[7] 刘金炽, 招礼军, 朱栗琼. 遮阴对三种木兰科幼苗生长和光合特性的影响[J]. 广西植物, 2020, 40(8): 1 159-1 168.
[8] 叶龙华, 杨振意, 薛立, 等. 3种幼苗对水淹胁迫的生理响应[J]. 华南农业大学学报, 2012, 33(3): 368-372.
[9] 郭淑红, 薛立, 张柔, 等. 4种幼苗对低温胁迫的光合生理响应[J]. 华南农业大学学报, 2012, 33(3): 373-377.
[10] 曹林, 马丽, 吴玉环, 等. 菊芋对酸铝复合胁迫的生理响应[J]. 生态环境学报, 2016, 25(2): 233-240.
[11] Pattanayak A, Pfukrei K. Aluminium toxicity tolerance in crop plants: Present status of research[J]. African Journal of Biotechnology, 2013, 12(24): 3 752-3 757.
[12] 孙琴, 倪吾钟, 杨肖娥. 有机酸在植物解铝毒中的作用及生理机制[J]. 植物学通报, 2002, 19(4): 496-503.
[13] 郑开敏, 肖家昶, 马俊英, 等. 柠檬酸对铝胁迫下豆瓣菜生长及生理的影响[J]. 江苏农业学报, 2022, 38(2): 476-485.
[14] 亢亚超, 刘萍, 王凌晖, 等. 格木幼苗对硝普钠-酸铝互作的生理响应[J]. 植物科学学报, 2019, 37(4): 521-529.
[15] 张永福, 任禛, 陈泽斌, 等. 水杨酸对缓解葡萄苗铝毒害的生理机制[J]. 华北农学报, 2015, 30(1): 182-187.
[16] 蒋时姣, 钟宇, 刘海鹰, 等. 铝胁迫对柳杉组培苗生长及生理特性的影响[J]. 植物生理学报, 2015, 51(2): 227-232.
[17] 杨梅, 吴幼媚, 黄寿先, 等. 不同桉树优良无性系幼苗对酸铝的抗性生理响应差异[J]. 林业科学, 2011, 47(6): 181-187.
[18] 孙文君, 杨蔚, 许文花, 等. 苜蓿幼苗对铝胁迫的生理响应及综合评价[J]. 热带亚热带植物学报, 2021, 29(1): 50-58.
[19] 黄玉婷, 刘大林, 张卫红, 等. 柠檬酸对铝胁迫下苗期黑麦草生长生理的影响[J]. 环境科学与技术, 2019, 42(7): 44-50.
[20] 刘强, 柳正葳, 龙婉婉, 等. 芒萁、玉米对酸铝胁迫生理响应的比较[J]. 江苏农业科学, 2017, 45(2): 65-69.
[21] 姚虹宇, 刘亚敏, 张盛楠, 等. 外源柠檬酸对铝胁迫下马尾松生理特性的影响[J]. 林业科学, 2018, 54(7): 155-164.
[22] Gagoonani S, Enteshari S, Delavar K, et al. Interactive effects of silicon and aluminum on the malondialdehyde (MDA), proline, protein and phenolic compounds inL.[J]. Journal of Medicinal Plants Research, 2011, 5(24): 5 818-5 827.
[23] 郑阳霞, 赵善梅, 向前, 等. 铝胁迫对豆瓣菜生理特性及营养元素吸收的影响[J]. 甘肃农业大学学报, 2019, 54(4): 83-91.
[24] 覃凌薇, 李琳, 陆海燕, 等. 闽楠幼苗对硝普钠——酸铝互作的生理响应[J]. 江西农业学报, 2022, 34(3): 172-178.
[25] 侯文娟, 胡厚臻, 鲁莹莹, 等. 磷对铝胁迫下尾巨桉生长生理方面的缓解作用[J]. 东北林业大学学报, 2016, 44(5): 5-9+19.
[26] Martins N, Goncalves S, Andrade P B, et al. Changes on organic acid secretion and accumulation in Plantago almogravensis Franco and Plantago algarbiensis Samp. under aluminum stress[J]. Plant Science, 2013, 198: 1-6.
Effects of Malic Acid on the Physiological Characteristics ofBlume Seedlings under Aluminum Stress
XUAN Junqing1XIE Cijiang2SHI Yutian1SHEN Lifeng2YANG Mei2HE Chun1
(1. Guangxi Gaofeng State Owned Forest Farm, Nanning, Guangxi 530000, China; 2. College of Forestry, Guangxi University/Guangxi Colleges and Universities Key Laboratory for Forestry Science and Engineering, Nanning, Guangxi 530004, China)
To understand the adaptability ofBlume seedlings to acid-aluminum compound stress,seedlings were used as experimental objects in different concentrations of malic acid (0, 5, 10, 15 mmol×L‒1) and aluminum (0, 60, 120, 150 mg×L‒1), and the chlorophyll, MDA, soluble sugar, and soluble protein content, and POD, SOD, and CAT activities of seedlings were determined. The results showed that under the same aluminum concentration, the chlorophyll a, chlorophyll b, and total chlorophyll ofin the treatments with medium and low malic acid concentrations were generally higher than those without malic acid. The concentrations showed a trend of first increasing and then decreasing. The medium and low malic acid concentrations (5 and 10 mmol×L‒1) could increase the low and medium aluminum concentrations (60, 120 mg×L‒1) under the treatment. In conclusion, 10 mmol×L‒1malic acid can effectively alleviate the Al stress of 150 mg×L‒1, and 5 mmol×L‒1malic acid can effectively remit the Al stress of 60-120 mg×L‒1aluminum stress.
Aluminum acid stress;Blume; malic acid; physiological characteristics
S792.99
A
10.12008/j.issn.1009-2196.2023.09.005
2022-11-24;
2023-01-28
广西自筹经费林业科技项目“红锥人工林土壤功能微生物筛选与应用研究”(No.桂林科研[2022ZC]第30号)。
禤俊卿(1965—),男,学士,高级工程师,研究方向为森林培育、森林资源调查,E-mail:785587958@qq.com。
何春(1966—),男,硕士,高级工程师,研究方向为林业经营管理,E-mail:smjhch@163.com。
(责任编辑 林海妹)
