鸭源奇异变形杆菌和摩氏摩根菌的分离鉴定、NDM 耐药基因检测及中药体外抑菌试验
2023-11-15石玉节柴贝贝张彦昕
石玉节,柴贝贝,张彦昕
(郑州赛科药业科技有限公司,河南 郑州 450000)
变形杆菌是人和动物的一种常见条件致病菌,以普通变形杆菌(Proteus vulgaris)和奇异变形杆菌(Proteus mirabilis)最为常见[1]。 变形杆菌可引起腹泻、肾盂肾炎、尿道炎、脑膜炎、菌血症等疾病,严重时导致死亡[2-4]。 摩氏摩根菌(Morganella morganii)为兼性厌氧的革兰阴性菌,是一种条件致病菌,可引起腹泻以及伤口和尿道感染,严重时可引起菌血症[5]。 近些年,变形杆菌和摩氏摩根菌的临床分离率越来越高, 且很多临床分离菌株都呈现出较强的耐药性[6]。 携带介导对碳青酶烯类抗菌药物耐药的blaNDM基因的“超级耐药菌”的出现,使得被称为人类治疗革兰阴性菌感染“最后一道防线” 的碳青酶烯类抗菌药物无法发挥较好的治疗作用, 对人类健康和公共卫生安全造成了严重威胁[7],也对畜牧养殖业造成了严重的经济损失。 流行病学调查报告显示,blaNDM基因主要在人医和兽医临床上的克雷伯菌和大肠杆菌中传播[8],关于分离出携带blaNDM基因的摩氏摩根菌报道较少。
2021 年11 月, 广东省某鸭场的部分鸭只开始发病,初期病鸭精神沉郁、羽毛凌乱,并排出黄绿色水样稀粪,后期发病鸭只陆续死亡。为确定引起病鸭死亡的细菌性病原种类, 笔者从发病鸭场采集病料进行病原菌分离培养及鉴定; 在确定病原菌种属的基础上, 对分离菌株进行抗菌药物敏感性试验和NDM 耐药基因检测,并评价单味中药对分离菌株的体外抑菌效果, 筛选对分离菌株具有明显抑菌作用的中药, 以期为该类疾病的防治提供参考。
1 材料与方法
1.1 试验材料
1.1.1 病料来源
肝脏、 脾脏等病料样本采集自广东省某鸭场的发病鸭只。
1.1.2 主要试剂及受试药物
营养肉汤培养基、普通营养琼脂培养基、沙门志贺菌属(SS)琼脂培养基、麦康凯琼脂培养基,南京建成生物科技有限公司产品;革兰染液试剂盒,索莱宝科技有限公司产品;细菌生化微量鉴定管,青岛海博生物技术有限公司产品;PCR 试验相关试剂,北京全式金生物技术股份有限公司产品。
13 种药敏纸片,杭州滨和微生物试剂有限公司产品。 野菊花、大黄、金银花、连翘、苦参、辣木、骆驼刺、枇杷叶、桑叶、黄柏、防风、射干、桔梗、博落回,均购自河南省禹州市永铭药业有限公司。
1.1.3 主要仪器设备
SW-CJ-1F 型超净工作台, 苏州净化设备有限公司产品;LS-50LD 型立式压力蒸汽灭菌器,江阴滨江医疗设备有限公司产品;LI-9272 型恒温培养箱,上海龙跃仪器设备有限公司产品;PA43 BIO型光学显微镜,麦克奥迪实业集团有限公司产品;DYY-6D 型电泳仪, 北京市六一仪器厂产品;A050911-014 型UVP 凝胶成像系统,美国思博明科学器材公司产品。
1.2 试验方法
1.2.1 细菌分离培养
将灼烧过的剪刀烙烤病变组织表面, 用剪刀剪开组织, 手持灼烧过的接种环伸入切口轻轻转动后取出, 分别于普通营养琼脂培养基、SS 琼脂培养基、麦康凯琼脂培养基上划线接种,37 ℃恒温培养18 h; 挑取不同形态的单个菌落接种于普通肉汤培养基中,37 ℃恒温振荡培养8 h; 划线接种于普通营养琼脂培养基进行纯化培养, 直至培养基上出现单一菌落。
1.2.2 革兰染色镜检
从长有单一菌落的平板培养基上, 无菌挑取单个菌落,使用革兰染色试剂盒进行染色,光镜下观察细菌形态、排列方式及染色特征。
1.2.3 生化鉴定
在无菌环境下, 使用接种环挑取纯化培养后的单个菌落,接种于生化微量鉴定管中,置于恒温培养箱中37 ℃培养24 h 后,观察试验结果。
1.2.4 16S rDNA 序列PCR 扩增及测序分析
采用煮沸法提取分离菌株的基因组DNA。PCR 扩增采用细菌16S rDNA 序列通用引物,上游引 物 (rmtc-F) 序 列:5′-AGAGTTTGATCMTGGCTCAG-3, 下游引物(rmtc-R) 序列:5′-AAGGAGGTGAGCCAGCCGCA-3′,预期扩增产物大小1 500 bp。 PCR 反应体系为25 μL:2×TaqMix 12.5 μL,ddH2O 8.5 μL,DNA 模板3 μL,上、下游引物各0.5 μL。 PCR 反应条件:94 ℃预变性10 min;94℃变性45 s,56 ℃退火30 s,72 ℃延伸90 s, 共32个循环;72 ℃延伸10 min,4 ℃保存。 反应结束后,取6 μL PCR 产物进行1%琼脂糖凝胶电泳检测,将阳性扩增产物送往生工生物工程(上海)股份有限公司完成测序。
1.2.5 基于16S rDNA 的系统进化树构建
在NCBI 的GenBank 数据库中, 将分离菌株的16S rDNA 测序结果与已公布的细菌16S rDNA序列进行BLAST 比对; 根据比对结果用DNAStar软件进行同源性分析, 并使用Mega-X 软件中邻接法(Neighbor-Joining method,NJ)构建系统进化树, 通过分离菌株的同源性分析及在进化树上的分支确定其对应种属。
1.2.6 抗菌药物敏感性试验
对分离纯化的菌株进行抗菌药物敏感性试验,参照K-B 纸片扩散法,结果参照美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI) 推荐的抗菌药物敏感性试验执行标准进行耐药、中介、敏感的结果判定。
1.2.7 NDM 耐药基因检测
采用PCR 法检测10 种NDM 耐药基因在分离菌株中的分布情况。 目的基因引物序列参照相关文献设计[9-10],引物序列及预期扩增产物长度见表1。 引物由生工生物工程(上海)股份有限公司合成。 以提取的分离菌基因组DNA 为模板,不同耐药基因对应不同的引物,参照“1.2.4”项下的反应体系和反应条件进行PCR 扩增。 反应结束后,取扩增产物进行1%琼脂糖凝胶电泳检测,并观察记录结果。

表1 10 种NDM 耐药基因检测所用引物序列信息
1.2.8 中药体外抑菌试验
1.2.8.1试验菌液及单味中药药液制备
菌液制备: 无菌挑取分离菌单个纯菌落于营养肉汤培养基中培养8~12 h。 用普通营养肉汤培养基稀释培养液,使菌液浓度达到1×107CFU/mL,备用。
单味中药液制备:采用水煎煮沸法制备试验所需所有药材的中药药液,每种中药各称取60 g,水煎2 次,合并2 次滤液,浓缩至药材与药液比1∶1,使中药药液终浓度为1 g/mL,高压蒸气灭菌30 min,4 ℃保存,备用。
1.2.8.2 最小抑菌浓度(MIC)的测定
采用肉汤二倍稀释法测定各单味中药对分离菌株的MIC。 如果药液本身透明, 则直接判定结果;若药液颜色较深,在培养结束后无法直接观察结果, 则使用接种环挑取每孔培养液在普通营养琼脂培养基上划线培养24 h, 以无菌生长的最低稀释度为MIC。
2 结果与分析
2.1 细菌分离及革兰染色镜检结果
从病变组织中分离出2 株具有鉴定意义的菌株,将2 株分离菌株分别命名为SK1、SK2。 2 株菌在普通营养琼脂培养基上均呈现圆形、灰白色、中央突起、表面光滑的单个菌落;SK1 株在麦康凯琼脂培养基上呈圆形、扁平、半透明、表面光滑的菌落,在SS 琼脂培养基上为半透明、中央黑色或整个菌落都呈黑色的圆形、 扁平菌落;SK2 株在SS琼脂培养基及麦康凯琼脂培养基上均为无色菌落。 革兰染色镜检显示,2 株分离菌株均为革兰阴性菌,其形状以短杆状为主,两端钝圆,多数为中等大小。
2.2 生化鉴定试验结果
生化鉴定试验结果见表2,根据《伯杰氏系统细菌学手册(第八版)》,SK1 株的鉴定结果与奇异变形杆菌基本相符,SK2 株的鉴定结果符合摩氏摩根菌的生化特性。

表2 分离菌株SK1、SK2 的生化鉴定结果
2.3 16S rDNA 序列的PCR 扩增结果
如图1 所示,SK1 株和SK2 株的PCR 扩增产物大小均在1 500 bp 左右,获得的目的条带单一、清晰,片段与预期扩增片段大小相符。
图1 分离菌株的16S rDNA 序列PCR 扩增产物1%琼脂糖凝胶电泳检测结果
2.4 16S rDNA 序列同源性分析及进化树的构建
通过使用MegAlign 软件比较分析测序获得的SK1 株、SK2 株16S rDNA 序 列 与GenBank 中已公布的细菌16S rDNA 序列的同源性,判定2 株菌的种属。 由图2 可知,分离株SK1 与20 株参考菌株的16S rDNA 序列进行比对,同源性为93.4%~99.6%, 与美国人体粪便来源Proteus mirabilis 分离株(GenBank 登录号:JX006386.1)、中国南京市黑水蝇幼虫体内Proteus mirabilis 分离株(Gen-Bank 登录号:OK053814)同源性最高,达99.6%,因此, 将SK1 株鉴定为奇异变形杆菌(Proteus mirabilis); 分离株SK2 与20 株参考菌株的16S rDNA 序列进行比对, 同源性为93.7%~99.2%,与中国云南省动物粪便来源Morganella morganii 分离株(GenBank 登录号:KC456528)、荷兰微生物实验室Morganella morganii 分离株 (GenBank 登录号:KJ626253.1)同源性最高,达99.2%,因此,将SK2 株鉴定为摩氏摩根菌(Morganella morganii)。

图2 分离菌株的16S rDNA 序列同源性比对分析
对SK1 株、SK2 株以及GenBank 中收录的20株参考菌株的16S rDNA 序列绘制系统进化树。由图3 可知,22 株细菌的16S rDNA 序列在进化上分为两大支,SK1 株与中国南京市黑水蝇幼虫体内Proteus mirabilis 分 离 株 (GenBank 登 录 号:OK053814) 属于同一分支,SK2 株与中国云南省动物粪便来源Morganella morganii 分离株(Gen-Bank 登录号:KC456528)属于同一分支,遗传关系最为密切。
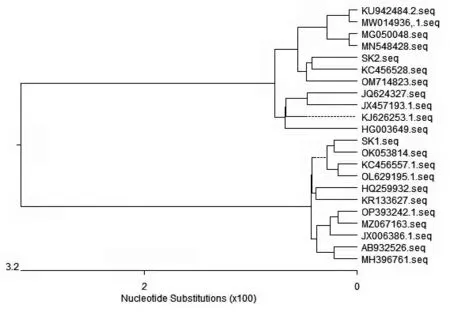
图3 基于细菌16S rDNA 构建的系统进化树
2.5 抗菌药物敏感性试验结果
分离菌株的抗菌药物敏感性结果见表3。 由表3 可知,SK1 株对新霉素、头孢他啶、头孢噻肟、头孢哌酮、环丙沙星敏感,对其余8 种抗菌药物耐药;SK2 株对庆大霉素、卡那霉素、新霉素、头孢他啶、头孢噻肟、头孢哌酮敏感,对多西环素、复方新诺明、恩诺沙星、氟苯尼考、多黏菌素B 耐药,环丙沙星和左氧氟沙星中介。
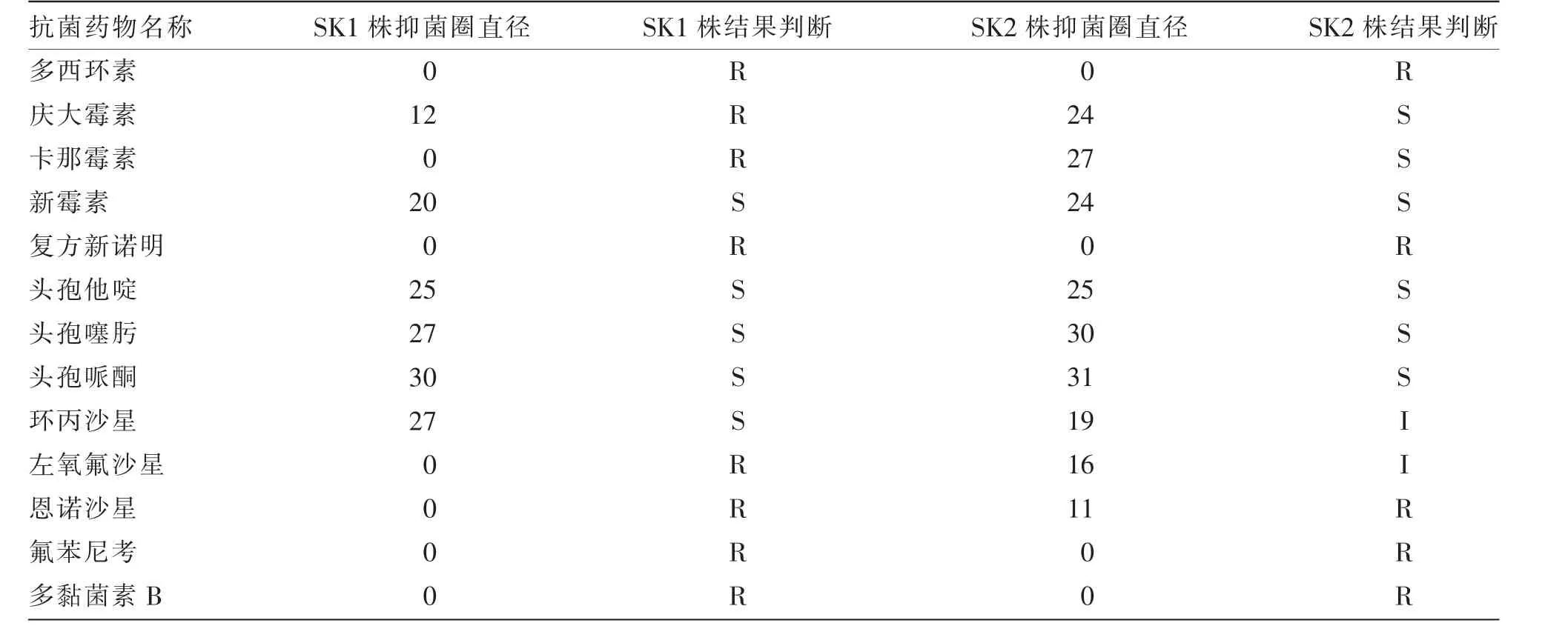
表3 分离菌SK1 株、SK2 株的抗菌药物敏感性试验结果 单位:mm
2.6 NDM 耐药基因检测结果
对分离菌株SK1、SK2 进行10 种NDM 耐药基因的PCR 检测, 结果显示,SK2 株检测出blaNDM-1基因, 其他9 种NDM 耐药基因菌未检出;SK1 株10 种NDM 耐药基因均未检出。
2.7 单味中药对分离菌株的MIC
单味中药对2 株分离菌的体外抑菌效果见表4。由表4 可知,博落回对SK1 株的抑菌效果最强,MIC 为3.906 mg/mL; 其次是大黄和金银花,MIC为31.25 mg/mL; 然后是苦参和连翘,MIC 分别为125、250 mg/mL;野菊花、骆驼刺、枇杷叶和射干的MIC 均为500 mg/mL。 连翘对SK2 株的抑菌效果最强,MIC 为3.906 mg/mL;其次为博落回,MIC 为7.812 5 mg/mL;金银花的MIC 为15.625 mg/mL;大黄、骆驼刺的MIC 为31.25 mg/mL;辣木的MIC 为62.5 mg/mL;苦参、射干的MIC 为125 mg/mL;野菊花的MIC 为250 mg/mL; 枇杷叶、 桑叶、 防风的MIC 为500 mg/mL。
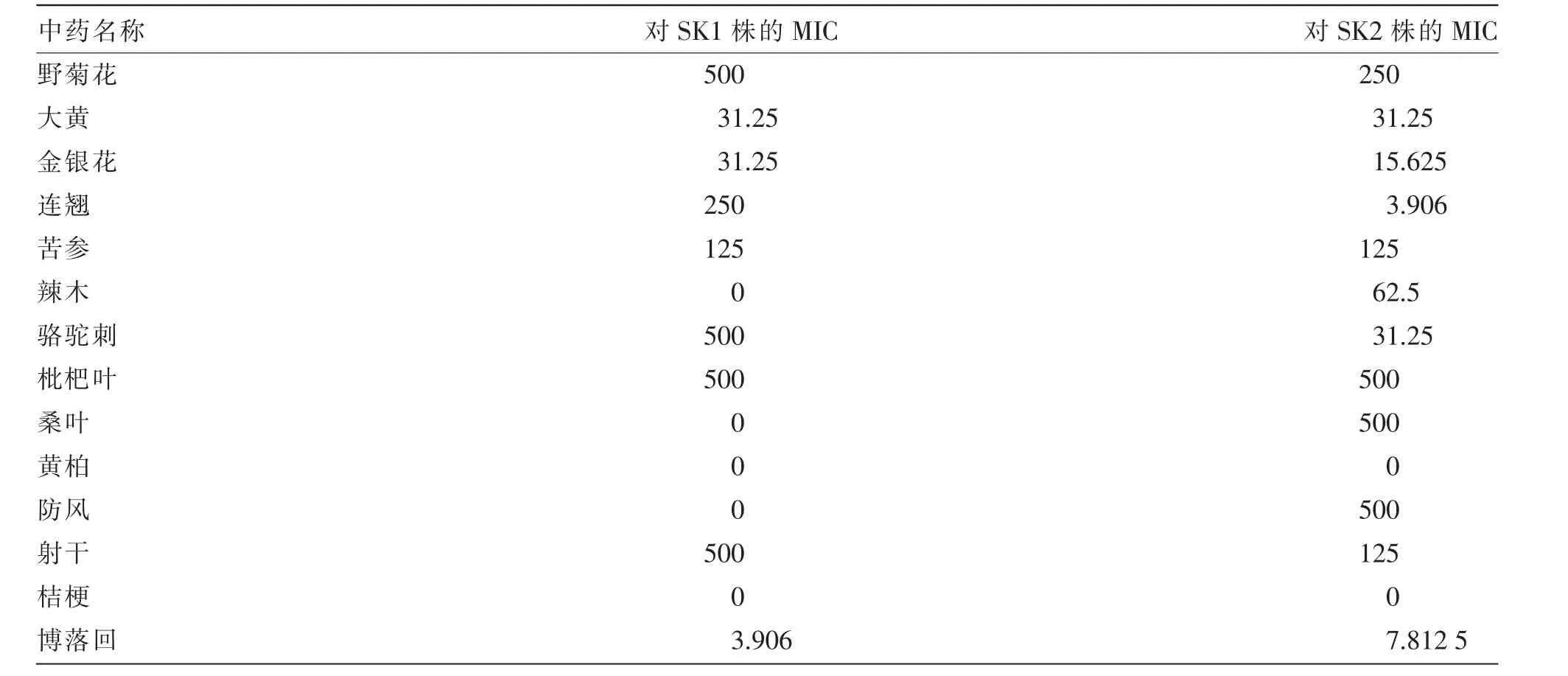
表4 中药对分离菌SK1 株、SK2 株的MIC 测定结果 单位:mg/mL
3 讨论
奇异变形杆菌存在于被污染的水源、 粪肥和土壤中,对人和动物都具有感染性。在畜牧生产领域, 奇异变形杆菌引起的感染是近些年多发的急性细菌性传染病,发病主要集中家禽中,鸭感染奇异变形杆菌的报道较为少见[11]。 本研究分离的奇异变形杆菌SK1 株,对新霉素、头孢他啶、头孢噻肟、头孢哌酮、环丙沙星敏感,此结果与近些年报道的医源、 动物源奇异变形杆菌药物敏感性研究结果相似[12-14]。 有研究报道,兔源奇异变形杆菌对环丙沙星高度敏感[15],但也有报道称人源奇异变形杆菌对环丙沙星耐药[16-17],这种差异可归因于菌株宿主来源的不同。 张萍等[18]报道狐狸源奇异变形杆菌对头孢菌素类药物敏感, 这一结果与本研究结果相似, 即鸭源奇异变形杆菌SK1 株对头孢噻肟、头孢哌酮、头孢他啶敏感。 杨霞等[19]报道鸭源奇异变形杆菌对头孢氨苄耐药, 头孢氨苄是第一代头孢菌素类药物; 本研究中鸭源奇异变形杆菌对头孢噻肟、头孢哌酮、头孢他啶敏感,三者均为第三代头孢菌素类药物; 提示相同动物来源的奇异变形杆菌对同类药物的敏感性差异可能与药物代次有关。
摩氏摩根菌属于肠杆菌科摩根菌属, 广泛存在于人和动物的粪便、污水、土壤中,在机体免疫力低下时可条件性致病, 且该菌的天然耐药性严重[20]。近年来,有很多关于摩氏摩根菌引起人和多种动物疾病的相关报道, 甚至可引起人和动物的死亡[21]。目前有摩氏摩根菌引起乌鱼、中华鳖、牛、猪、鸡、兔等动物感染的报道[22],但是关于从鸭体内分离出摩氏摩根菌报道相对较少。 本研究分离出的摩氏摩根菌SK2 株对庆大霉素、卡那霉素、新霉素、头孢他啶、头孢噻肟、头孢哌酮敏感,对多西环素、复方新诺明、恩诺沙星、氟苯尼考、多黏菌素B 耐药, 这一结果与文献报道的鳀鱼源摩氏摩根菌对抗菌药物的敏感性检测结果相似[23];并且该菌株检测出blaNDM-1耐药基因,说明该鸭场存在碳青霉烯类抗菌药物耐药性传播和扩散的风险。
单味中药体外抑菌结果显示, 博落回对奇异变形杆菌SK1 株的抑菌效果最强,大黄、金银花次之;连翘对摩氏摩根菌SK2 株的抑菌效果最强,其次为博落回和金银花。 其他中药对SK1 株和SK2株的体外抑菌效果不如以上中药理想。 此结果可为治疗鸭源奇异变形杆菌和摩氏摩根菌感染参考依据。但本研究仅进行了体外试验,中药在进入动物体内是否能对上述2 种菌发挥有效的抑制效果,还需进一步试验验证。
4 结论
引起该鸭场鸭群发病的主要病原菌为奇异变形杆菌和摩氏摩根菌,可使用新霉素、头孢菌素类抗菌药物及中药博落回、 连翘对患病鸭只进行治疗。
