GC-MS 法测定不同地区生鲜牛乳中的脂肪酸组成及含量
2023-11-15刘兵
刘 兵
(商丘职业技术学院,河南 商丘 476000)
生鲜牛乳中的主要固体成分为脂肪、蛋白质、乳糖, 其中, 脂肪含量最高, 一般在3%~5%(W/V),包括甘油三酯、甘油二酯、磷脂、鞘脂、非酯化脂肪酸以及胆固醇等[1]。 牛乳中的脂肪酸可以分为三大类, 即饱和脂肪酸 (saturated fatty acid,SFA)、 单不饱和脂肪酸 (monounsaturated fatty acid,MUFA) 和多不饱和脂肪酸(polyunsaturated fatty acid,PUFA),其中,长链饱和脂肪酸的含量普遍较高[2]。 脂肪酸的组成以及比例是牛乳质量与营养价值的重要衡量指标, 而脂肪酸分子的高度结构多样性增加了鉴定和定量的复杂性。 近年来有许多研究注重于测定生鲜牛乳中的脂肪酸的组成及含量,常见的方法有气相色谱-氢火焰离子检测 (gas chromatography-flame ionization detection,GC-FID)、气相色谱与质谱连用(gas chromatography-mass spectrum,GC-MS)、直接进样质谱、液相色谱与质谱连用 (liquid chromatography-mass spectrometry,LC-MS)等。 GC-MS 法借助气相色谱法的高效分析能力和质谱的准确鉴定能力, 在脂肪酸的检测乳品上具有一定优势,且定量限较低,可以达到0.001 g/100 g[3]。 GC-MS 法是一种简单易行、 准确可靠的方法, 适用于牛乳脂肪酸的检测。有研究结果显示,生鲜牛乳中脂肪酸主要以饱和脂肪酸为主,其含量达到了62.43%[4]。
脂肪酸的组成和比例对牛乳质量与营养价值具有重要指示和评价作用。本研究采用GC-MS 方法对3 个地区规模化奶牛养殖场的生鲜牛乳样品进行检测, 重点分析河南省牧场生鲜牛乳的脂肪酸组成特征, 并与相邻省份河北省和山西省采集的乳样进行比较, 以期为河南省乳业资源的合理开发和利用, 以及解析不同地区生鲜牛乳质量差异提供参考。
1 材料与方法
1.1 试验材料
1.1.1 样品来源
于2019 年5 月至2020 年3 月,从河南省、河北省、山西省各选取1 个规模化奶牛养殖场,按照四个季节采集健康奶牛乳样,每个季节采集1 次,每次采样设3 个平行,每次采集的乳样由10 头奶牛的乳样混合, 即每个地区采集乳样12 份,3 个地区共36 份乳样。采集牛乳后及时进行样品处理和分析测定。
1.1.2 主要试剂
盐酸、二氯甲烷、无水碳酸钠均为分析纯,购自天津科密欧化学试剂有限公司;乙酰氯、无水甲醇均为色谱纯, 美国默克公司产品;37 种脂肪酸甲酯混标品,美国Sigma 公司产品。
1.1.3 仪器与设备
6890-5975 型气相色谱-质谱联用分析仪,美国Agilent Technologies 公司产品;7683B 型自动进样器, 美国Agilent Technologies 公司产品;XW-80A 型涡旋混合器, 宁波新芝生物科技股份有限公司产品;BSA124S-CW 型电子分析天平, 德国Sartorius 公司产品;Sorvall ST 8 低速离心机,美国Thermo Fisher Scientific 公司产品;DC-0515 恒温水浴锅,上海衡平仪器仪表有限公司产品。
1.2 试验方法
1.2.1 脂肪酸的提取及甲酯化
准确量取30 mL 牛乳置于50 mL 离心管,加入5 mL 的二氯甲烷/甲醇溶液(2∶1,V/V),并加入3 mL 的盐酸溶液(0.1 mol/L),剧烈振摇60 min 使离心管内液体明显分层;收集下层有机相,旋转蒸发浓缩后将有机相倒入离心管,4 000 r/min离心10 min;吸取1 mL 上层有机油相进行甲酯化操作。
将以上1 mL 脂肪提取液置于10 mL 离心管,加入10%的乙酰氯甲醇溶液5 mL,氮气保护及70℃水浴条件下振荡60 min;随后取出冷却至室温,加入6%的碳酸钠溶液3 mL 混匀,4 000 r/min 离心10 min,取甲酯上清液进行气相色谱分析。
1.2.2 分析条件
气相色谱条件: 使用CP-WAX 52 CB 毛细管色谱柱(30 m×0.32 mm×0.5 μm),载气:高纯氦气,压力设置为95 kPa,流量为1 mL/min,以不分流模式进行注射。 程序升温:GC 柱温箱以10 ℃/min 的速率从50 ℃程序升温至175 ℃,保持15 min,然后以5 ℃/min 的速率升温至240 ℃,在240 ℃下保持10 min, 最后以90 ℃/min 的速率升温至250 ℃并保持5 min。 总运行时间为60 min, 进样温度为250 ℃,进样量为1 μL,吹扫流速为10 mL/min,吹扫时间为2 min[5]。
质谱条件:70 eV 的电子轰击离子源, 质量扫描范围为45~700 m/z。 扫描时间为1.00 s,扫描间延迟时间为0.50 s。 质谱仪的分辨率调整为2 000。 离子源温度设置为250 ℃,传输线保持在250 ℃。
1.2.3 定性与定量方法
定性分析方法为将生鲜牛乳样品待测组分的出峰保留时间与37 种脂肪酸甲酯混合标准品的保留时间进行比对,同时使用NIST05 谱库进行脂肪酸的定性结构分析,确定其脂肪酸组成成分。采用面积归一化法计算各脂肪酸含量。
1.3 数据处理与分析
所有样品按照上述处理方法进行脂肪酸分析,结果以每个地区乳样脂肪酸含量的“平均值±标准偏差”表示。
2 结果与分析
2.1 脂肪酸甲酯混合标准品定性
通过比较生鲜牛乳中脂肪酸甲酯的化学结构GC 保留时间与37 种脂肪酸甲酯混合标准品的保留时间,以及通过比较质谱与NIST05 数据库中可用的图谱进行定性分析。 37 种混合标准品的色谱图如图1 所示,相对应的脂肪酸甲酯组成、出峰顺序以及每种成分占比如表1 所示。 生鲜牛乳中脂肪酸甲酯的检测结果如图2 所示。 与标准混标图谱相比, 生鲜牛乳样本的脂肪酸甲酯图谱存在少量的杂质基线干扰, 但是各种脂肪酸甲酯的峰形和分离度均良好, 证明该分析方法适合牛乳中脂肪酸含量的测定。

表1 脂肪酸甲酯混合标准品的组成及洗脱顺序 单位:%
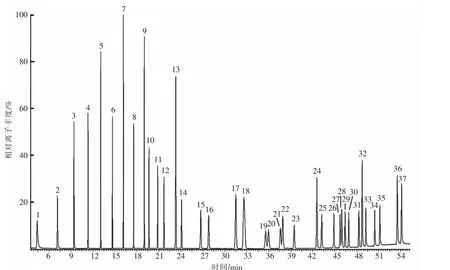
图1 脂肪酸甲酯混合标准品总离子流图
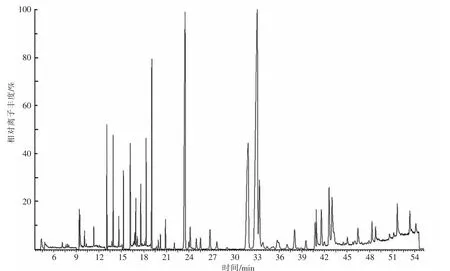
图2 生鲜牛乳中脂肪酸对应的脂肪酸甲酯随时间变化的相对离子丰度
2.2 不同地区生鲜牛乳中脂肪酸组成及含量检测结果
根据色谱图中保留时间对比以及NIST05 数据库检索, 可以确定生鲜牛乳样品中含量较高的脂肪酸甲酯有癸酸甲酯、月桂酸甲酯、十三烷酸甲酯、肉豆蔻酸甲酯、棕榈酸甲酯、硬脂酸甲酯、油酸/反油酸甲酯、花生酸甲酯、木蜡酸甲酯等,通过面积归一化法对各脂肪酸含量进行计算, 结果如表2 所示。 3 个地区的生鲜牛乳中都未检测到反亚油酸甲酯、γ-亚麻酸甲酯、 顺-15-碳烯酸甲酯、芥酸甲酯、顺-4,7,10,13,16,19-二十二碳六烯酸甲酯, 原因可能是牛乳中这些不饱和脂肪酸含量本身就很低,达不到GC-MS 分析条件的检测限。

表2 不同地区采集的生鲜牛乳中脂肪酸甲酯组成及含量(n=12) 单位:%
从河南省采集的生鲜牛乳中检测出的脂肪酸甲酯结果来看,共检出28 种脂肪酸;饱和脂肪酸种类有15 种,其中,癸酸甲酯[(6.66±1.45)%]、月桂酸甲酯[(4.18±0.96)%]、肉豆蔻酸甲酯[(9.01±1.76)%]、硬脂酸甲酯[(17.15±1.98)%]、棕榈酸甲酯[(20.03±2.34)%]5 种饱和脂肪酸含量较高,占检出脂肪酸总含量的57.03%;不饱和脂肪酸种类有13 种,多数含量较低,只有油酸/反油酸甲酯含量较高,占检出脂肪酸总含量的32.26%。 从河北省以及山西省采集的生鲜牛乳中均检出30 种脂肪酸,但其组成有所不同:河北省乳样中未检出花生酸甲酯, 山西省乳样中未检出顺-11-二十碳一烯酸甲酯;2 个省份生鲜牛乳的脂肪酸含量检测结果与河南省生鲜牛乳的检测结果相似, 饱和脂肪酸含量占检出脂肪酸总含量的比例均在60%左右。 河北省生鲜牛乳中的油酸/反油酸含量为39.80%,在3 个地区中最高。
3 讨论
3.1 样品中脂肪酸的提取
该研究使用GC-MS 法进行生鲜牛乳中的脂肪酸含量测定,该方法要求脂质样品经过水解、脂肪提取、脂肪酸甲酯化等处理步骤之后,才可进样分析。 由于牛乳中的许多脂肪是以游离态而非结合态的形式存在,所以一般不需要经过水解过程,直接从牛乳中提取脂质即可[6]。 脂肪酸的提取方法 常 参 考Folch 等[7]和Bligh 等[8]报 道 的 通 用 方法,前者使用氯仿/甲醇(2∶1,V/V)作为萃取溶剂,后者使用氯仿/甲醇(1∶2,V/V)加1 体积的氯仿/水(1∶1,V/V)作为提取溶剂。 近年来有许多基于上述2 种方法的脂质提取方法改进,例如,有研究使用甲基叔丁基醚作为提取溶剂, 体系分层后有机相位于上层, 避免了传统方法中收集提取液时将移液枪头穿过上层溶液进入下层而造成的提取物污染[9]。 有研究发现在使用氯仿甲醇溶剂提取脂质时加入0.1 mol/L 的盐酸溶液可以提高样品中的脂质回收率[10]。在该研究中,考虑到氯仿的毒性较强且具有挥发性,因此,选择使用二氯甲烷代替氯仿进行脂质提取, 同时在提取溶剂中加入了0.1 mol/L 的盐酸以提高提取效率。
3.2 脂肪酸的甲酯化
脂肪酸含有羧基的极性基团, 极性大、 沸点高,因此,不能直接进行气相分析,需要进行脂肪酸甲酯化处理, 变成极性低且易挥发的甲酯化衍生物。常见的脂肪酸甲酯化方法有酯交换法[11]、酸碱酯化法[12]、乙酰氯-甲醇化法[13]等。 酸酯化法能够甲基化所有脂肪酸, 但过程相当耗时并且可能导致共轭亚油酸发生结构的改变[14]。 碱酯化法反应速度快, 但存在部分脂肪酸不能被甲基化的问题。乙酰氯-甲醇化法操作简单、结果可靠,特别适合大批量样品的处理,因此,该研究选择乙酰氯-甲醇法进行甲酯化处理。 从生鲜牛乳样品中的色谱图结果可以看出, 该研究应用的GC-MS 法检测灵敏度高, 脂肪酸甲酯的峰形对称与混合标准品没有区别, 也证明了脂肪酸甲酯化的处理是成功的。
3.3 牛乳样品中的脂肪酸含量
牛乳中存在400 余种脂肪酸[15],然而由于检测技术的限制,截至目前,已有的研究报道中对牛奶中脂肪酸含量的分析测定不超过50 种。牛乳中常被检测到的脂肪酸包括丁酸(C4:0)、己酸(C6:0)、辛酸(C8:0)、癸酸(C10:0)、月桂酸(C12:0)、肉豆蔻酸(C14:0)、肉豆蔻油酸(C14:1)、十五烷酸(C15:0)、棕榈酸(C16:0)、棕榈油酸(C16:1)、十七烷酸(C17:0)、硬脂酸(C18:0)、油酸(C18:1)和亚油酸(C18:2),以及大量低丰度脂肪酸, 包括花生四烯酸(C20:4)、二十碳五烯酸(C20:5)和二十二碳六烯酸(C22:6,DHA)。 文献报道,牛乳中最丰富的脂肪酸有棕榈酸、油酸、肉豆蔻酸和硬脂酸[16],该研究中3 个地区的生鲜牛乳脂肪酸含量检测结果与文献报道相似。 中国荷斯坦奶牛乳中的部分营养成分和矿物质元素含量接近或优于荷斯坦奶牛和西门塔尔牛。同时,中国荷斯坦奶牛乳的脂肪酸含量和组成与荷斯坦奶牛相近, 但脂肪酸组成优于西门塔尔牛[17]。 冷季牛乳粉的MUFA、PUFA、必需脂肪酸(essential fatty acid,EFA)含量和占比均高于暖季;而冷季牛乳粉的USFA 与SFA 比值为44.79%,暖季为38.55%[18]。 值得一提的是,该研究使用的毛细管色谱柱(30 m×0.32 mm×0.5 μm)不能使油酸和反油酸的峰分离,据文献报道,长度为100 m 的色谱柱也无法充分分离这对双键异构体, 理想的分离措施是气相进样前先使用薄层色谱法进行预分馏[19]。
该研究选取3 个地区的生鲜牛乳进行脂肪酸含量的测定,结果表明,3 个地区生鲜牛乳的脂肪酸组成和含量都没有明显区别, 唯一有所差异的是它们的油酸/反油酸含量。 河北省生鲜牛乳中的油酸/反油酸含量最高,接近检出脂肪酸总含量的40%。 3 个地区生鲜牛乳的脂肪酸中,肉豆蔻酸甲酯占比为7.11%~9.01%, 棕榈酸甲酯占比为19.3%~20.16%, 硬脂酸甲酯占比为16.53%~17.50%,油酸/反油酸甲酯含量在脂肪酸中比例最高(32.26%~39.80%)。 据郭艳霞等[20]的研究显示,广西地区水牛乳中的脂肪酸含量具有明显的季节性变化, 在夏季的饱和脂肪酸含量要明显下降且长链脂肪酸占比增加,中链脂肪酸占比降低,而多不饱和脂肪酸含量基本不随季节而变化。
4 结论
对从河南省、河北省、山西省规模化奶牛养殖场采集的生鲜牛乳样品进行了脂肪酸组成及含量分析,结果表明,3 个地区生鲜牛乳中的脂肪酸含量都比较丰富,以饱和脂肪酸为主,所有脂肪酸中以油酸/反油酸甲酯含量最高,但脂肪酸组成及含量也存在一定差异。 研究结果为解析不同地区生鲜牛乳质量差异提供了参考。
