新疆南疆某规模化绵羊养殖场腹泻羔羊隐孢子虫感染情况及其分子鉴定
2023-11-15张博文司俊飞张振杰郭嘉栋赫永强余复昌
张博文,司俊飞,张振杰,郭嘉栋,陈 荣,赫永强,余复昌,齐 萌,2
(1.塔里木大学动物科学与技术学院,新疆 阿拉尔 843300;2.省部共建绵羊遗传改良与健康养殖国家重点实验室,新疆 石河子 832000)
隐孢子虫(Cryptosporidium)是引起人和动物腹泻的常见肠道寄生原虫之一, 多通过饮水或食物进行传播[1]。 成年绵羊感染隐孢子虫后,一般无明显临床症状; 羔羊感染隐孢子虫后, 可引起腹泻、脱水、消化不良、增长缓慢等临床症状[2]。 目前,已命名至少45 个隐孢子虫虫种,常见感染羊的隐孢子虫有微小隐孢子虫(Cryptosporidium parvum)、泛在隐孢子虫(C.ubiquitum)和肖氏隐孢子虫(C.xiaoi),其中,微小隐孢子虫和泛在隐孢子虫是人兽共患隐孢子虫虫种[3]。
在我国开展的调查结果显示, 绵羊隐孢子虫感染率为0.41%(2/489)~36.36%(36/99), 以新疆维吾尔自治区、宁夏回族自治区、吉林省和北京市的绵羊隐孢子虫感染率较高, 分别为36.36%(36/99)、33.75%(81/240)、32.86%(23/70) 和29.69%(19/64);以肖氏隐孢子虫为优势感染虫种,泛在隐孢子虫和微小隐孢子虫次之;以<3 月龄羔羊更易感染隐孢子虫[2,4-5]。
研究发现,微小隐孢子虫至少存在21 个亚型家族, 不同宿主之间微小隐孢子虫的亚型分布具有一定差异,其中Ⅱa 与Ⅱd 亚型家族可感染人和多种动物,Ⅱc 和Ⅱe 则仅感染人[6]。我国绵羊感染的微小隐孢子虫亚型主要为Ⅱd 亚型家族, 同时也发现少数感染Ⅱa 亚型家族[7-9]。 该研究结合显微镜观察和分子生物学技术, 检测新疆南疆某规模化养殖场腹泻羔羊隐孢子虫感染情况, 解析其基因亚型分布特点, 以期为我国新疆羊源隐孢子虫的致病性和遗传进化研究提供参考。
1 材料与方法
1.1 腹泻羔羊粪便样本的采集
2023 年4 月,在新疆南疆某规模化绵羊养殖场,采用一次性手套经直肠采集4 个品种1 月龄以内腹泻羔羊粪便样本共60 份,分别置于洁净自封袋中,标记信息后置4 ℃冷藏箱,送至实验室,4 ℃冰箱保存。
1.2 主要试剂与仪器
奥林巴斯CX31 显微镜, 日本Olympus 公司产品;A600 型PCR 仪,杭州朗基科学仪器有限公司产品;DYY-7C 型稳压稳流电泳仪及JY 系列电泳槽,北京六一生物科技有限公司产品;粪便全基因组DNA 提取试剂盒,OMEGA 公司产品;2×EasyTaq PCR Super Mix(+dye)和DL 2 000 Marker,北京全式金生物技术股份有限公司产品。
1.3 隐孢子虫卵囊显微镜观察
参考李治国等[10]报道的方法,采用饱和蔗糖溶液漂浮法检查粪便样本中的隐孢子虫卵囊。 取1~2 g 绵羊粪便样本于50 mL 烧杯中,加入30 mL蒸馏水充分搅拌均匀,经60 目筛网过滤至50 mL离心管中,3 000 r/min 离心2 min;弃去上清液,分别于离心管沉淀物中加入20 mL 饱和蔗糖溶液,充分搅拌均匀后,3 000 r/min 离心3 min; 吊环蘸取表层液膜置载玻片上,加盖玻片,置普通光学显微镜下观察。
1.4 腹泻羔羊粪便样本DNA 的提取
取约200 mg 粪便样本分别置于2 mL 离心管内,使用粪便全基因组DNA 提取试剂盒,按照操作流程提取粪便样本中的DNA, 每份样本提取200 μL DNA,置于-20 ℃保存。
1.5 隐孢子虫SSU rRNA 基因和微小隐孢子虫gp60 基因的PCR 扩增与电泳
参照文献[11]设计隐孢子虫SSU rRNA 基因序列引物,对所有DNA 样本进行PCR 扩增,鉴定隐孢子虫种属;参照文献[12]设计隐孢子虫gp60基因序列引物, 对鉴定为微小隐孢子虫的样本进行基因亚型鉴定; 引物均由苏州金维智生物科技有限公司合成, 引物序列见表1。 隐孢子虫SSU rRNA 基因和微小隐孢子虫gp60 基因的PCR 扩增均按照25 μL 反应体系进行,各组分分别为:2×EasyTaq PCR Super Mix(+dye)12.5 μL,上、下游引物各0.3 μL,双蒸水10.9 μL,粪便DNA 模板1 μL。

表1 隐孢子虫SSU rRNA 基因和gp60 基因序列信息
基于隐孢子虫SSU rRNA 基因位点, 两轮PCR 扩增条件均为:预变性94 ℃5 min;变性94 ℃30 s,退火55 ℃30 s,延伸72 ℃30 s,35 个循环;再延伸72 ℃5 min。每次PCR 扩增时,以塔里木大学兽医寄生虫学实验室保存的牛源安氏隐孢子虫(C.andersoni)DNA 样本为阳性对照, 以双蒸水为阴性对照。 基于微小隐孢子虫gp60 基因位点,两轮PCR 扩增反应条件均为:预变性94 ℃5 min;变性94 ℃45 s,退火58 ℃45 s,延伸72 ℃1 min,35个循环;再延伸72 ℃10 min。每次PCR 扩增时,以塔里木大学兽医寄生虫学实验室保存的牛源微小隐孢子虫DNA 样本为阳性对照,双蒸水为阴性对照。 PCR 反应结束后,每份样本分别取5 μL 扩增产物,于1%琼脂糖凝胶中进行电泳和观察。
1.6 隐孢子虫种属/基因亚型序列测定和比对分析
基于SSU rRNA 基因和gp60 基因位点进行PCR 扩增,将PCR 扩增呈阳性的产物均委托苏州金维智生物科技有限公司进行双向测序和序列拼接。 利用NCBI 中的BLAST,对测序获得的隐孢子虫序列和微小隐孢子虫基因亚型序列进行同源序列搜索,分别下载同源性较高的参考序列。对所获隐孢子虫种属/基因亚型序列和下载的参考序列,采用MEGA 7.0 软件进行比对分析,鉴定隐孢子虫的种类和微小隐孢子虫的基因亚型。
1.7 微小隐孢子虫基因亚型的种系发育进化树构建和分析
从NCBI 数据库中,分别下载不同地区和不同宿主源微小隐孢子虫基因亚型序列, 结合该研究所获微小隐孢子虫基因亚型序列,采用MEGA 7.0软件对所有序列进行比对分析, 以邻接算法(Neighbor-Joining,NJ) 构建微小隐孢子虫基因亚型种系发育进化树, 进化树的可靠性采用Bootstrap 分析进行检测。 根据种系发育树形成的聚类和分支, 分析微小隐孢子虫不同基因亚型之间的遗传进化关系。
2 结果与分析
2.1 隐孢子虫卵囊的形态学观察与种类初步鉴定
普通光学显微镜下(400×)观察可见,饱和蔗糖溶液中隐孢子虫卵囊呈圆形、 近圆形或不规则圆形,淡蓝紫色,周边有亮绿色折光带,卵囊大小约5 μm×5 μm(见图1)。 60 份羔羊腹泻粪便样本中有38 份样本中观察到隐孢子虫卵囊,阳性率为63.33%(38/60); 结合宿主年龄和形态学观察,初步鉴定该次调查所获虫种为微小隐孢子虫。
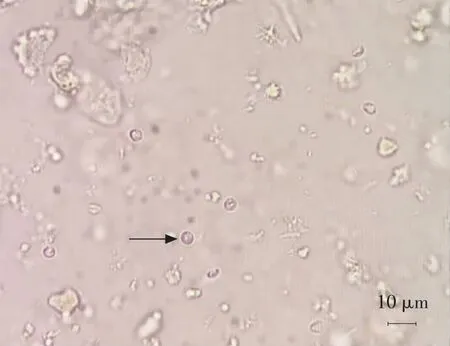
图1 普通光学显微镜下隐孢子虫卵囊的形态结构(400×)
2.2 隐孢子虫SSU rRNA 基因PCR 扩增结果及种属鉴定
基于隐孢子虫SSU rRNA 基因位点,60 份腹泻羔羊粪便DNA 样本中有52 份成功扩增约587 bp的条带,与目的条带相符(见图2)。
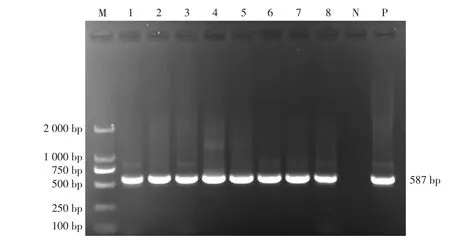
图2 隐孢子虫SSU rRNA 基因的PCR 扩增结果
经PCR 扩增可知,腹泻羔羊的隐孢子虫的阳性率为86.67%(52/60),其中,杜泊羊、澳湖羊、澳洲白羊、 湖羊羔羊的隐孢子虫阳性率分别为85.71%(6/7)、89.29%(25/28)、100%(8/8)、76.47%(13/17)(见表2)。 52 份隐孢子虫阳性样本均成功双向测序,经序列比对分析,所获隐孢子虫序列均与我国大庆市奶牛源微小隐孢子虫 (GenBank 序列登录号:OQ456120) 和法国山羊羔羊源微小隐孢子虫(GenBank 序列登录号:OQ938540)序列同源性为100%,均鉴定为微小隐孢子虫(见表2)。

表2 某规模化绵羊养殖场腹泻羔羊隐孢子虫感染情况
2.3 微小隐孢子虫gp60 基因PCR 扩增结果及基因亚型鉴定
基于gp60 基因位点对52 份微小隐孢子虫阳性样本进行PCR 扩增,49 份样本成功扩增出约850 bp 大小的条带,与目的片段相符(见图3),有3 份样本未能扩增成功。
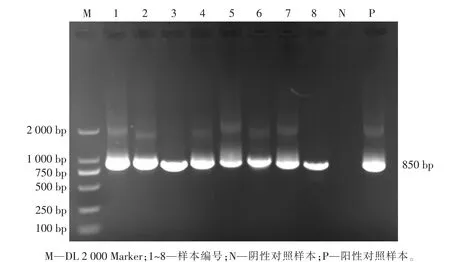
图3 隐孢子虫gp60 基因的PCR 扩增结果
49 份微小隐孢子虫阳性样本均成功双向测序, 经序列比对分析,49 条微小隐孢子虫序列均与我国安徽山羊源微小隐孢子虫亚型ⅡdA19G1(GenBank 序列登录号:MH049734)和陕西奶山羊源微小隐孢子虫亚型ⅡdA19G1(GenBank 序列登录号:KT235713)序列的同源性为100%,均鉴定为亚型ⅡdA19G1(见表3、图4)。
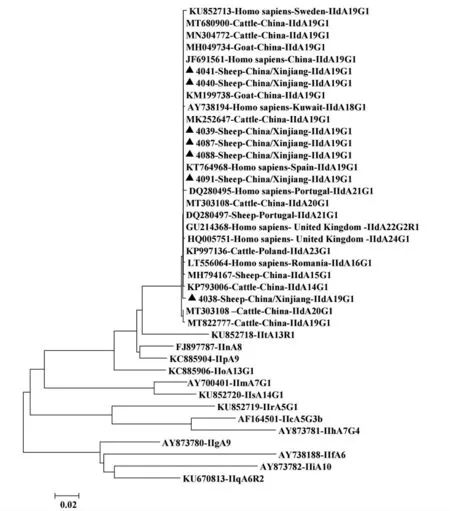
图4 基于隐孢子虫基因亚型构建的种系发育进化树

表3 微小隐孢子虫gp60 基因PCR扩增结果及基因亚型鉴定
2.4 微小隐孢子虫基因亚型种系进化分析
根据微小隐孢子虫gp60 基因序列构建的种系发育进化树可知, 微小隐孢子虫不同亚型家族形成不同的进化支,Ⅱf、Ⅱg、Ⅱi 和Ⅱq 亚型家族聚类形成一个进化支, 与其他亚型家族形成不同分支。 该研究所获绵羊源微小隐孢子虫基因亚型ⅡdA19G1 与科威特人源微小隐孢子虫基因亚型ⅡdA18G1,瑞典人源、我国牛源、山羊源微小隐孢子虫基因亚型ⅡdA19G1,葡萄牙人源微小隐孢子虫基因亚型ⅡdA21G1,波兰牛源微小隐孢子虫基因亚型ⅡdA23G1,英国人源微小隐孢子虫基因亚型ⅡdA24G1 等序列同处于一个亚群进化支;与Ⅱt亚型家族形成一个亚群, 而与其他亚型家族形成不同的亚群分支。
3 讨论
世界范围内,绵羊感染隐孢子虫较普遍,以羔羊更易感, 随宿主年龄增长而隐孢子虫感染率呈下降趋势。 至少有14 个隐孢子虫种/基因型可感染羊,在欧洲,绵羊以微小隐孢子虫为优势感染虫种;在大洋洲、亚洲和非洲,肖氏隐孢子虫为绵羊的优势感染虫种;而在北美洲和南美洲,泛在隐孢子虫为绵羊的优势感染虫种。上述研究结果提示,不同地理环境分布的绵羊感染隐孢子虫虫种/基因型存在一定的适应性遗传分布[13-14]。
在以色列的调查显示,31 份2~21 日龄腹泻绵羊羔羊的粪便样本中,通过PCR 法检测,有30份呈隐孢子虫感染阳性, 感染率为96.77%(30/31),均为微小隐孢子虫[15];在罗马尼亚的调查显示,175 份<21 日龄羔羊的腹泻粪便样本中, 通过显微镜观察检测, 有24 份呈隐孢子虫感染阳性,感染率为13.71%(24/175),鉴定出3 种隐孢子虫,以微小隐孢子虫为优势感染虫种(20/24),同时发现泛在隐孢子虫(2/24)和肖氏隐孢子虫(2/24)[16]。该研究通过显微镜观察, 发现腹泻羔羊隐孢子虫的阳性率为63.33%(38/60);通过PCR 法检测,发现腹泻羔羊隐孢子虫的阳性率为86.67%(52/60),均为微小隐孢子虫;调查结果与上述报道相一致,表明微小隐孢子虫是感染新生羔羊的主要隐孢子虫虫种,可引起羔羊腹泻。
研究发现, 感染绵羊的微小隐孢子虫亚型主要是Ⅱa 和Ⅱd 亚型,其基因亚型呈现多样遗传分布特征。在西班牙,Díaz 等[17]报道无腹泻症状绵羊羔羊感染的微小隐孢子虫亚型为ⅡaA15G2R1 和ⅡaA14G2R1;在希腊,Papanikolopoulou 等[18]调查发现, 腹泻绵羊羔羊感染的微小隐孢子虫亚型为ⅡaA15G2R1、 ⅡaA20G1R1、 ⅡdA15G1 和ⅡdA16G1;在以色列,Tako 等[15]报道腹泻绵羊羔羊感染的微小隐孢子虫亚型为ⅡaA15G1R1、ⅡaA15G2R1、 ⅡaA16G1R1、 ⅡaA16G2R1、 ⅡaA17G1R1、 ⅡaA17G2R1、 ⅡaA19G2R1、 ⅡaA21G1R1、ⅡdA20G1 和ⅡdA22G1;在罗马尼亚,Imre 等[16]报道腹泻绵羊羔羊感染的微小隐孢子虫亚型为ⅡaA16G1R1、ⅡaA17G1R1、ⅡdA20G1、ⅡdA24G1 和ⅡdA22G2R1;在波兰,Kaupke 等[19]报道绵羊感染的微小隐孢子虫亚型为ⅡaA17G1R1;在巴西,Paz 等[20]报道绵羊感染的微小隐孢子虫亚型为ⅡaA15G2R1。在我国,Mi 等[4]报道北京市、上海市、山东省、吉林省等地绵羊感染的微小隐孢子虫亚型有ⅡaA15G2R1、ⅡaA17G2R1、ⅡdA15G1、ⅡdA18G1、ⅡdA19G1;Qi 等[8]报道新疆维吾尔自治区绵羊感染的微小隐孢子虫亚型为ⅡdA15G1。本次调查发现, 某规模化场腹泻羔羊源微小隐孢子虫均为ⅡdA19G1,提示绵羊源微小隐孢子虫具有区域适应性。
4 结论
该结果表明,新疆维吾尔自治区某规模化绵羊养殖场腹泻羔羊隐孢子虫感染率较高,感染虫种为微小隐孢子虫, 鉴定出的基因亚型为ⅡdA19G1。调查结果为绵羊隐孢子虫种属鉴定与遗传进化研究提供了基础数据。
