木犀草素-聚乙二醇 400/PVP k30固体分散体的制备及体内外评价
2023-11-14吕鑫科曾爱国
吕鑫科,曾爱国
1.武汉大学中南医院药学部,武汉 430071;2.西安交通大学医学部药学院,西安 710061
木犀草素化学名为3’,4’,5,7四羟基黄酮(3’,4’,5,7-tetralydroxyflanone),是典型的黄酮类化合物,广泛存在于荆芥、野菊花、金银花、白毛夏枯草、洋蓟等中药材中[1-3]。现代药理学研究表明,木犀草素具有抗氧化[4]、抗炎[5-6]、抗肿瘤[7]、抑菌[8]、抗过敏[9]以及增加冠状动脉血流量和降低冠状动脉血管阻力[10]等作用。但木犀草素的水溶性差,不易吸收,生物利用度低,限制了其在临床上的应用[11]。
提高难溶性药物的溶解度一般用减小药物粒径、成盐、固体分散体、包合物、前药修饰、改变晶型等方法[12-13]。目前,固体分散体是提高难溶性药物溶解度和溶出度、改善体内吸收和生物利用度的常用方法[14-15]。邓向涛等[16]和吴春等[17]以乙醇为溶剂,分别用溶剂法、溶剂-熔融法制备木犀草素-PVP k30固体分散体,增大木犀草素的溶解度,提高体内生物利用度。以乙醇为溶剂制备固体分散体,在除去乙醇时,易造成环境污染,且制备的固体分散体易析晶。本研究拟以聚乙二醇(PEG) 400为溶剂,在85 ℃溶解木犀草素,加入PVP k30在150 ℃充分搅拌,制备木犀草素-PEG 400/PVP k30固体分散体。用该方法制备固体分散体时,不需要除去PEG 400,可简化制备过程且不会污染环境。PEG 400作为载体成分,还可起到增塑作用,降低PVP k30玻璃转变温度,提高固体分散体的稳定性。
1 仪器与材料
1.1 仪器
AY 120型电子天平、傅里叶红外分析仪、LC-20A型色谱系统均购自日本Shimadzu公司;Mapada UV-1200型紫外分光光度计(上海美普达仪器有限公司);DSC 822e型差示扫描量热仪(Mettler Toledo有限公司);D8 Advance型X线衍射仪(Bruker有限公司);ZRS-8G型智能溶出试验仪(上海双旭电子有限公司);98-1-C型数字电热套(天津市泰斯特仪器有限公司)。
1.2 试药
木犀草素(质量分数>98%,西安冠宇生物技术有限公司);木犀草素对照品、芹菜素对照品质量分数均>99.9%,均购自中国食品药品检定研究院;PEG 400、PVP k30均购自天津市光复科技发展有限公司;甲醇、乙腈均为色谱纯,均购自天津市科密欧化学试剂开发中心;肝素钠(天津生物化学制药有限公司);羧甲基纤维素钠(国药集团化学试剂有限公司);三蒸水为自制;其他试剂均为分析纯,均购自西安化学试剂厂。
1.3 动物
SD雄性大鼠,体质量为(280±20) g,购自西安交通大学医学实验动物中心,许可证号为SCKX(陕)0073276。
2 方法
2.1 木犀草素-PEG 400/PVP k30固体分散体的制备
取适量木犀草素,加入PEG 400中,85 ℃搅拌至溶解;按一定比例加入PVP k30,150 ℃搅拌10 min,室温冷却;粉碎,过80目筛,得粒径为50~100 μm的木犀草素-PEG 400/PVP k30固体分散体,置于干燥器中避光保存,备用。
取PEG 400,按一定比例加入PVP k30,150 ℃搅拌10 min,室温冷却,粉碎,过80目筛;加入木犀草素,混合均匀,即得物理混合物,置于干燥器中避光保存。
2.2 差示扫描量热法曲线的绘制
精密称取2.0 mg木犀草素以及相当于2.0 mg木犀草素的木犀草素-PEG 400/PVP k30固体分散体和物理混合物测定差示扫描量热法(differential scanning calorimetry,DSC)曲线。差示扫描量热仪用铟和锌进行温度和焓值校正,以空铝坩埚作为参比物,在氮气流下从25 ℃升温至350 ℃,升温速率为10 ℃·min-1。
2.3 粉末X线衍射分析
称取适量的木犀草素、木犀草素-PEG 400/PVP k30固体分散体和物理混合物在室温下测定各样品的粉末X线衍射图谱。粉末X线衍射条件:铜靶,管压为40 kV,管电流为30 mA,步长为0.02°,扫描速度为每分钟2.0°,持续时间为0.06 s,扫描范围为10°~40°。
2.4 溶出实验
以蒸馏水为溶出介质,用桨法(2020年版《中华人民共和国药典》四部通则0931第二法)测定木犀草素的溶出度。分别精密称取5.0 mg木犀草素以及相当于5.0 mg木犀草素的木犀草素-PEG 400/PVP k30固体分散体和物理混合物,加入200 mL水中,温度为(37.5±0.5) ℃,转速为100 r·min-1。分别于5、10、15、30、60、120、180、240 min取样5 mL,立即用0.2 μm微孔滤膜过滤,同时补充5 mL同温度的蒸馏水。用紫外-可见分光光度计在254 nm处测定溶出样品的吸光度值,计算溶出样品中木犀草素的含量,并绘制溶出曲线。
2.5 体内药动学
2.5.1试药的配制 木犀草素混悬液:精密称取0.25 g木犀草素,置于50 mL量瓶中,加入适量5 g·L-1CMC-Na水溶液,用蒸馏水定容至刻度,即得5 mg·mL-1的木犀草素混悬液。
木犀草素-PEG 400/PVP k30固体分散体混悬液:精密称取木犀草素-PEG 400/PVP k30固体分散体(10%载药量)2.5 g,置于50 mL量瓶中,加入适量5 g·L-1CMC-Na水溶液,用蒸馏水稀释至刻度,即得5 mg·mL-1的木犀草素-PEG 400/PVP k30固体分散体溶液。
2.5.2血浆样品的采集 取SD雄性大鼠10只,随机分为2组,每组5只,实验前12 h禁食但不禁水。分别以木犀草素混悬液和木犀草素-PEG 400/PVP k30固体分散体混悬液单次灌胃给药,给药量为40 mg·kg-1。根据预实验结果,分别于给药前和给药后5、15、30、60、120、240、360、480、720 min颈静脉取血0.30 mL,置于肝素离心管中,以3 000 r·min-1离心5 min,取上层血浆冷冻备用。
2.5.3血浆样品的预处理 取血浆100 μL,加入2 μg·mL-1内标(芹菜素)甲醇溶液20 μL,再加入100 μL 3 mol·L-1的稀盐酸溶液,于80 ℃水浴锅中加热1.5 h,冷却后加入1 mL乙酸乙酯,涡旋振荡1 min,以3 000 r·min-1离心10 min,取1 mL上清液,氮气吹干,100 μL流动相复溶,以12 000 r·min-1离心10 min,取上清液进样分析。
2.5.4色谱条件 色谱柱为Tianhe C18(150 mm×4.6 mm,5 μm);流动相为乙腈-甲醇-体积分数0.05%磷酸(30∶5∶65);流速为1.0 mL·min-1;检测波长为254 nm;进样量为20 μL;柱温为30 ℃。
3 结果
木犀草素、物理混合物及木犀草素-PEG 400/PVP k30固体分散体的PXRD图见图1。由图1可见,木犀草素在2θ为12.68°、14.04°、15.81°、21.37°、25.40°、26.16°、27.38°、28.40°处具有较强的特征衍射峰,而在木犀草素-PEG 400/PVP k30固体分散体PXRD图中木犀草素的特征衍射峰消失,物理混合物在2θ为12.68°、14.04°、15.81°、21.37°、26.16°处有较强的木犀草素特征衍射峰,表明木犀草素以无定形状态或分子形式分散于载体材料中。

图1 木犀草素、物理混合物及木犀草素-PEG 400/PVP k30固体分散体的PXRD图
木犀草素、物理混合物及木犀草素-PEG 400/PVP k30固体分散体的DSC曲线见图2。由图2可见,木犀草素的熔融峰在350 ℃;在木犀草素-PEG 400/PVP k30固体分散体DSC曲线中,木犀草素熔融峰消失,只在载体和木犀草素之间出现一个熔融峰,表明木犀草素与载体在固体分散体中形成共熔体,并以无定形状态或分子形式分散于载体材料中。物理混合物在190 ℃左右出现吸热峰,而木犀草素熔融峰消失,这可能是因为载体PEG 400和PVP k30熔融后,木犀草素溶解在二者的熔融液中;在固体分散体的制备过程中,木犀草素在85 ℃时能溶解在PEG 400中也证实了这一点。

图2 物理混合物、木犀草素及木犀草素-PEG 400/PVP k30固体分散体的DSC曲线
在水溶性介质中,木犀草素在4 h内达平衡时的溶解度仅为0.60 μg·mL-1,溶出率仅为2.41%。相比之下,木犀草素-PEG 400/PVP k30固体分散体中的木犀草素在30 min达到平衡时,溶解度为25.06 μg·mL-1,约为木犀草素的40倍,溶出率高达100%。物理混合物的溶解度仅为4.03 μg·mL-1左右,溶出率仅为16%。物理混合物的溶解度和溶出率高于木犀草素,可能是由于水溶性载体PEG 400和PVP k30改善了木犀草素的润湿性。以上结果表明,固体分散体可显著改善木犀草素的溶出速度和溶解度,使其具有更快的释放速度和更大的溶出率。结果见图3。
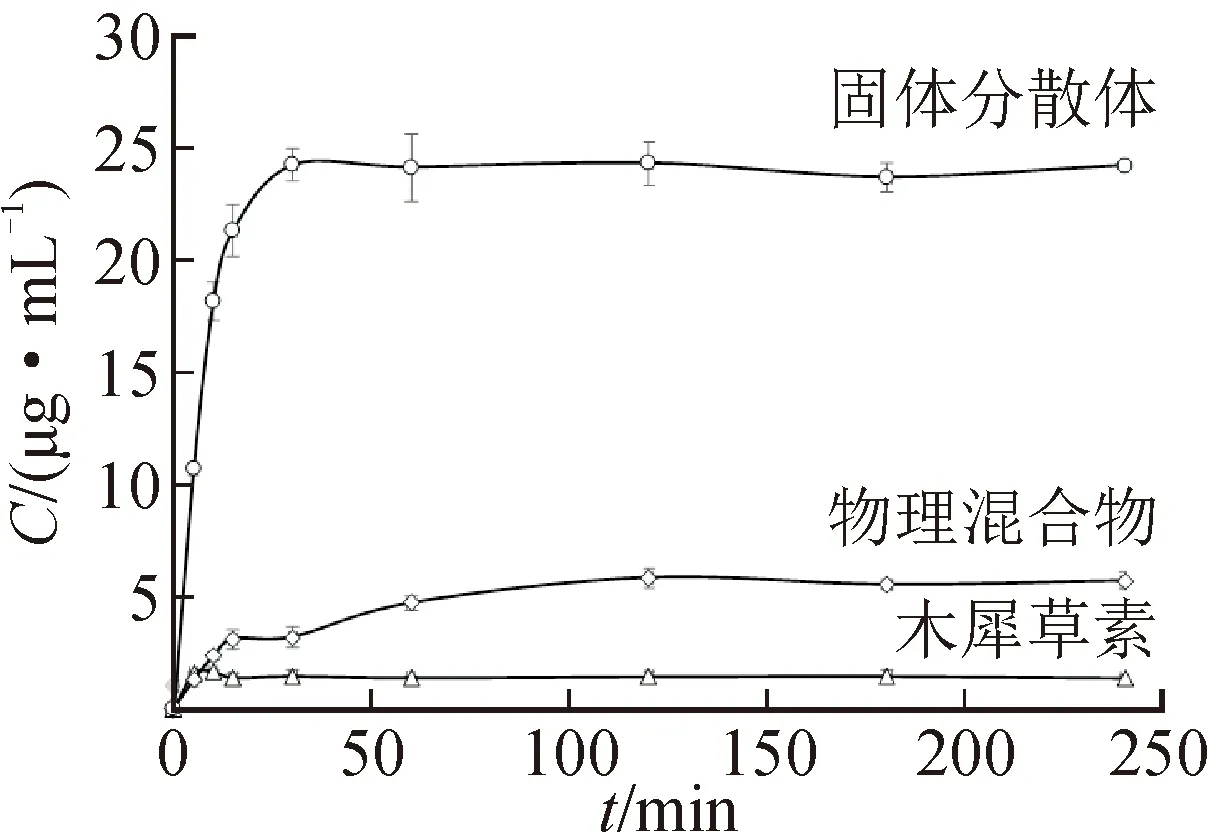
图3 木犀草素、物理混合物和木犀草素-PEG 400/PVP k30固体分散体的溶出曲线(n=5)
用HPLC法测定木犀草素在大鼠血浆样品中的质量浓度。结果表明,芹菜素的保留时间为16.05 min,木犀草素的保留时间为9.67 min,血浆样品中芹菜素和木犀草素的主峰保留时间与对照溶液中的保留时间一致;在该色谱条件下,血浆中的内源性杂质不影响木犀草素和芹菜素的测定,且具有较好的分离度,见图4。木犀草素在0.01~5.00 μg·mL-1范围内线性关系良好,线性回归方程为y=0.907 2x+0.010 6(r=0.999 5)。检测限为0.20 ng(信噪比为S/N=3),定量限为1.00 ng(信噪比为S/N=10)。低、中、高3个质量浓度(0.05、1.00、5.00 μg·mL-1)的回收率分别为114.20%、96.42%、105.31%,RSD值分别为9.42%、5.41%、6.25%。低、中、高3个质量浓度的溶液室温放置24 h、冻融循环以及-20 ℃放置30 d内药物在血浆中的稳定性良好,回收率在94.81%~108.25%范围内,RSD值小于5.57%。

注:1.木犀草素;2.芹菜素。
木犀草素和木犀草素-PEG 400/PVP k30固体分散体的药时曲线见图5。由图5可见,木犀草素-PEG 400/PVP k30固体分散体的达峰浓度(Cmax)药时曲线下面积(AUC)均显著大于木犀草素原料药。用DAS 2.0药动学软件包自动拟合数据,主要药动学参数见表1。由表1可见,木犀草素-PEG 400/PVP k30固体分散体的达峰时间(tmax)为28.12 min,Cmax为3.01 μg·min-1,是木犀草素原料药Cmax的5倍,表明木犀草素-PEG 400/PVP k30固体分散体在体内能快速释放和溶出,且体内吸收较快。木犀草素-PEG 400/PVP k30固体分散体的AUC0→12 h为(1.74±0.44) min·mg·mL-1,显著高于木犀草素原料药,相对生物利用度为915.82%。体外溶出度结果显示,固体分散体能明显提高木犀草素的溶解度和溶出速率,而体内药动学结果表明,固体分散体能促进木犀草素在体内的吸收,生物利用度显著提高,表明木犀草素的溶解和溶出是其在体内吸收的限速步骤,固体分散体是改善木犀草素溶解性和体内生物利用度的有效方法。
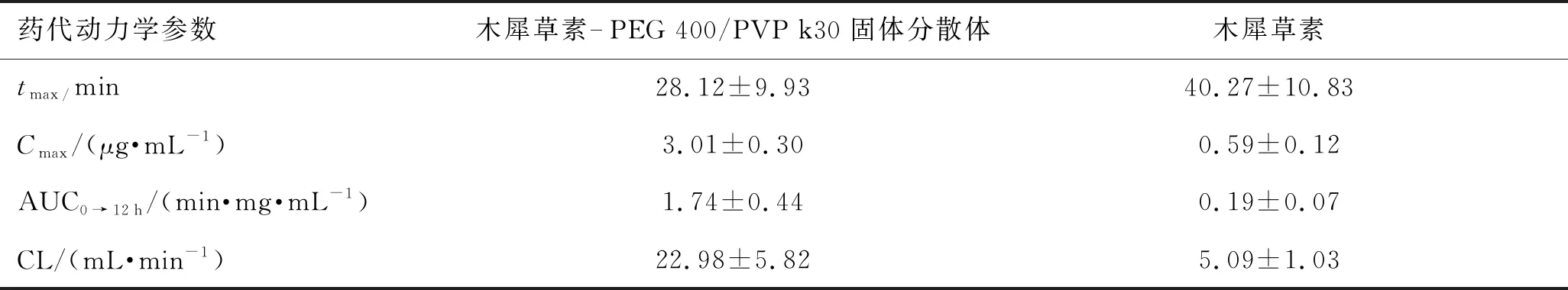
表1 木犀草素和木犀草素-PEG 400/PVP k30固体分散体在大鼠体内药代动力学参数(n=5)
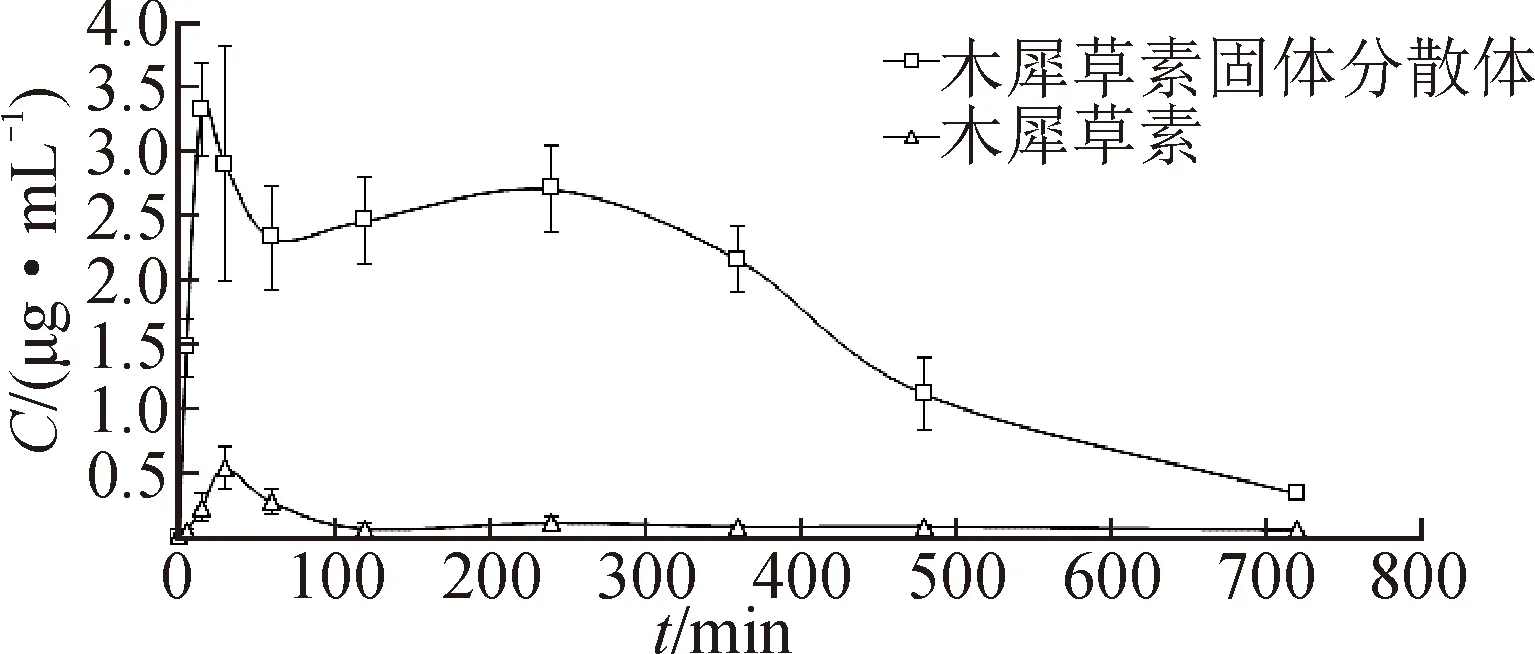
图5 木犀草素和木犀草素-PEG 400/PVP k30固体分散体的药时曲线(n=5)
4 讨论
固体分散体的制备工艺有熔融法、溶剂法、溶剂-熔融法、研磨法和热熔挤出法等。邓向涛等[16]和吴春等[17]用溶剂法、溶剂-熔融法制备木犀草素-PVP k30固体分散体,提高木犀草素的溶出度和生物利用度。但是,以乙醇为溶剂制备固体分散体,易导致药物重结晶,使分散度下降,且乙醇挥发会污染环境。木犀草素为黄酮类化合物,具有较多的羟基,在PEG 400中有较好的溶解度,因此本文以PEG 400作为溶剂,采用溶剂-熔融法制备木犀草素-PEG 400/PVP k30固体分散体,使用该方法完全可以避免环境污染和析晶问题。此外,PEG 400不用除去,而作为固体分散体载体成分,可以起到增塑作用,降低PVP k30玻璃转变温度,不仅可以降低制备过程中的熔融温度,还可提高固体分散体的稳定性。体外溶出实验和体内药动学结果显示,木犀草素-PEG 400/PVP k30固体分散体在体内能快速释放和溶出,且体内吸收速度较快,能极大地改善木犀草素的体内生物利用度,表明以PEG 400作为溶剂,用溶剂-熔融法制备固体分散体是改善木犀草素溶解度和生物利用度的有效方法。
