无花果病毒CP 基因克隆及遗传多样性分析
2023-11-14李亚娟王瑞鑫玉山江麦麦提
陈 伟 ,薛 婷 ,李亚娟 ,王瑞鑫 ,玉山江·麦麦提
(1.山西师范大学 生命科学学院,山西 太原 030004;2.铜仁市农业科教信息站,贵州 铜仁 554300;3.西安国际陆港园林景观有限公司,陕西 西安 710000;4.新疆农业科学院 植物保护研究所/农业部西北荒漠绿洲作物有害生物综合治理重点实验室,新疆 乌鲁木齐 830091)
无花果(Ficus caricaLinn.),别名品仙果,是桑科榕属植物,喜光不耐寒,对土壤、水分、温度要求严格。无花果主要分布在阿拉伯、叙利亚、土耳其等地中海沿岸国家,唐代从波斯传入中国[1]。我国无花果主要生产地区是山西、山东、陕西、新疆等。无花果作为重要的经济果木,所含营养丰富,应用范围广,经济价值高。在药用方面,无花果可用作轻泄剂用于治疗便秘,同时干果提取物经处理后具有抗艾氏肉瘤的作用[2-3]。在经济价值方面,无花果果实可以加工制作成果干、果脯、饮料、罐头等系列产品[4-5]。据联合国粮食和农业组织统计,2020 年中国无花果种植面积约为3 031 hm2,产量为18 121 t。随着无花果的大面积种植,特别是无性繁殖苗木的广泛推广应用,无花果的病毒病害日趋严重,严重影响无花果的产量和品质。
无花果病毒最早是在美国的加利福尼亚被发现[6],随后在土耳其、日本、塞尔维亚、伊朗等地被报道。研究显示,侵染无花果的病毒有5 种,分别是无花果斑点相关病毒(Fig fleck-associated virus,FFkaV)、无花果杆状病毒1(Fig badnavirus 1,FBV-1)、无花果杆状病毒2(Fig badnavirus 2,FBV-2)、无花果叶斑相关病毒4(Fig leaf mottle-associated virus 4,FLMaV-4)和无花果花叶病毒(Fig mosaic virus,FMV)[7-8]。其中,无花果花叶病毒(Fig mosaic virus,FMV)是一种负链RNA 病毒,被认为是无花果花叶病的致病因子[9]。
FMV 通过营养繁殖和嫁接有效传播,也可以通过Aceria ficus在植物间传播[10],目前暂没有种子传播的证据。感染FMV 的植株叶片表现出花叶、褶皱、褪绿斑驳、环斑、明脉、叶脉明化等症[11-14]。FMV 的首次发现是在美国加利福尼亚州无花果植株的花叶上。随后大量科研人员对无花果植株中的FMV 检测,发现FMV 的侵染率高达96%[15],说明FMV 是无花果植株的一种重要病害。之后,ELBEAINO 等[16]首次发现FMV 有4 条负义单链RNA(-ssRNA),分别为RNA1~4。其中每条RNA均编码一个开放阅读框(ORF),其中最大为7 093 nt,其他大小分别为2 252、1 490、1 472 nt。然而在日本无花果收集的FMV 分离物JS1 中检测到RNA5,长度为1 752 nt,包含一个ORF,编码502 个氨基酸的蛋白质,分子质量大小为59 ku。JS1 的RNA6 长度为1 216 nt,ORF 编码预测的232 个氨基酸,26 ku 蛋白质[18]。无花果花叶病几乎遍布于所有无花果种植区,是无花果生产中的一大威胁。因此,明确我国FMV 的遗传多样性、种群结构、分子变异等信息,对设计有效的病毒防控策略至关重要。
本研究从山西省临汾市采集被FMV 感染的无花果叶片,经RT-PCR 获得CP 基因,并进行序列分析,通过分析FMV 分离株的遗传变异和种群结构,旨在为无花果花叶病毒的分类、分子特征、进化机制以及致病机理的研究奠定基础。
1 材料和方法
1.1 样品采集与保存
在山西省临汾市尧都区县底镇翟村无花果种植园内(111.62°E,36.02°N),2019 年采集57 份无花果鲜嫩叶片,2020 年采集62 份,叶片置于冰盒中,24 h 内运回实验室,一部分用于实验,另一部分保存于-80 ℃冰箱。
1.2 总RNA 提取和RT-PCR 扩增
使用RNA 试剂盒提取样品无花果叶片总RNA,PrimeScript RT 试剂盒合成cDNA,接着用Primier 5.0 软件设计引物FMV-F(5′-CATCTCTC TAAGTCTAAGGAGAA-3′)和FMV-R(5′-AAC ATGAGCACTTGCAATCCTAT-3′),PCR 扩增FMV 的外壳蛋白基因[19]。
PCR 产物经1.5%琼脂糖凝胶电泳检测并回收。将回收的目的条带连接至pGEM-Teasy 载体中,筛选阳性菌落后送去测序。将阳性菌落送至公司测序。每条阳性条带至少经过3 次测序,3 次结果相同,则测序完成。
1.3 系统进化分析
将测序得到的12 个CP 基因,在NCBI 数据库(https://www.ncbi.nlm.nih.gov/)中进行BLAST比对,根据其核苷酸一致性筛选并获得37 条相似序列,使用MEGA 7.0 软件对这49 条序列构建进化树,进行遗传多样性分析[20]。首先,从Models 中寻找最佳构建模型T92+G+I,接着采用General Time Reversible 模型和Construct/Test Maximum Likelihood Tree(ML)方法构建系统发育树,自展值1 000,去掉低于50%的进化数分支。
1.4 核酸相似性分析和氨基酸相似性分析
利用SDTv1.2 软件分析49 个分离物CP 基因间的核苷酸相似性和氨基酸相似性分析。
基于49 个分离物CP 基因,使用Dna SP 5.10.01[21]软件计算分离位数(S)、突变总数(T)、单倍型多样性(Hd)、核苷酸序列差异的平均数(K)、核苷酸多样性(π)、非同义突变(Ka)和同义突变数(Ks),以及非同义突变与同义突变的比率(Ka/Ks)。在试验中,若Ka/Ks 值在所有分离株中均大于1,表明它们处于正向选择;反之,如果Ka/Ks<1,则表明它们处于负向选择或者稀薄状态[22]。
1.5 种群差异分析
基于49 个分离物CP 基因,利用Dna SP 5.10.01软件,分析种群内部或种群间的基因流动和遗传分化。试验中,Ks*、Kst*、Z*、Snn[23]的P值小于0.05,则认为存在遗传差异性。Fst[24]值用于衡量49 个分离物间的遗传分化程度,Fst 的绝对值小于0.33,表明基因流动频繁。
1.6 群体进化分析
运用Dna SP 5.10.01 软件进行Tajima’s D、Fu & Li’s D 和Fu & Li’s F 的统计检验,评估了分离位点的分子多样性模式[25]。其中,Tajima’s D 检验比较了核苷酸多样性与多态位点的比例,在选择中性下预期相等。Fu & Li’s D 是是基于单例数(突变在序列中只出现一次)与突变总数之间的差异;Fu & Li’s F 检验是基于单例数之间的差异和序列对之间的核苷酸差异的平均数量。
2 结果与分析
2.1 FMV 的发生情况
2019—2020 年,在山西省临汾市尧都区的无花果基地随机采集119 份无花果叶片。2019 年采集57 份样品,经RT-PCR 检测22 个叶片带有FMV,其阳性检出率为38.6%。2020 年采集62 份样品,其中31 个样品带有FMV,阳性检出率为50%。测序分析后获得12 个新的FMV 分离物,分别命名为FMV1~FMV12(登录号:SUB11540627)。
2.2 FMV 的系统进化分析
本试验使用MEGA 7.0 软件,基于CP 基因,对49 个分离物(37 个来自NCBI,12 个分离所得)进行系统进化分析(图1)。系统发育树结果显示,49 个分离物被分为6 组。其中,Group1 包括18 个分离物,分布于中国、土耳其、美国、加拿大和日本5 个国家;Group2 包括7 个分离物,分别来自于中国、美国、以色列;Group3 有2 个分离物,均分布在土耳其;Group4 包括14 个分离物,日本2 个、塞尔维亚5 个、俄罗斯3个、伊朗2 个、意大利1 个,另外1 个地理位置不确定;Group5 有3 个分离物,均来自于伊朗;Group6 有5 个分离物,分布在伊朗和俄罗斯。中国的12 个分离物被分到Group1、Group2,日本的分离物被分到Group1、Group4,美国、俄罗斯等国的分离物也被分到了不同的组,这表明FMV种群存在较高的遗传多样性,且地理位置可能不是影响FMV 分离物遗传多样性的主要原因。
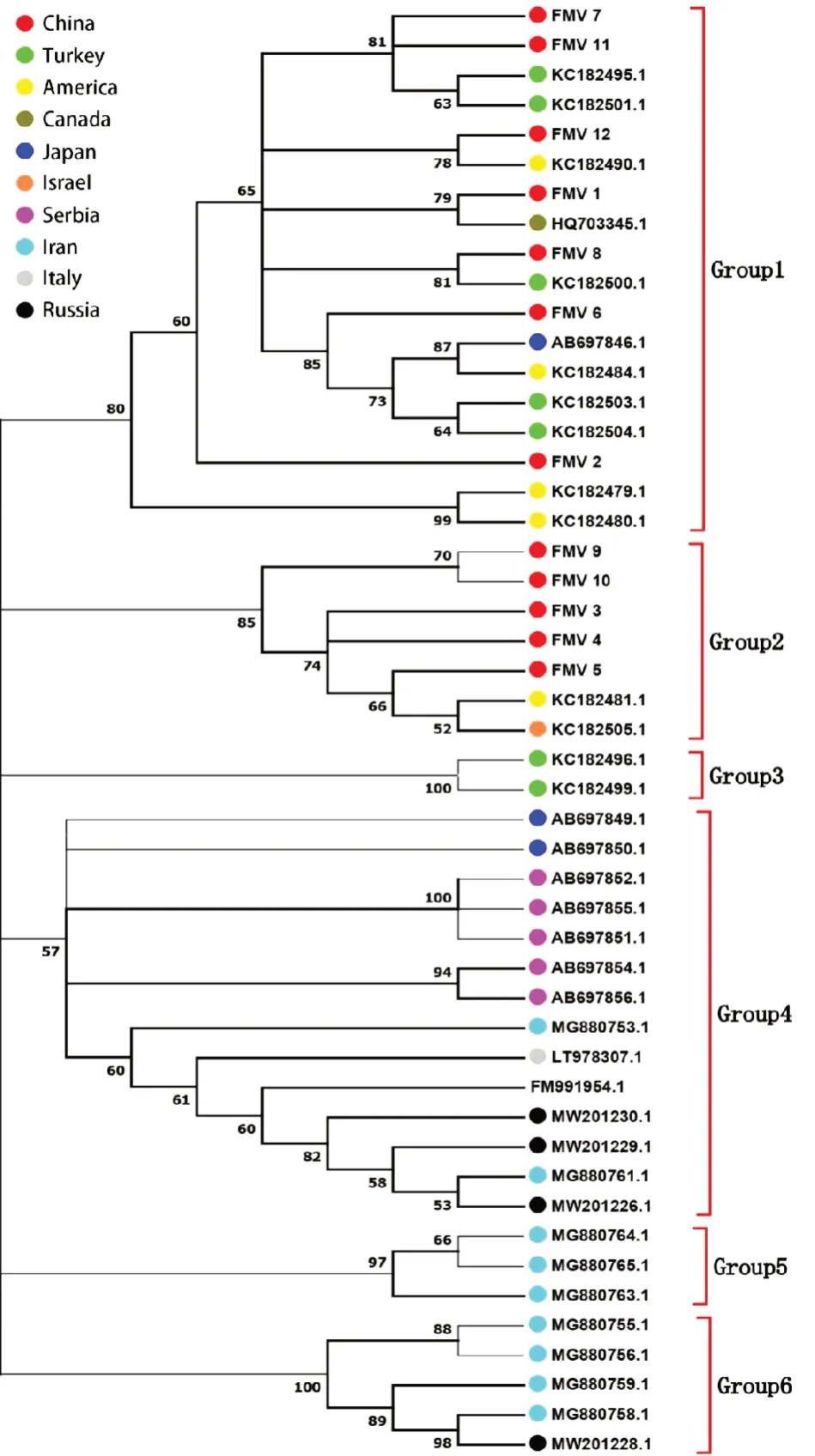
图1 基于CP 基因的49 个FMV 分离物系统进化树Fig.1 Phylogenetic tree of 49 FMV isolates based on CP gene
2.3 FMV 核苷酸和氨基酸序列相似性分析
49 个FMV 分离物基因序列一致性分析显示,49 个CP 基因核苷酸一致率为91.41%~100%。AB697851.1 和 AB697852.1、 AB697851.1 和AB697855.1、AB697852.1 和AB697855.1 核苷酸同源性最高,为100%,MG880759.1 和MG880753.1核苷酸同源性最低,为91.41%。本研究分离物FMV8 与KC182500.1 核苷酸同源性最高,为99.85%,FMV5 与MG880759.1核苷酸同源性最低,为92.44%。49个CP基因氨基酸一致率为89.33%~100%。MG880753.1 和MG880759.1 的氨基酸相似性最低,为89.33%,本研究分离物FMV1 与MG880759.1 氨基酸相似性最低,为93.33%。上述结果表明,FMV 的CP 基因存在一定多样性,但是在进化中高度保守,突变率较低(图2)。
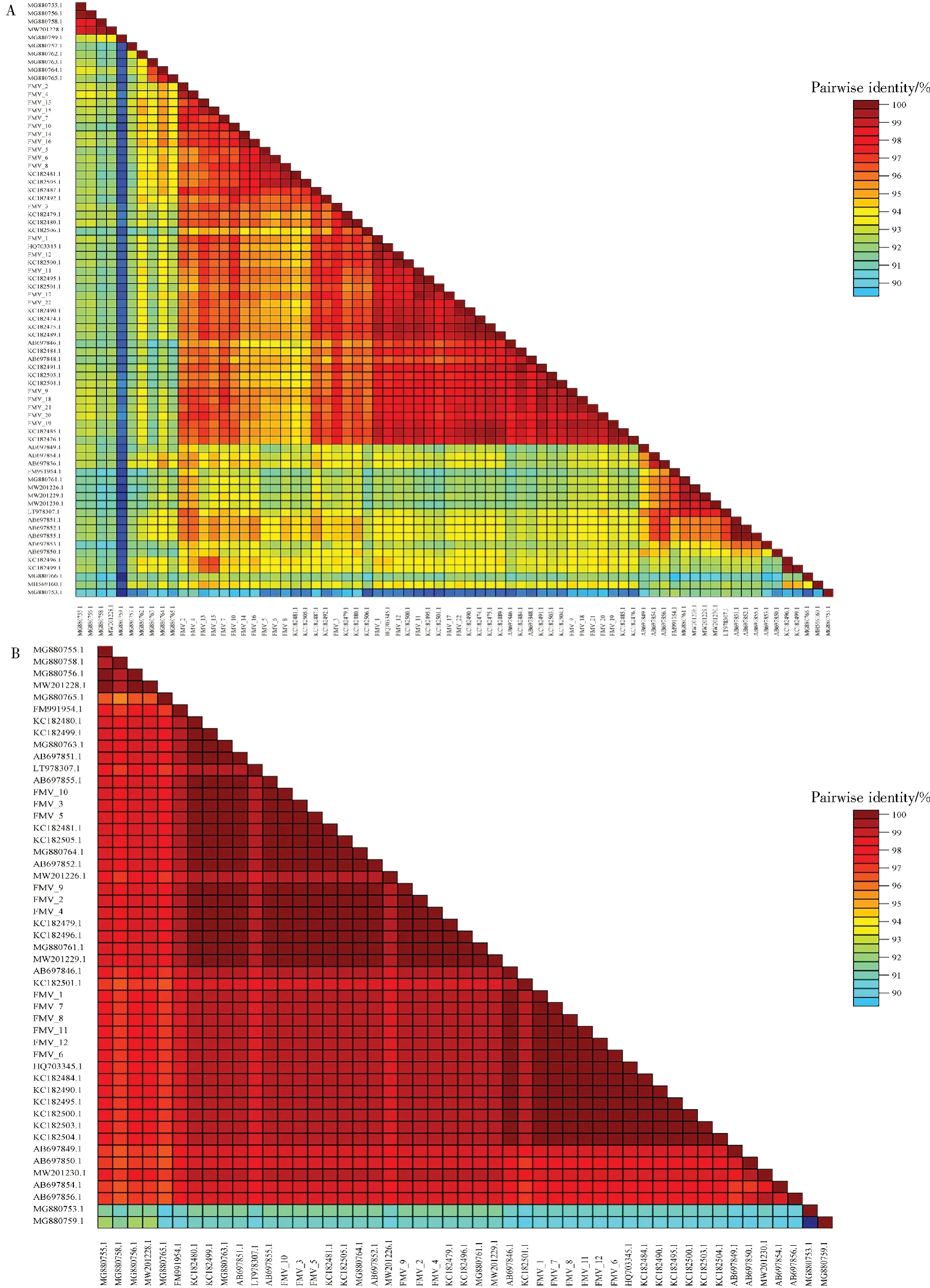
图2 CP 序列同一性二维分布Fig.2 Identity plot of nucleotide sequence(A)and amino acid sequence(B)
2.4 FMV 群体遗传学分析
49 个分离物CP 基因序列分析表明,Group4 的分离位点数(S=65)和突变总数(T=66)最高,然而单倍体多样性(Hd=0.967)低于其他5 组。Group4 的平均CP 核苷酸差异数(K=16.055)和核苷酸多样性(π=0.023 79)最高,Group3 的平均CP核苷酸差异数(K=1.000)和核苷酸多样性(π=0.001 48)最低。另外,在49 个分离物中,为了估计对编码区的选择性约束程度,分别计算了非同义突变/同义突变的比率,Ka/Ks 值在0~0.25,且Ka/Ks 值均小于1。随着基因组在不同区域的变化,表明49 个分离物CP 基因的氨基酸的位置呈负向选择(表1)。
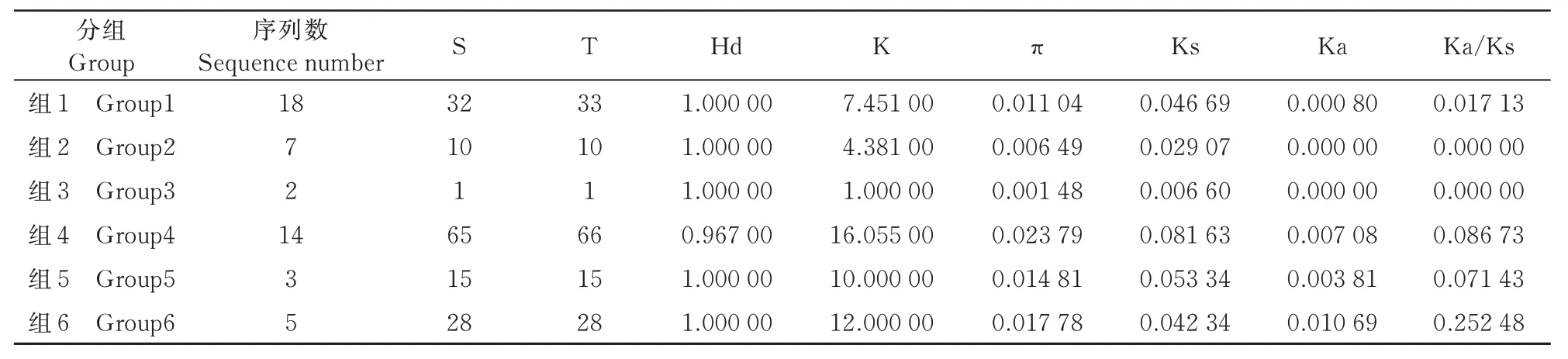
表1 6 组分离物遗传多样性Tab.1 Genetic diversity of isolates in six groups
2.5 FMV 种群差异分析
使用Ks*、Z*、Kst*和Snn统计确定了49个FMV分离物组内和组间的基因流动和遗传分化(表2)。结果显示,49 个分离物Snn 值均小于0.05,确定分离物之间存在遗传差异性。组内的Fst 值均小于0,说明组内分化程度较低。组间的Fst 值均大于0,表明组间分化程度较高。组内Fst 值明显小于组间,说明组间分化程度高于组内,种群分化主要来源于组间。而组间所有的Fst 值均大于0.33,表明群体之间的基因流动频率非常低。
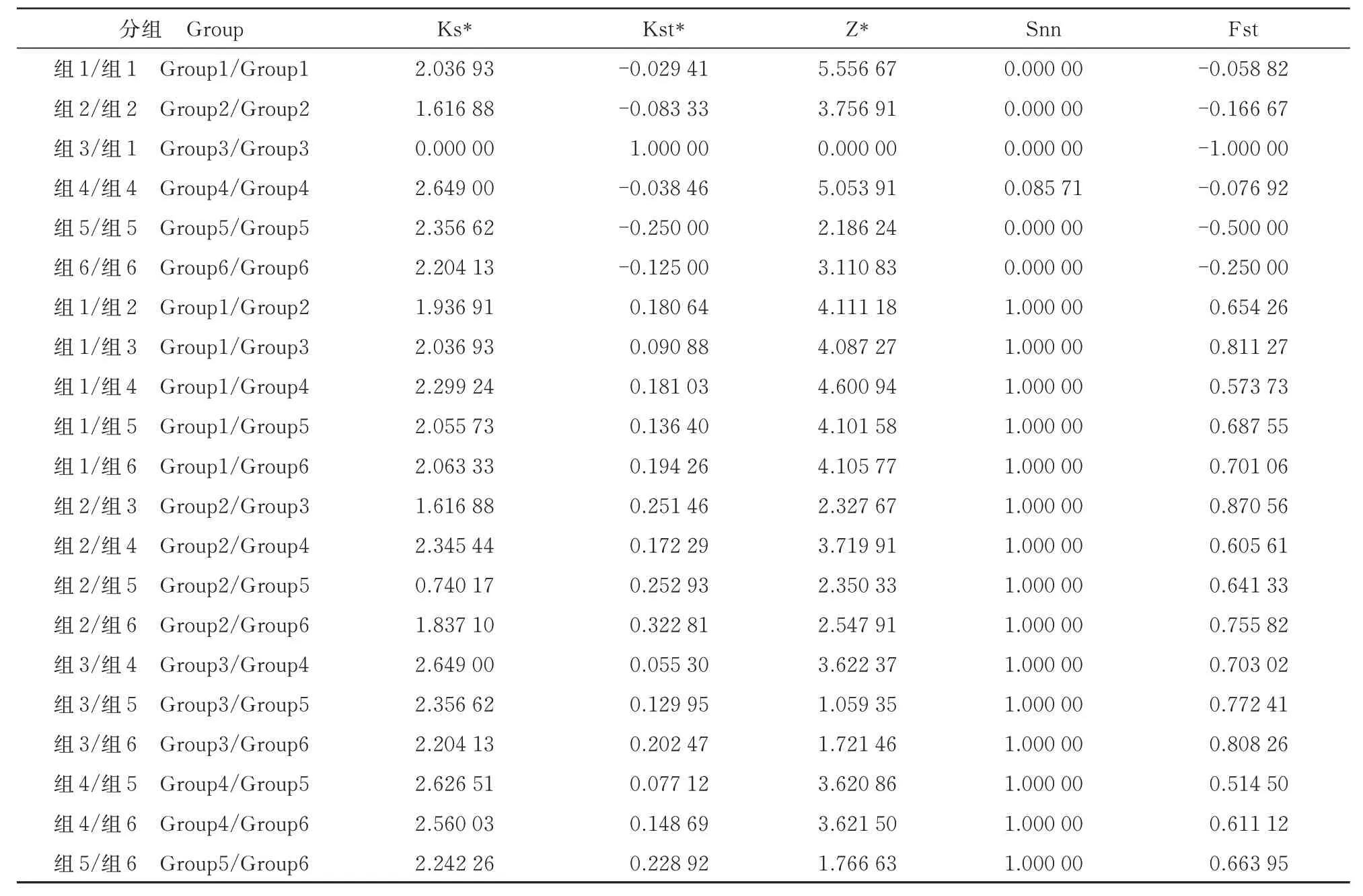
表2 FMV 群体遗传差异性分析Tab.2 Genetic differences analysis of FMV populations
2.6 FMV 的群体进化分析
本研究采用Tajima′s D、Fu & Li′s D、Fu &Li′s F 这3 种方法统计检验评估了FMV 分离位点的分子多样性模式(表3)。结果显示,除Group2 为正值外,其他大多数各组的Tajima′s D、Fu & Li′s D、Fu & Li′s F 的统计检验值均为负值,说明FMV种群极大可能处于扩张状态。
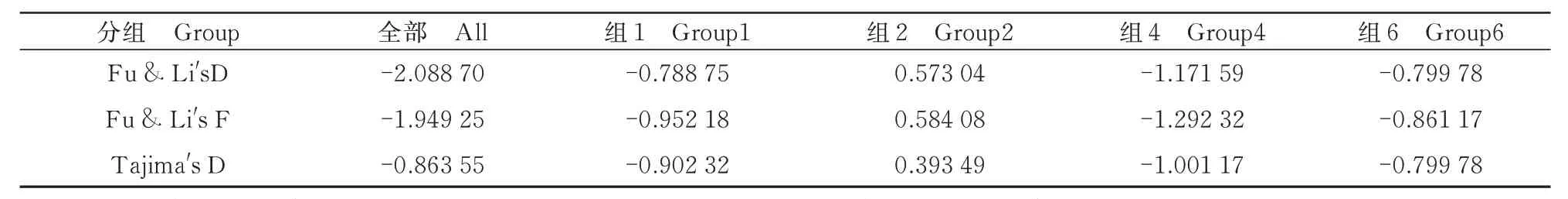
表3 FMV 分离物的群体进化分析Tab.3 Population evolutionary analysis of FMV isolates
3 结论与讨论
本研究采集了119 个样品,经RT-PCR 检测,筛选获得了12 个分离物,经生物信息学分析,明确了FMV 存在较高的遗传多样性,且负向选择可能是FMV 分子变异的重要原因,为FMV 生物防治奠定了理论基础。
FMV 分离物遗传多样性与地理位置没有密切联系。地理上遥远的分离物之间的密切遗传关系可能是由于繁殖无花果材料的国际运输造成的长距离迁徙[26]。中国山西的分离物分布在Group1 和Group2,可能至少有1 个分离株被独立引入[27]。通过系数Fst 评估遗传分化程度和基因流,本试验49 个FMV 分离物组间分化程度高且差异显著。植物病毒主要利用特定载体进行植物间传播[28]。无花果繁殖方式是营养繁殖,大多是扦插。这为病毒有效转移和维持后代提供了机会。
从遗传学角度分析,FMV 病毒是典型的RNA病毒,CP 基因全长675 bp。RNA 病毒复制容易出错而导致的高突变率,FMV 缺乏校对活性[29]。RNA 编码区施加的不同选择压力也是导致遗传变异差异的重要原因。因此,在面对足够的选择压时,FMV 能够进行快速的进化,这将提高控制FMV 的难度。为了提高无花果的产量和质量,必须更加重视FMV 的配对。合理的预防和控制策略是预防和控制这种病毒的必要和重要手段。
种群水平上的3 种中性测试中,Tajima′s D、Fu & Li′s D、Fu & Li′s F 检验均为负值,负向选择似乎在种群扩张中发挥了重要作用。在无花果园中有可能产生越来越多的遗传分化分离株。负选择也可能导致高毒力菌株的产生。CP 基因遗传多样性分析使得更加了解FMV 的感染和发生以及为FMV 的防治提供理论依据。
