NF-κB 和Nrf2 信号通路在成肌细胞抗氧化应激中的作用
2023-11-14王鹤洁李俊玲窦敏敏翟竹汇李振月
李 君 ,王鹤洁 ,安 洁 ,李俊玲 ,窦敏敏 ,翟竹汇 ,何 浪 ,李振月 ,秦 健 ,,3,杜 荣
(1.山西农业大学 动物医学学院,山西 太谷 030801;2.山西农业大学 生命科学学院,山西 太谷 030801;3.山西农业大学 实验教学中心,山西 太谷 030801)
氧化应激最初由SOHAL 教授提出,指的是在机体受到各种内外环境的有害刺激时,体内会产生过多的高活性分子如活性氧自由基(Reactive oxygen species,ROS)和活性氮自由基(Reactive nitrogen species,RNS),而细胞内的抗氧化系统不能及时清理,会导致氧化与抗氧化系统的失衡,使细胞膜和线粒体以及遗传物质受到原发或继发性的损伤,严重情况下可能导致细胞发生癌变或者死亡[1-2]。研究发现,核因子κB(NF-κB)和核因子E2 相关因子2(Nrf2)是被过量ROS 激活的2 个主要转录因子,活化后的转录因子进入细胞核,引起下游各种靶基因的表达以抵抗不良影响[3]。在NF-κB 信号通路的多个靶点中,SOD2和FHC在抗氧化活性方面有着重要的作用,其中NF-κB 可通过FHC的上调来抑制ROS,进而抑制肿瘤坏死因子诱导的细胞凋亡[4];而CHANG 等[5]研究发现,壳寡糖能够激活Nrf2 途径,促进Nrf2 介导的HO-1和GSH-Px基因表达,从而减少ROS 水平,提高肉鸡的肉质。
骨骼肌约占动物身体的40%,其具有维持运动、代谢和支持身体的重要作用[6]。骨骼肌发育的过程较为复杂,胚胎和围产期是决定动物骨骼肌生长性能的关键时期[7]。现已明确地塞米松作为一种人工合成的糖皮质激素,因其在围产期有抗炎、镇痛、抗毒、抗过敏等多种优势被广泛使用。但由于糖皮质激素受体几乎存在于所有的细胞中,高剂量或长期使用会产生一定的副作用[8]。研究表明,地塞米松能够在体内和体外的骨骼肌细胞、成骨细胞以及脂肪细胞等多种类型的细胞中引起氧化应激损伤[9-10]。氧化应激会使蛋白质代谢加快而抑制蛋白质的合成,最终引起肌肉发育不良或肌肉萎缩[11]。目前,利用分离培养的成肌细胞诱导分化已被广泛应用于研究肌肉生成机制的体外模型[12-13]。
为探明在成肌分化过程中,NF-κB 和Nrf2 信号通路在地塞米松诱导的氧化应激中是否发挥作用,本试验以绵羊成肌细胞为研究对象,在其分化过程中,选用地塞米松来诱导氧化应激,比较正常和应激状态下不同分化阶段NF-κB 和Nrf2 信号通路相关基因的表达变化,并分析各基因的相互关系,旨在为阐明骨骼肌细胞分化过程中的抗氧化机制奠定基础,同时为防治胎儿骨骼肌发育过程中受到的氧化损伤提供理论依据。
1 材料和方法
1.1 试验材料
绵羊胎儿成肌细胞由本实验分离培养所得。主要试剂包括青霉素-链霉素(PS)、I 型胶原酶、0.25%胰酶(TE)、马血清(HS)、地塞米松,均购于索莱宝;DMEM/F12、NBCS 购于GIBCO 公司;RNAiso Plus 购于TaKaRa 公司;活性氧检测试剂盒购于碧云天公司。
1.2 试验方法
1.2.1 绵羊胎儿成肌细胞的分离与培养 样品来自于太谷屠宰场屠宰时意外发现的早期怀孕母羊。将胎儿从子宫中取出,用加了双抗的生理盐水冲洗表面,无菌手术刀切成大小为1 mm3的组织碎片,以1 500 r/min 的转速离心5 min。然后,用0.2%的I 型胶原酶消化1 h,中间每10 min 混匀一次,消化结束后,再次离心。接着用0.25%胰酶消化20 min,加等量培养基(89% DMEM/F12、10% NBCS、1% PS)终止消化,用0.074 mm 细胞筛进行过滤,离心,悬浮培养在100 mm 细胞培养皿中,随后通过差速贴壁的方法纯化成肌细胞。
1.2.2 绵羊胎儿成肌细胞的分化与处理 绵羊胎儿成肌细胞长到80%左右时,对照组用含有2%HS和1% PS的DMEM/F12正常诱导分化48、72 h。根据山西农业大学分子细胞调控课题组前期经验,在低浓度时,地塞米松对成肌分化有促进作用,中高浓度时对成肌分化有抑制作用。因此,本试验中试验组的处理方式为:在正常分化的细胞中添加中浓度(0.375 mg/mL)的地塞米松,分别处理细胞48、72 h。
1.2.3 ROS 检测 采用活性氧检测试剂盒检测各组成肌细胞中的ROS 水平。每孔加入4%多聚甲醛溶液固定2 min,PBS 洗涤3 次。然后加入ROS检测工作液,置培养箱20 min,洗涤细胞3 次,荧光显微镜观察并分析ROS 水平。1.2.4 RNA-seq 分析 分别将不加地塞米松分化48、72 h 和加地塞米松分化48、72 h 的细胞样品收集放置于RNAiso Plus 裂解液中,送至百迈客公司进行转录组测序分析。根据测序结果,分析NF-κB和Nrf2 信号通路相关基因的mRNA 相对表达情况。
1.3 生物信息学及统计学分析
采用皮尔森相关系数法分析相关性,采用SPSS 22.0 单因素(ANOVA)方差分析差异显著性;同时利用STRING 数据库分析并建立蛋白互作网络。每个处理3 个重复。
2 结果与分析
2.1 绵羊胎儿成肌细胞分离、分化及地塞米松处理后的形态和ROS 变化
分离培养的绵羊成肌细胞在2~3 d 内开始从组织块爬出,并在第3 天时开始大量增殖,如图1 所示,细胞形态正常,呈长梭形或者梭形,可用作后续试验。诱导分化后,单核成肌细胞开始变长并逐渐融合为多核肌管。
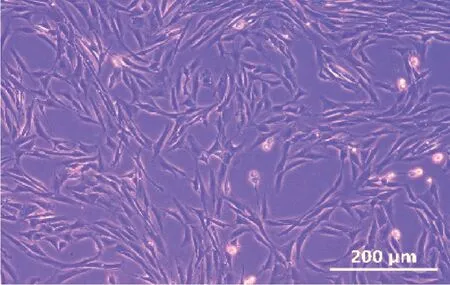
图1 绵羊胎儿成肌细胞在培养基中的生长状态Fig.1 Growth status of sheep fetal myoblasts in the culture medium
地塞米松处理前后的变化如图2 所示,随着分化时间延长肌管数量增加,地塞米松处理抑制了成肌细胞的分化,导致形成的肌管变短变细、数量减少。相应地,与N 48 h 组相比,Dex 48 h 组中ROS含量增加了130.96%,差异极显著(P<0.01);与N 72 h 组相比,Dex 72 h 组中ROS 含量增加了151.57%,差异极显著(P<0.01)。
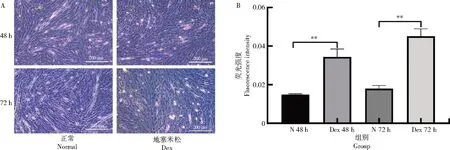
图2 绵羊胎儿成肌细胞在加或不加Dex 的分化培养基中分化的状态(A)和ROS 水平(B)Fig.2 Differentiation status(A),ROS levels(B)of sheep fetal myoblasts in differentiation medium with or without Dex
2.2 NF-κB 和Nrf2 通路相关基因的mRNA 表达结果
由测序结果分析可知(图3),NF-κB 信号通路中,与N 48 h 组相比,Dex 48 h 组中P65、IKK2、IκBα、IκBβ、SOD2和FHC的mRNA 相对表达量分别上升了53.68%、36.38%、219.36%、55.64%、415.32% 和388.12%,差异极显著(P<0.01);与N 72 h组相比,Dex 72 h组中P65、IKK2、IκBα、SOD2和FHC的mRNA 相对表达量分别上升了45.39%、66.85%、226.32%、436.08%和339.08%,差异极显著(P<0.01),IκBβ的mRNA 相对表达量上升了47.58%,差异达显著水平(P<0.05)。

图3 NF-κB 和Nrf2 信号通路相关基因的相对表达量Fig.3 Relative expression level of genes related to NF-κB 和Nrf2 signaling pathways
Nrf2 信号通路中,与N 48 h 组相比,Dex 48 h组中Keap1、Nrf2和HO-1的mRNA 相对表达量分别上升了83.98%、81.46%和242.02%,差异极显著(P<0.01),GSH-Px的mRNA 相对表达量上升了54.45%,差异显著(P<0.05)。与N 72 h 组相比,Dex 72 h 组中Keap1、SOD1和HO-1的mRNA 相对表达量分别上升了74.78%、37.20%和270.51%,差异达极显著水平(P<0.01)。
2.3 NF-κB 和Nrf2 通路相关基因mRNA 表达的相关性
由表1 可知,分化48 h 后,NF-κB 信号通路中,P65与IKK2、IκBα、IκBβ和FHC呈极显著正相关(P<0.01);IKK2与IκBα呈极显著正相关(P<0.01),与IκBβ、SOD2和FHC呈显著正相关(P<0.05);IκBα与IκBβ和FHC呈极显著正相关(P<0.01);IκBβ与FHC呈显著正相关(P<0.05)。Nrf2信号通路中,Nrf2与SOD2呈极显著正相关(P<0.01);HO-1与Keap1呈极显著正相关(P<0.01)。NF-κB 信号通路和Nrf2 信号通路相关性分析结果显示,Keap1与P65、IKK2、IκBα、IκBβ和FHC呈极显著正相关(P<0.01);HO-1与P65、IKK2、IκBα和FHC呈极显著正相关(P<0.01),与IκBβ呈显著正相关(P<0.05);GSH-Px与IκBβ和FHC呈显著正相关(P<0.05)。

表1 分化48 h 后各组相关基因mRNA 表达的相关性Tab.1 Correlation of mRNA expression of the related genes in each group after 48 h of differentiation
由表2 可知,分化72 h 后,NF-κB 信号通路中,P50与IκBβ呈显著正相关(P<0.05);P65与IKK2、IκBα、IκBβ和FHC呈极显著正相关(P<0.01);IKK2与IκBα和FHC呈极显著正相关(P<0.01),与IκBβ呈显著正相关(P<0.05);IκBα与IκBβ和FHC呈极显著正相关(P<0.01),与SOD2呈显著正相关(P<0.05);IκBβ与FHC呈极显著正相关(P<0.01);SOD2与FHC呈显著正相关(P<0.05)。Nrf2 信号通路中,Keap1与HO-1和GSH-Px呈极显著正相关(P<0.01),与SOD1呈显著正相关(P<0.05);SOD1与HO-1呈极显著正相关(P<0.01),与SOD2呈显著正相关(P<0.05);SOD2与HO-1呈显著正相关(P<0.05);HO-1与GSH-Px呈极显著正相关(P<0.01)。Nrf2 信号通路和NF-κB 信号通路相关性分析结果显示,Keap1与P65、IKK2、IκBα、IκBβ和FHC呈极显著正相关(P<0.01);SOD1与P50呈极显著正相关(P<0.01),与IKK2、IκBα、IκBβ和FHC呈显著正相关(P<0.05);HO-1与P65、IKK2、IκBα、IκBβ和FHC呈极显著正相关(P<0.01),与P50呈显著正相关(P<0.05);GSH-Px与P65、IKK2和IκBα呈极显著正相关(P<0.01),与IκBβ和FHC呈显著正相关(P<0.05)。
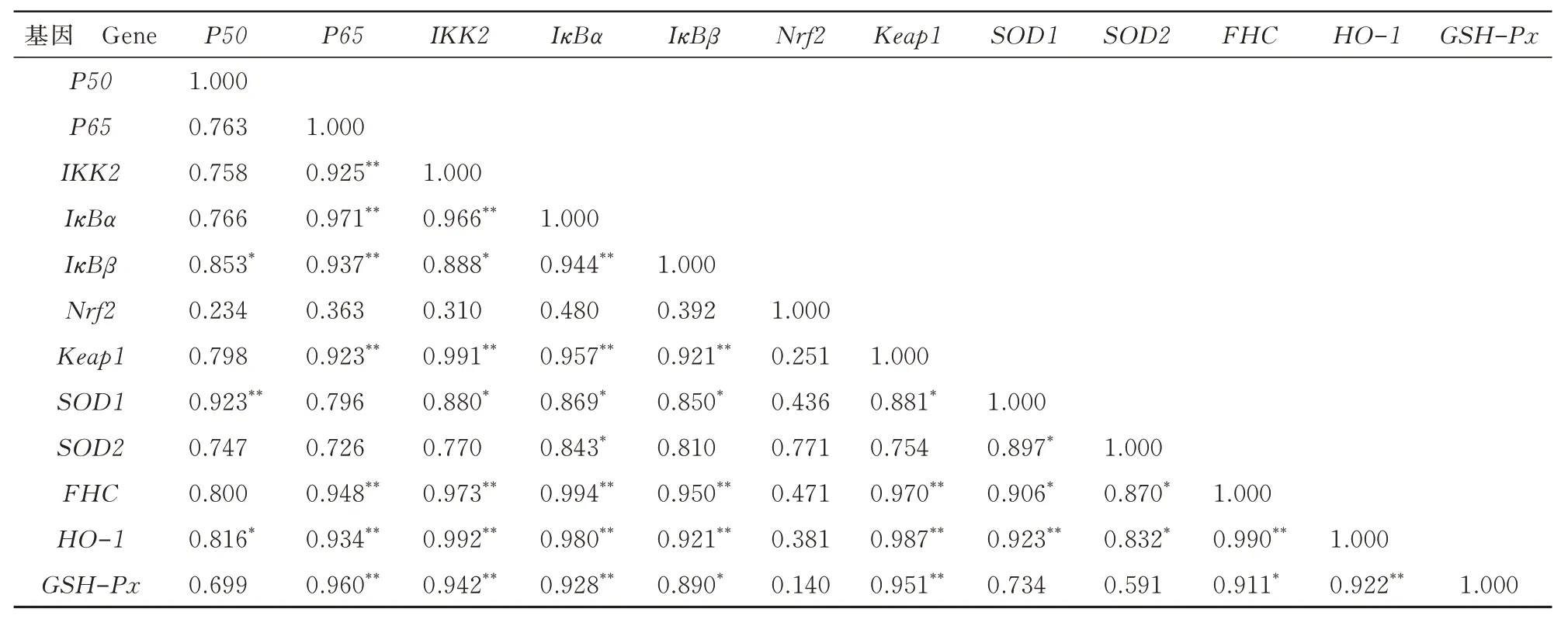
表2 分化72 h 后各组相关基因mRNA 表达的相关性Tab.2 Correlation of mRNA expression of the related genes in each group after 72 h of differentiation
2.4 NF-κB 和Nrf2 通路相关基因的蛋白互作分析结果
为了进一步了解NF-κB 和Nrf2 这2 条通路中氧化应激相关基因之间的关系,利用STRING 数据库分析并建立了蛋白互作网络,结果显示(图4),NF-κB 和Nrf2 这2 条通路的多数基因之间存在互作关系,而且2 条通路之间具有交叉对话作用,其中,Keap1是联系NF-κB 和Nrf2 这2 条通路的关键枢纽,Nrf2(NFE2L2)和IκBα(NFκBIA)之间的互作关系也是2 条通路沟通的方式之一,而SOD2是2 条通路共同调控的下游基因。

图4 NF-κB 与Nrf2 通路相关基因的蛋白互作网络Fig.4 Protein-protein interaction(PPI)network of genes related to NF-κB and Nrf2 pathways
3 结论与讨论
细胞的功能会受到细胞内在损伤和外界刺激的影响,包括氧化应激、DNA 损伤、蛋白质损伤和新陈代谢改变等[13]。在骨骼肌发育、再生以及体外研究成肌分化的过程中,不可避免地会受到氧化应激影响,适当的ROS 能够参与肌卫星细胞的激活以及成肌细胞的增殖分化,但过量增加的ROS 会导致细胞功能障碍,影响骨骼肌细胞的发育和再生[14]。研究表明,地塞米松可以引起小鼠成肌细胞氧化应激[15]。本研究中,通过形态学观察与ROS检测结果发现,与正常对照组相比,地塞米松处理导致分化48 h 和72 h 的绵羊成肌细胞内ROS 含量显著上升,成肌细胞出现受损,分化和融合成肌管的数目减少,肌管的直径变小,表明成肌分化过程中的氧化应激模型成功构建。其原因可能是由于地塞米松引起的氧化应激会抑制成肌细胞内蛋白质的合成,促进肌管内蛋白质的降解[16],从而影响成肌细胞的分化及融合过程。
NF-κB 蛋白家族作为一种多效性的转录因子,在调节细胞凋亡、炎症反应、应激反应、免疫应答中发挥着重要的生物学功能[17-18]。该家族中P65 和P50 构成的异二聚体属于典型的诱导型[19],正常情况下,其与抑制蛋白IκB 形成三聚体存在于细胞质中。当受到刺激后,会激活IκB 激酶的亚型IKK2,使IκB 发生降解,P65 和P50 得以进入核内启动SOD2和FHC等下游基因的表达[20]。作为一种超氧化物清除的关键酶,SOD2 的主要作用是清除氧化磷酸化产物超氧阴离子自由基[21]。FHC编码的铁蛋白可以将细胞内的铁储存起来以限制芬顿反应的发生,使细胞中的ROS 含量减少[22]。本试验中,Dex 48 h 组和Dex 72 h 组分别与对照相比发现,NF-κB 通路中IKK2、P65、IκBα、IκBβ、SOD2、FHC的mRNA 表达水平均呈极显著升高,表明ROS 激活了NF-κB 通路,继而促进了下游靶基因SOD2和FHC的表达,其中部分原因是由IKK2、P65基因表达量的升高所致。同时,抑制因子IκBmRNA 的表达也出现了显著上升,其原因可能是IκB也属于NF-κB 的下游靶基因,该转录因子的活化或表达增加会直接调控IκB 的表达,使其表达上调从而反馈性抑制NF-κB 的过度活化[23-24]。通过对各基因之间mRNA 表达的相关性分析结果可知,分化48、72 h 时NF-κB 通路相关基因随地塞米松处理表现出的表达相关性存在一致性也存在差异性。2 个阶段中P65与IKK2、IκBα、IκBβ和FHC均存在显著相关性,而IKK2、IκBα、IκBβ和FHC相互之间多数存在显著相关,但2 个阶段有所差异,此外,2 个阶段中与SOD2呈现显著相关的基因有所不同。
Nrf2 通路是抗氧化应激的主要机制之一。YANG 等[25]研究发现,香叶素能够通过激活Nrf2/HO-1 通路来减轻氧化应激,从而预防脑缺血/再灌注损伤。李孟心等[26]证明了Nrf2/HO-1 信号通路在H2O2诱导的hiPSCs 氧化应激中发挥了明显的抗氧化作用。正常情况下,细胞内的Nrf2 与Keap1 结合,以非活性的形式存在。当发生氧化应激后Nrf2与Keap1 发生解离并转移至细胞核内,与Maf 蛋白形成异二聚体后,通过与250 多个基因启动子区域中存在的抗氧化反应元件(ARE)序列结合,来启动一系列抗氧化基因的转录,其中包括HO-1、SOD和GSH-Px等[27-28]。本试验研究表明,与对照相比,处理组HO-1、SOD1、SOD2和GSH-PxmRNA的表达量多数达到显著上升,至少部分是由于Nrf2表达上调介导的。HO-1、SOD、GSH-Px表达增加后,分别主要通过阻止血红素基团促氧化[29]、清除氧化磷酸化产物超氧阴离子自由基[21]、分解有毒的过氧化物[30-31]等作用而减缓ROS 对绵羊成肌细胞分化的不利影响。同时,抑制因子Keap1mRNA的表达也出现了显著上升,这与上述NF-κB 通路中抑制因子IκBmRNA 表达上升的机制可能是类似的,是机体的一种负反馈调节。通过对各基因之间mRNA 表达的相关性分析结果可知,分化48、72 h时Nrf2 通路相关基因随地塞米松处理表现出的表达相关性同样存在异同。其中,Keap1、SOD1、SOD2、HO-1、GSH-Px之间,多数基因在48 h 或(和)72 h 表现出相关性,而Nrf2的表达与SOD2存在相关性。当细胞受到氧化应激时,多种信号通路被激活参与抗氧化应激,这些通路之间也存在相互作用。
本试验进一步对NF-κB 和Nrf2 这2 条通路基因的表达相关性以及蛋白互作关系进行分析可知,尽管有些基因之间的表达相关性不显著,但这2 条通路各基因之间存在调控关系。因为基因的mRNA 转录往往同时受到多个相关转录因子的调控以及其他因素的影响。李慧[32]研究发现,NF-κB的抑制蛋白IκB 可以抑制NF-κB 通路并活化Nrf2通路,表明细胞内这2 条通路之间存在相互作用,这与本研究结果基本一致。
SOD2是2 条通路共同调控的下游基因。本试验中,SOD2基因可能同时受到转录因子Nrf2和P65的调控,而且受到其他相关基因的影响,因此它的表达水平是受到各因子调控或影响的综合结果。Nrf2 通路中的关键抑制因子Keap1 是一种上游蛋白,参与不同信号通路的协调,在Nrf2 与NFκB 信号通路之间发挥着重要的作用[33]。
综上可见,无论是分化48 h 还是72 h 时,Keap1与NF-κB 通路相关基因P65、IKK2、IκBα、IκBβ和FHC的相关性均为显著。结合蛋白互作关系进一步表明,Keap1基因是联系NF-κB 和Nrf2 这2 条通路的关键枢纽。说明在绵羊成肌细胞分化过程中,NF-κB 和Nrf2 信号通路被激活,其上游基因P65、IKK2、IκBα、IκBβ、Nrf2、Keap1以及相应下游靶基因SOD1、SOD2、FHC、HO-1、GSH-Px的mRNA相对表达量均显著升高,2 条通路以Keap1因子为重要枢纽而交互联系,共同在地塞米松诱导的氧化应激中发挥抗氧化作用,从而降低细胞的氧化应激损伤,减缓氧化应激对成肌分化造成的影响。
