百香果苯丙氨酸解氨酶基因PePAL 克隆及表达分析
2023-11-14杨翠凤刘正鲁
杨翠凤,滕 峥,韦 春,刘正鲁
(百色学院农业与食品工程学院/广西芒果生物学重点实验室/亚热带特色农业产业学院,广西 百色 533000)
苯丙氨酸解氨酶(PAL)是连接植物新陈代谢中初生代谢和次生代谢的桥梁,在植物木质素、类黄酮、香豆酸酯类等次生代谢物的形成过程以及植物的抗逆调控中发挥重要作用[1]。PAL 属于氨基裂解酶,由组氨酸裂解酶(HAL)家族突变进化而来,PAL与HAL 的催化活性位点含有1 个共同的辅因子4-甲基二烯-咪唑-5-酮(MIO),通过内部三肽区段Ala-Ser-Gly,经过自环化脱水形成[2]。植物的PAL基因CDS 长度通常2 100 bp 左右,包含1 个内含子和2 个外显子(裸子植物除外),编码约700 个氨基酸,分子质量大小在220~330 ku[3]。目前,研究人员已 成 功 从 木 薯(AF383152.1)、麻 疯 树(DQ883805.1)、蓖 麻(KF311063.1)及 甜 菜(AJ810175.1)等植物中克隆获得该基因cDNA 序列全长。研究发现,该基因在不同植物中的氨基酸组成和分子质量大小存在差异,如宋慕波等[4]克隆了荸荠的PAL基因,其cDNA 全长2 485 bp,开放阅读框(ORF)为2 142 bp,编码713个氨基酸;潘文等[5]克隆获得尾叶桉PAL基因全长4 507 bp,氨基酸编码序列为2 172 bp,内含子为1 759 bp。PAL基因在植物不同器官中的时空表达具有组织特异性,也受生长发育过程的调控。朱海生等[6]研究表明,丝瓜LcPAL基因编码的蛋白质包含了PAL-HAL、PLN02457、phe_aml_yase 保守结构域和1 段酶活性中心序列,为典型的Lyase_I_Like 超家族,该基因在丝瓜果实、花、茎、叶和根中均有表达。张文香等[7]研究表明,TcPAL基因在百蕊草叶和茎中表达量较高,根中表达量较少。乔枫等[8]在研究枸杞中PAL基因的表达特性时发现,枸杞PAL基因在叶片中表达量最高,其次是花,且随枸杞生长表达量增加。而对云锦杜鹃PAL 活性进行时空表达分析时发现,在花苞中的PAL活性最高[9]。SHANG 等[10]的研究也证明了PAL 活性在黄瓜雌花和雄花中高于果等部位。随着研究的深入,研究人员发现不同光因子调控[11-12]、机械损伤[13]、低温[14]、干旱[15]、毒素处理[16]、病原菌感染[17-18]等胁迫均可诱导植物体内PAL基因的表达。董春娟等[19]以黄瓜幼苗为研究对象,在低温条件下,叶片中PAL基因的表达量显著升高,其产物活性也有所提高。程春振等[20]利用少量紫外线对梁平柚果皮进行照射处理,可诱导PAL 活性的增强。戢强强等[21]通过对6 个青蒿PAL 基因家族成员进行顺式作用元件分析发现,青蒿苯PAL 基因成员的启动子区域含有较多参与光响应、逆境胁迫响应、激素响应和生长发育相关的作用元件。可见,PAL 在植物的抗逆及生长发育中具有重要的作用,其在组织的含量水平、酶活性及基因表达量可作为衡量植物抗逆能力的指标[22-23]。
花青素是植物各组织器官内糖基化的多酚类化合物,是普遍存在于植物叶、花和果中的水溶性天然色素,具有类黄酮物质所特有的“C6-C3-C6 三环”碳骨架结构,分子结构为3,5,7-甲基-2-苯基苯并吡喃,能使植物呈现不同颜色[24]。花青素的合成底物是2-氨基苯丙酸(Phenylalanine),又称苯丙氨酸,其在2-氨基苯丙酸解氨酶的催化作用下生成β-苯丙烯酸(肉桂酸),因此,PAL 是花青素合成的起始酶。花青素在植物抵御逆境时同样发挥着重要作用,既可抵抗病原菌侵染、虫害侵染等生物因素胁迫,也可以抵抗紫外线辐射、低温、旱灾等非生物因素胁迫[25-27]。
百香果(Passiflora edulisSims)属攀缘型木质藤本植物,果实多汁,富含多种水果香气,营养价值高,经济效益显著。当前各地种植的栽培种按果色可分为黄金果、紫果或为两者的杂交后代[28]。目前,关于百香果PAL基因的研究较少,未见在分子方面进行百香果PAL基因全长克隆及其在不同品种不同组织中表达特异性研究的报道。鉴于此,拟利用RACE 技术克隆获取PePAL基因cDNA 全长,分析PePAL基因序列特征,然后利用实时荧光定量PCR(Real-time PCR)测定其在不同品种不同组织中的表达量,为进一步研究PePAL基因参与百香果花青素生物合成途径以及百香果的分子育种提供理论依据。
1 材料和方法
1.1 植物材料
采集健康生长的台农1号百香果嫩叶用于基因全长克隆;采集健康生长的台农1 号百香果(紫果)和大黄金、小黄金百香果(黄果)3 级蔓同一结果枝上的茎、叶、花瓣、果皮组织用于后续基因荧光定量PCR 试验。样品采集后立即用液氮速冻,置于-80 ℃保存备用。
1.2 总RNA提取及cDNA合成
采 用 试 剂 盒 RNAprep Pure Plant Kit(TIANGEN,北京)抽提纯化百香果各组织样品总RNA,并用试剂盒PrimeScript TM RT Master Mix(TaKaRa,大连)进行反转录合成cDNA,用于后续基因克隆及基因表达分析。
1.3 PePAL基因的克隆
根据百色学院百香果病害研究团队前期获得的候选基因unigene 序列,设计引物,以反转录cDNA 为模板,开展候选基因片段的PCR 扩增和测序验证;按照SMARTer RACE 5′3′ Kit Protocol-At-A-Glance(TaKaRa,大连)操作指南进行5′-RACE和3′-RACE 巢式PCR 扩增,并将PCR 产物回收、连接、转化、测序、拼接;设计ORF 扩增引物,完成ORF的扩增和测序验证。利用Vector NTI 11.0设计引物如下:PePAL-Unigene-F:5′-ATGGACCAGGGCGGCAATGGT-3′,PePAL-Unigene-R:5′-TCAGCTGATGGGAAGAGGAGC-3′,PePAL-3OUTER-F:5′-CTGTGGTTGGTTTACGCTCCTATATTTCCGAAGGTGCAGTTAT-3′,PePAL-3OUTER-R:5′-CTAATACGACTCACTATAGGGCAAGCAGTGGTATCAACGCAGAGT-3′,PePAL-3INNER-F:5′-CACTTGGAAGAGAACCTGAAGCACGCGGTGAAGAACA-3′,PePAL-3INNERR:5′-CGGCGAGAACGAGAGCAACT-3′ ,PePAL-5OUTER-F:5′-GCATGGCGTCACATTGTGGTTCAGGAGCTTGGTTA-3′,PePAL-5OUTER-R:5′-CTAATACGACTCACTATAGGGCAAGCAGTGGTATCAACGCAGAGT-3′,PePAL-5INNER-F:5′-TCAATCATCCGCTTCACCTCTTCC-3′ ,PePAL-5INNER-R:5′-CTAATACGACTCACTATAGGGC-3′。将5′RACE 和3′RACE 测序结果用Vector NTI 11.0软件进行拼接获得百香果PePAL基因cDNA 全长。设计扩增完整编码框引物:PAL-ORF-F:5′-ATGGACCAGGGCGGCAATGGT-3′ 和 PAL-ORFR:5′-TCAGCTGATGGGAAGAGGAGC-3′。
1.4 生物信息学分析
利用BioXM 2.6 预测基因氨基酸序列;利用NCBI-protein blast 在线分析百香果PePAL与其他物种的同源性;利用ProtParam 预测PePAL 蛋白理化性质;利用ProtScale 在线分析PePAL 蛋白疏水性;利用SignalP 4.1 Server 预测信号肽;利用TMHMM Server 2.0 预测蛋白质跨膜结构域;利用PSORT WWW Server 进行PePAL 亚细胞定位分析;利用NetPhos 3.1 Server 分析PePAL 蛋白磷酸化位点;利用Motif Search 工具对推导的氨基酸序列预测膜内在蛋白(MIP)结构域;用SOPMA 软件预测PePAL 蛋白的二级结构;利用SWISS-MODEL 对PePAL 三级结构进行同源建模;用Mega 5.05软件构建PePAL编码氨基酸序列进化树。
1.5 实时荧光定量PCR分析
以台农1 号、大黄金和小黄金百香果3 级蔓同一结果枝上的茎、叶、花瓣和果皮的cDNA 为模板进行分析。根据百香果PePAL基因序列设计荧光定量PCR引物Y-PePAL-F:5′-GGCGAGAACGAGAGCAACT-3′,Y-PePAL-R:5′-CTAGCACTGTCTACCTCCTTGG-3′;以百香果Histone H3为内参基因,设计内参引物Y-His-F:5′-AGAGCCATGCAGTGTTGGCA-3′,Y-His-R:5′-CTTGGCGTGGATGGCACAGA-3′。PCR 反应混合液配制:2×Universal SYBR qPCR Master Mix 10 μL,F-primer(10 μmol/L)0.4 μL,Rprimer(10 μmol/L)0.4 μL,cDNA 1 μL,ddH2O 补足至20 μL。PCR 循环条件:95 ℃预变性3 min;94 ℃变性15 s,56 ℃退火15 s,72 ℃延伸20 s,共进行40个循环;72 ℃延伸10 min。加好样后放在德国AnalytikJena qTOWERE3 荧光定量PCR 仪中进行反应。利用2-ΔΔCt法计算PePAL基因的相对表达量。
2 结果与分析
2.1 PePAL全长cDNA克隆
经5′-RACE 及3′-RACE 巢式PCR 扩增、测序拼接及其ORF 测序验证(图1),获得百香果PePAL全长cDNA序列。经NCBI数据库BLAST比对,该基因与其他植物PAL基因有较高同源性。PePAL基因cDNA 全长2 499 bp,含有一个185 bp 的5′-端非翻译区(5′-UTR)、一个190 bp 的3′-端非翻译区(3′-UTR)和一个2 124 bp 的完整ORF。PePAL基因186—188 位为起始密码子ATG,下游存在同框终止密码子TGA和poly A尾。

图1 百香果PePAL 5′RACE、3′RACE和编码框的克隆产物Fig.1 The cloning products of 5′RACE,3′RACE and ORF of PePAL gene
2.2 PePAL基因编码序列分析
用BioXM 2.6 对PePAL基因进行分析,翻译得到其编码的蛋白质序列。PePAL完整ORF 长度为2 124 bp,编码707 个氨基酸,分子质量为173.43 ku。无带电荷氨基酸,无酸性和碱性氨基酸。非极性氨基酸1 145 个,占54.0%,亲水性氨基酸1 543个,占72.7%。含量最多的氨基酸是丙氨酸(Ala),达27.4%,含量最少的氨基酸是半胱氨酸(Cys),占比22.2%(表1)。PePAL蛋白等电点为4.92,原子总数为22 051,分子式简写为C6315H10508N2124-O2632S472,无负电残基(Asp+Glu)和正电残基(Arg+Lys)。脂肪族系数为27.35,不稳定指数为44.96,总平均亲水性为0.775。

表1 PePAL编码的总氨基酸成分分析Tab.1 Analysis of total amino acid components encoded by PePAL
2.3 PePAL蛋白亲疏水性分析及信号肽预测
利用在线软件Proscale(http://web.expasy.org/proscale)分析百香果PAL 蛋白的亲疏水性,如图2所示,正值代表疏水性,负值代表亲水性。在氨基酸第510 位时,其疏水性达到高峰,最大值为2.411;在氨基酸第114 位时,亲水性达到高峰,最大值为-2.733;按照亲水性越高则负值越大,反之相反的标准,可以预测出PePAL 蛋白为亲水性蛋白。利用在线软件SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP-4.1/)预测PePAL 蛋白的信号肽,结果如图3 所示,C-max 位点为24,C-score=0.145;Ymax 位点为24,Y-score=0.125;S-max 位点为4,Sscore=0.154;D=0.116,SP=‘NO’,说明百香果PAL蛋白没有信号肽,不是分泌性蛋白。
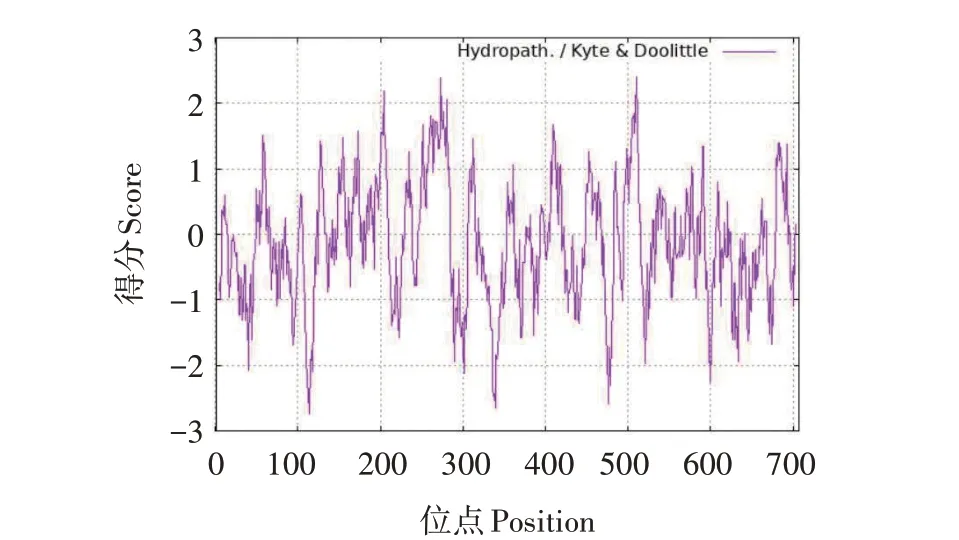
图2 PePAL蛋白亲疏水性分析Fig.2 Hydrophilicity analysis of PePAL protein
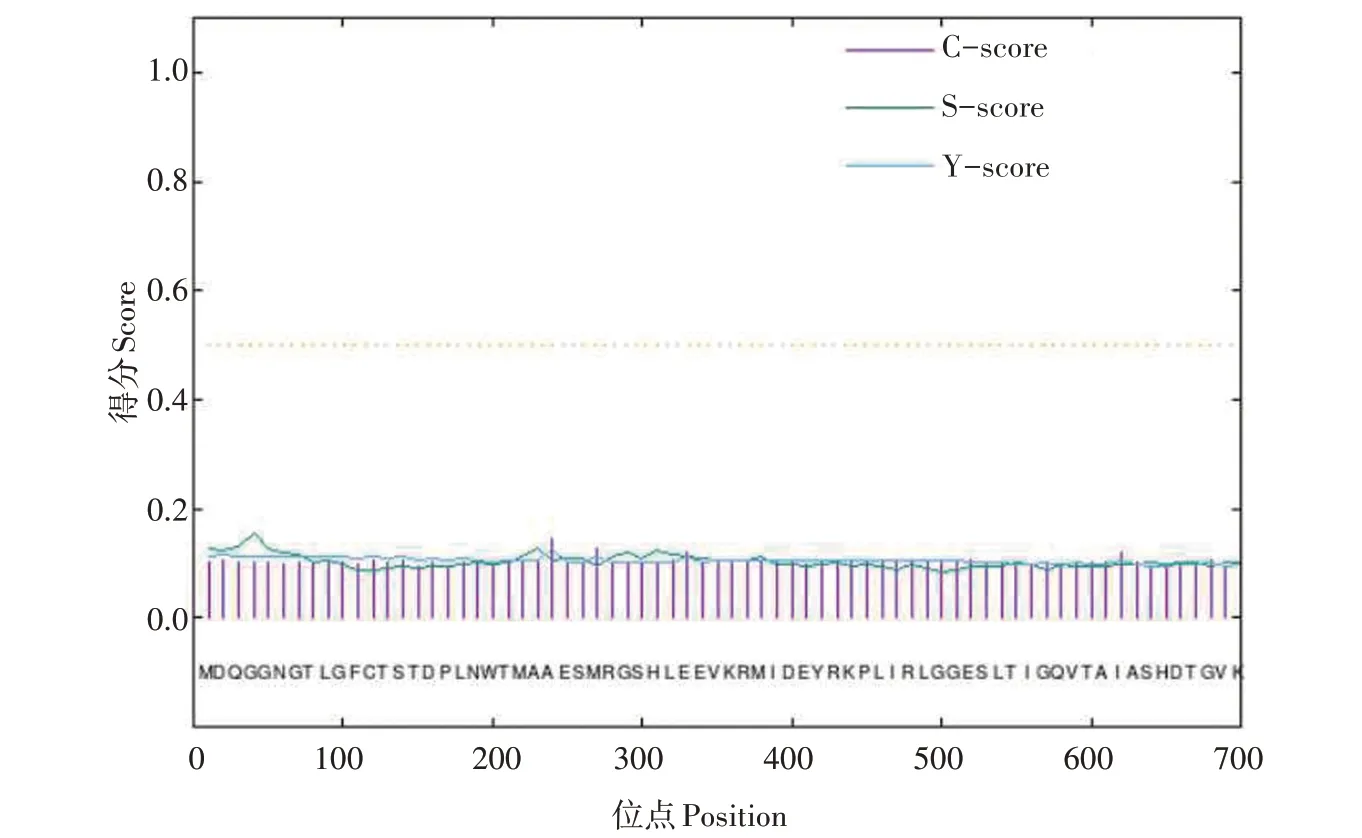
图3 PePAL蛋白信号肽预测Fig.3 Prediction of PePAL protein signal peptide
2.4 PePAL蛋白亚细胞定位及磷酸化位点预测
经PSORT WWW Server 预测分析,PePAL 蛋白亚细胞定位于细胞核的可能性最高,达35%,其次为叶绿体,可能性为30%,位于细胞质和细胞膜的可能性均为20%,而位于线粒体、液泡和内质网膜的可能性仅为10%。利用NetPhos 3.1 Server在线预测PePAL 蛋白磷酸化位点,已知阈值大于0.5,证明该位点磷酸化,如图4 所示,丝氨酸(S)磷酸化位点有30个,苏氨酸(T)磷酸化位点有21个,络氨酸(Y)磷酸化位点有7个。
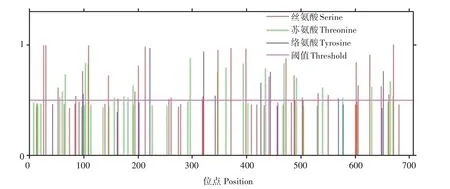
图4 PePAL蛋白磷酸化位点预测Fig.4 Prediction of phosphorylation site of PePAL protein
2.5 PePAL蛋白的Motif分析
利用Motif Search 工具(http://www.genome.jp/tools/motif/)对推导的PePAL 氨基酸序列进行生物学意义的位点分析,在54—530 位点预测到了一个Lyase_aromatic 结构域,在189—205 位点含有标志性的GTITASGDLVPLSYIAG 酶活性中心序列,ASG是典型的保守区域(图5)。
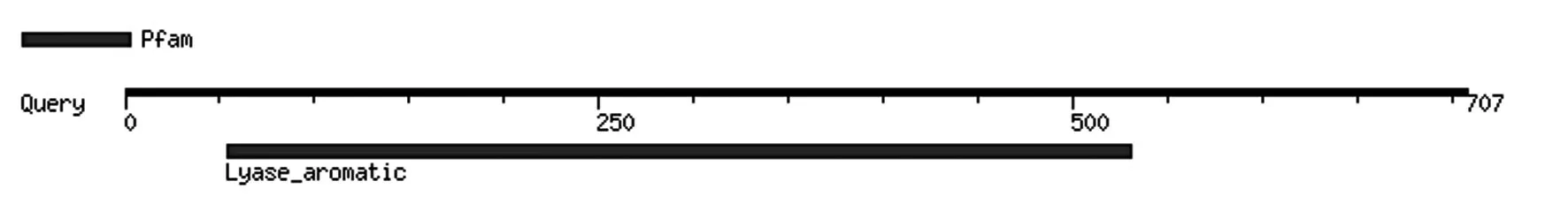
图5 PePAL蛋白的Motif分析Fig.5 Motif analysis of PePAL protein
2.6 PePAL蛋白二级与三级结构预测
利用SOPMA 在线预测PePAL 蛋白二级结构,如图6 所示,PePAL 蛋白二级结构由55.45%氨基酸残基组成α 螺旋,8.63%氨基酸残基组成延伸链,6.22%氨基酸残基组成β转角以及29.70%氨基酸残基组成无规则卷曲,其中无规则卷曲将前三者连接起来。利用在线分析软件SWISS-MODEL 对PePAL蛋白进行三级结构同源建模(图7)。
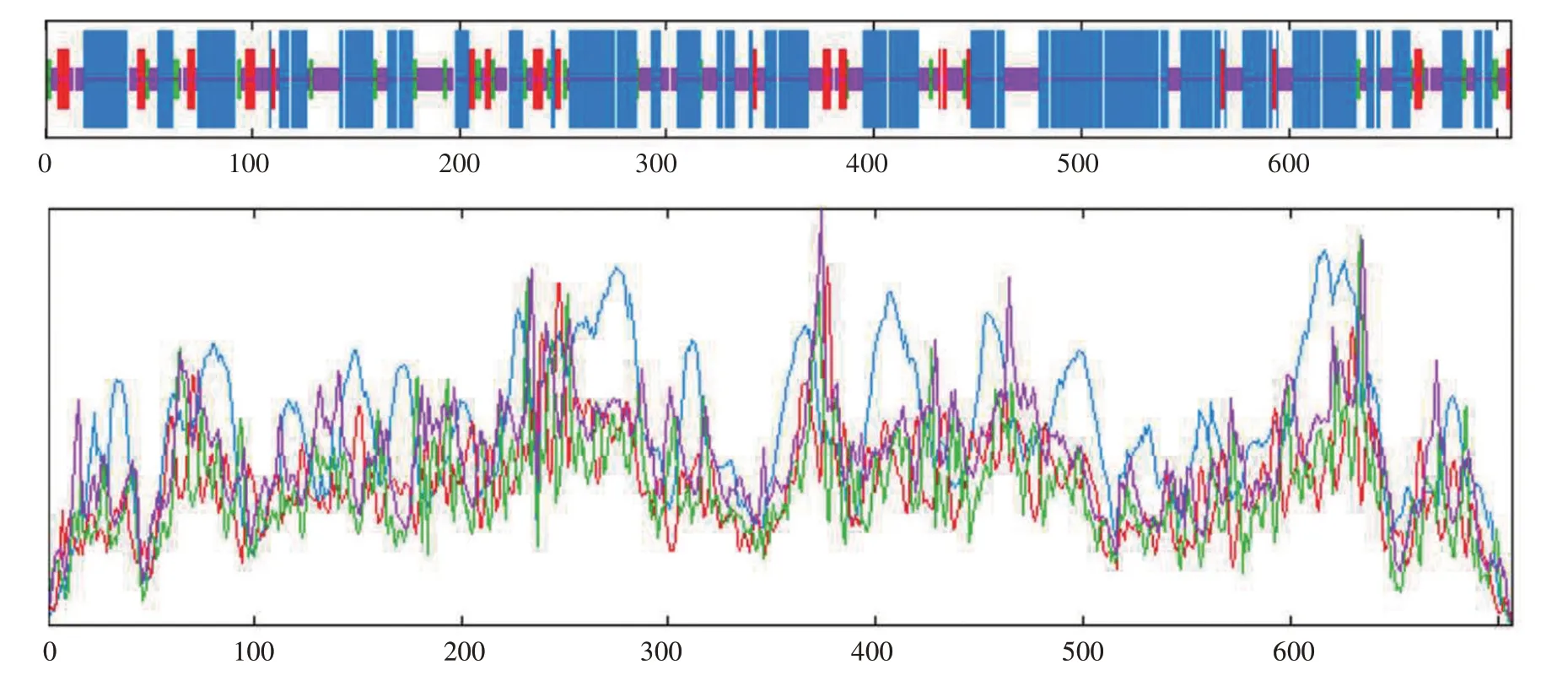
图6 PePAL蛋白二级结构各组成位置及空间构型预测Fig.6 Prediction of positions and spatial configuration of secondary structure of PePAL protein
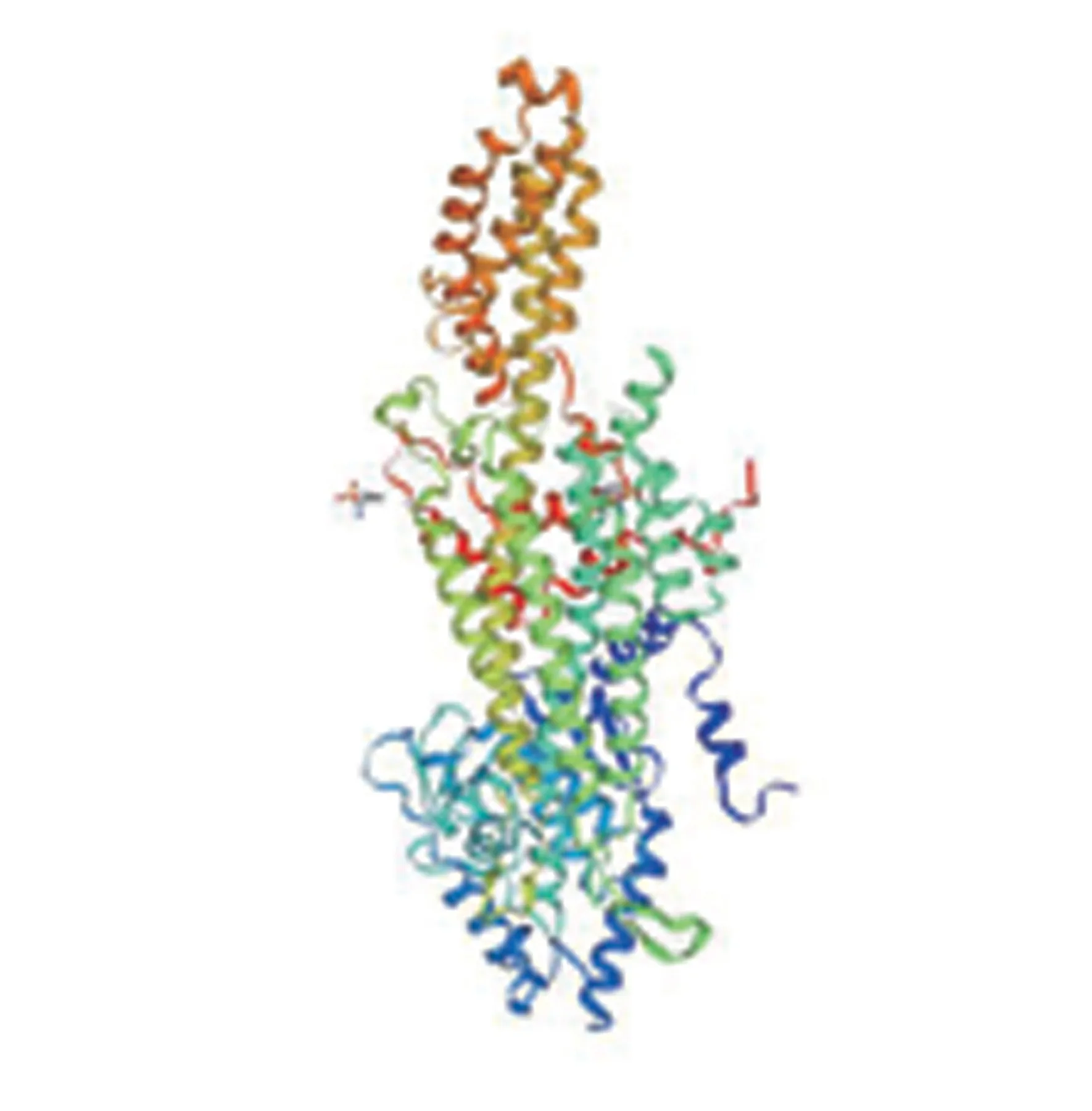
图7 PePAL蛋白三级结构预测模型Fig.7 Prediction model of tertiary structure of PePAL protein
2.7 PePAL基因进化树分析
为研究PePAL与其他植物PAL基因的进化关系,用Clastal W 将PePAL所编码的氨基酸序列与其他植物PAL基因编码的氨基酸序列进行同源比对,采用MEGA 5.05 的相邻法(Neighbor-Joining,NJ)构建系统进化树,结果如图8所示,百香果PePAL与毛白杨(Populus tomentosa)、毛果杨(Populus trichocarpa)、川杨(Populus szechuanica)、胡杨(Populus euphratica)的PAL基因聚为一类,表明百香果PePAL与杨属(Populus)植物的PAL基因亲缘关系较近。
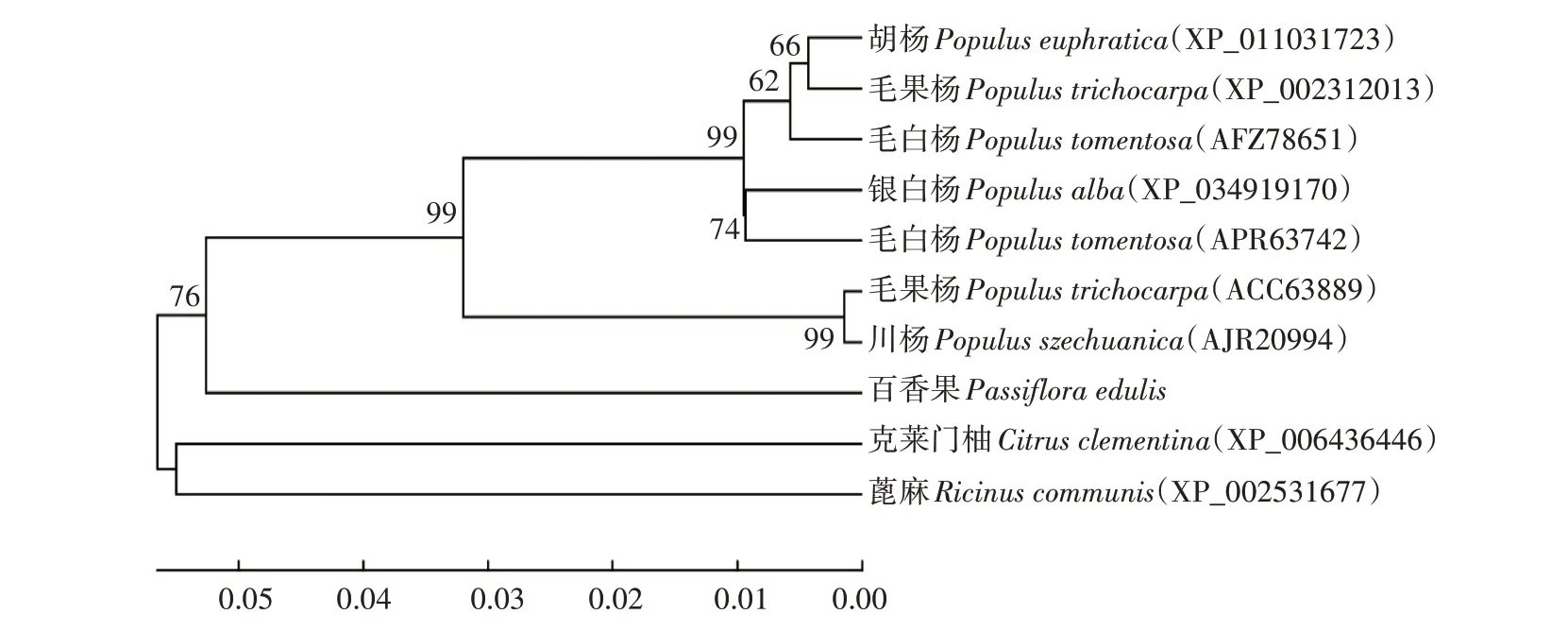
图8 PePAL基因进化树分析Fig.8 Analysis of PePAL gene evolutionary tree
2.8 PePAL在不同品种及不同组织中的相对表达量分析
利用实时荧光定量PCR 技术,以百香果Histone H3为内参基因,分析了PePAL在台农1 号百香果(TN)、大黄金百香果(DHJ)、小黄金百香果(XHJ)中3 级蔓同一结果枝叶、花瓣、果皮、茎的表达情况。从图9 可以看出,PePAL在不同品种百香果的同一结果枝上叶、花瓣、果皮、茎中均有表达,表达量均呈现出花瓣>茎>果皮>叶的变化趋势,但不同品种之间的不同组织表达量存在明显差异,小黄金百香果中花瓣的表达量是叶的7 倍,台农一号百香果中花瓣的表达量是叶的149 倍,而大黄金百香果中花瓣的表达量是叶的798倍。
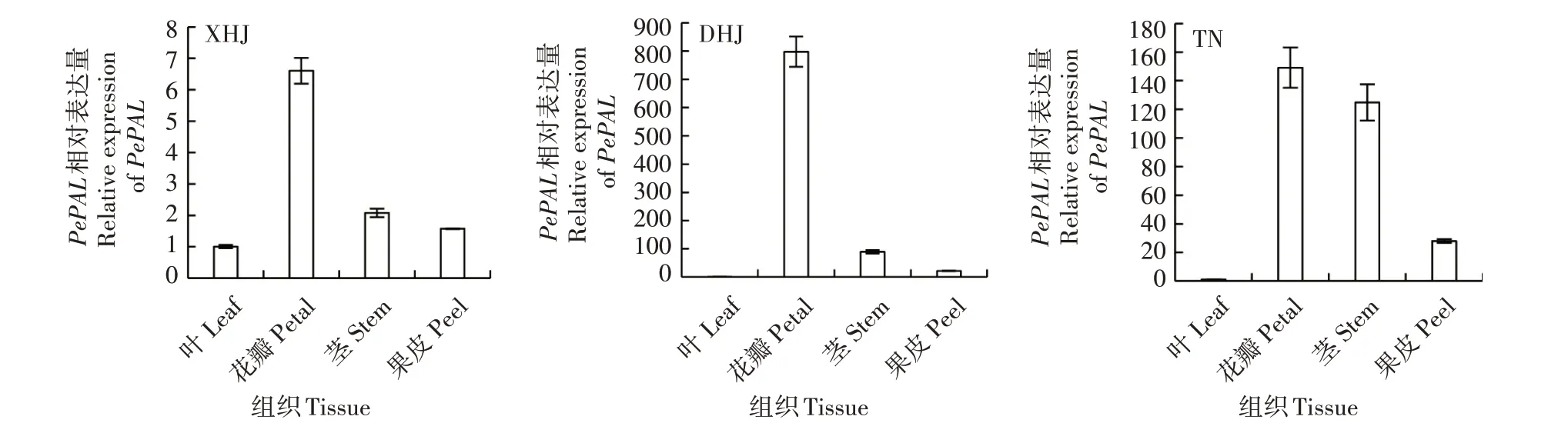
图9 PePAL基因表达量分析Fig.9 Analysis of PePAL gene expression
3 结论与讨论
植物PAL 一般都包含保守的PLN02457、phe_am_lyase、Lyase_aromatic 和PAL-HAL 结构域,且大都含有GTITASGDLVPLSYIAG 酶活性中心序列,其中ASG 是植物PAL 最典型的保守区域[29]。对百香果PePAL 蛋白功能结构域分析,预测到其在54—530 位点存在一个Lyase_aromatic 结构域,在189—205 位 点 含 有 标 志 性 的GTITASGDLVPLSYIAG 酶活性中心序列,表明百香果PAL 是典型的苯丙氨酸解氨酶,属PAL 蛋白质家族的一员。NJ 系统进化树分析结果显示,百香果PePAL编码的氨基酸序列与杨属中的毛白杨、毛果杨、川杨等PAL基因具有较高的同源性,表明PAL作为苯丙烷代谢途径的第1个关键酶在进化过程中保持了足够的遗传稳定性和演化趋同性,这与前人的研究结果一致[30-31]。
PAL 作为胞内酶,在细胞水平上,其主要分布在植物微管组织细胞以及表皮下的细胞中[32];此外,研究还发现,PAL 可在植物高尔基体囊泡和次生壁加厚层中定位到[33]。BARROS 等[34]利用13C 同位素标记发现,二穗短柄草PAL 通过其TAL 活性参与了近50%的木质素合成,表明PAL 在木质素合成途径和细胞壁代谢过程中发挥着重要作用。在亚细胞水平上,植物PAL 主要分布于细胞质、内质网以及叶绿体等细胞结构中[35-37]。本研究中百香果PePAL蛋白亚细胞定位于细胞核、叶绿体、细胞质、细胞膜等细胞器中。研究发现,不同的PAL 异构酶亚细胞定位分析也会呈现出不同的结果,如烟草NtPAL1主要定位于细胞内膜,负责调节肉桂酸的累积;而NtPAL2则主要定位于细胞质,负责将积累的肉桂酸扩散到细胞质中[38]。
大多数植物PAL基因在成熟的花和根部表达量较高,茎表达水平中等,而在成熟的叶片中几乎不表达,表明植物PAL基因的表达具有组织器官特异性。百香果PAL基因与前人研究的黄芪[39]、夏枯草[40]、甘蔗[41]等植物PAL基因表达模式相同,在花中的表达量最高,其次是茎和果皮,在成熟的叶片表达量最低。推测可能是本研究克隆的百香果PAL更多地参与了花青素和木质素的合成过程。通常植物的PAL 是由一个基因家族控制,不同的组织器官含有多种同工酶[42],不同PAL 家族成员之间参与的代谢途径不同,因此表达模式也会有所不同,如何潇等[43]研究半夏PtPAL的表达量时发现,其在叶中表达量最高,其次是块茎和根,花中表达量最低。
综上,本研究利用RACE 技术克隆获得的百香果PePAL基因cDNA 全长2 499 bp,含有一个185 bp的5′-端非翻译区和一个190 bp 的3′-端非翻译区,完整开放阅读框架为2 124 bp,编码的氨基酸序列与杨属中毛白杨、毛果杨、川杨、胡杨PAL基因编码的氨基酸序列具有较高的同源性。PePAL 亚细胞定位在细胞核、叶绿体、细胞质、细胞膜等细胞结构中。PePAL在百香果同一结果枝上的叶、花瓣、果皮、茎中均有表达,基因表达量依次为花瓣>茎>果皮>叶,表明该基因更多地参与了花青素和木质素的合成过程。在百香果中是否存在PAL 家族基因,仍需进一步研究。此外,今后可进一步分析百香果果色或香气合成途径中关键基因的表达模式,为探明百香果PAL基因调控花青素、木质素、香豆酸酯、苯甲酸甲酯等生物合成途径提供生物学证据。
